新人教版高一化学必修第二册第七章第一节《认识有机化合物》第1课时教学课件
文档属性
| 名称 | 新人教版高一化学必修第二册第七章第一节《认识有机化合物》第1课时教学课件 |  | |
| 格式 | zip | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-06 15:33:12 | ||
图片预览








文档简介
(共53张PPT)
第一节 认识有机化合物
第1课时 有机化合物中碳原子的成键特点
烷烃的结构
第七章 有机化合物
上课啦!
学习目标
核心素养
1.知道有机化合物是有空间结构的,以甲烷为例认识有机物中碳原子的成键特点。
2.知道同系物、同分异构体的概念,能根据结构式或结构简式判断它们是否为同分异构体或同系物。?
宏观辨识与微观辨析:
1.能从原子、分子水平分析烷烃的微观特征,能运用化学符号说明同系物、同分异构现象。
2.能从物质的微观角度说明烷烃的结构特征。
3.能用不同的化学符号描述常见的简单有机物。
导入:
目前,在自然界里发现的和由人工合成的有机化合物已经有几千万种,而且新的有机化合物仍在不断地被发现或合成出来。其中,有些物质有特殊的性质和功能,有些物质与人类的生命活动息息相关。为了人类的生存和发展,化学家们不断地对有机化合物进行研究,逐渐揭开了包括生命之谜在内的许多科学奥秘,也使我们的物质世界更加丰富多彩。
通过初中化学的学习,你已经了解到有机化合物具有一些共同的性质,如大多数有机化合物具有熔点和沸点低、难溶于水、可以燃烧等性质。下面以甲烷为例,进一步研究有机化合物的性质。让我们一起走进丰富多彩前景广阔的有机化学世界,去探索知识的奥秘吧!
一、有机化合物中碳原子的成键特点
1.甲烷是最简单的有机化合物,甲烷的分子式为________,
电子式为___________,结构式为___________。
CH4
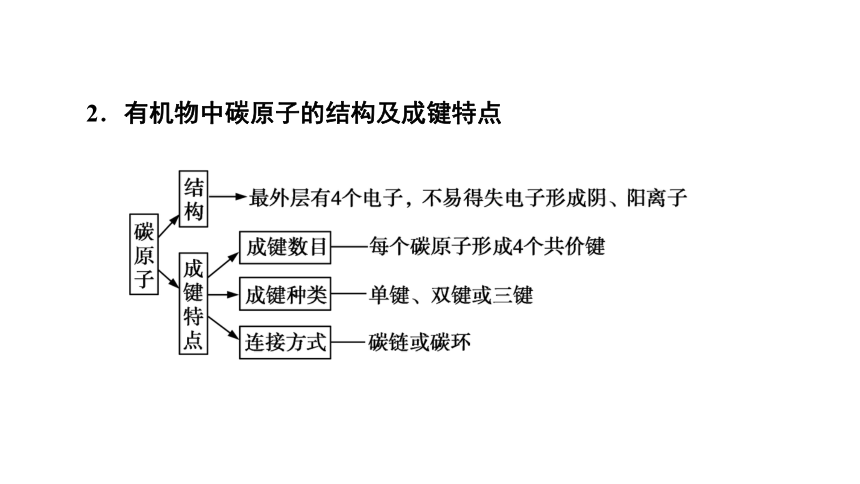
2.有机物中碳原子的结构及成键特点
3.有机物种类繁多的原因
(1)碳原子间成键方式多样
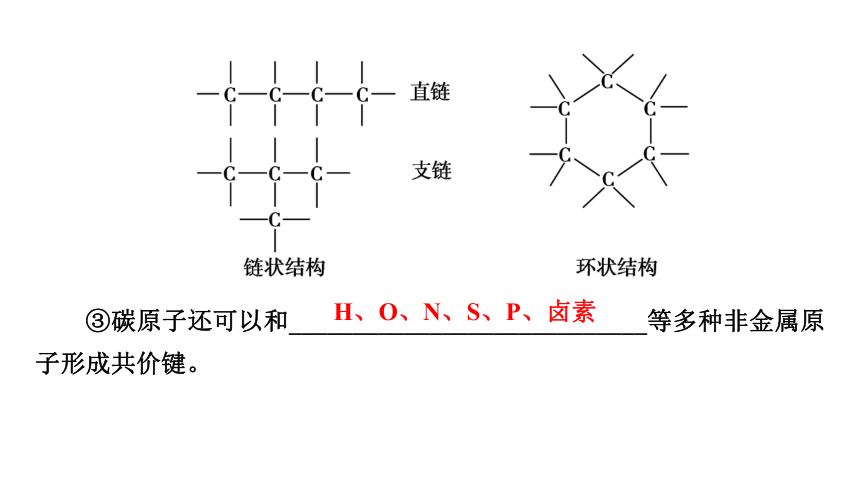
①碳碳之间的结合方式有单键(_________)、双键(_________)、三键(______________)。
②多个碳原子可以相互结合成______状,也可以结合成______状(且可带支链),如下图所示。
—C≡C—
链
环
③碳原子还可以和____________________________等多种非金属原子形成共价键。
H、O、N、S、P、卤素
(2)组成有机物的碳原子数目灵活
有机物分子中可能只含有1个或几个碳原子,也可以含有成千上万个碳原子。
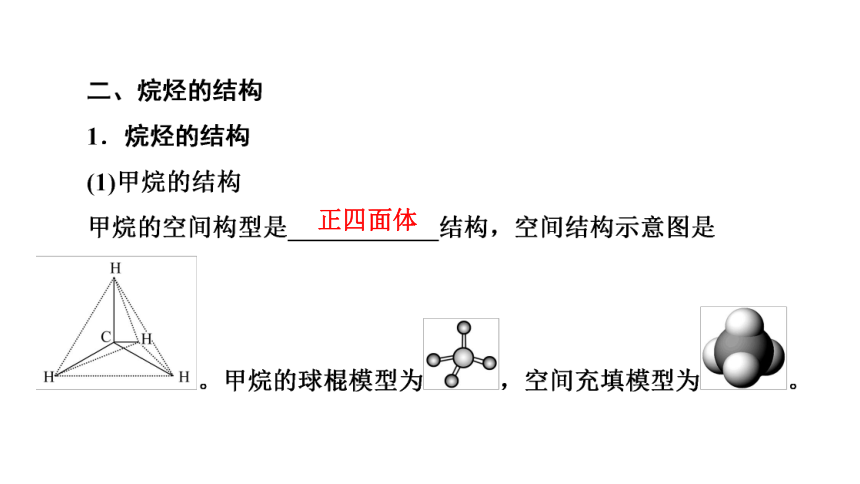
正四面体
(2)烷烃结构上的特点
碳碳单键
链状
氢原子
CnH2n+2(n≥1)
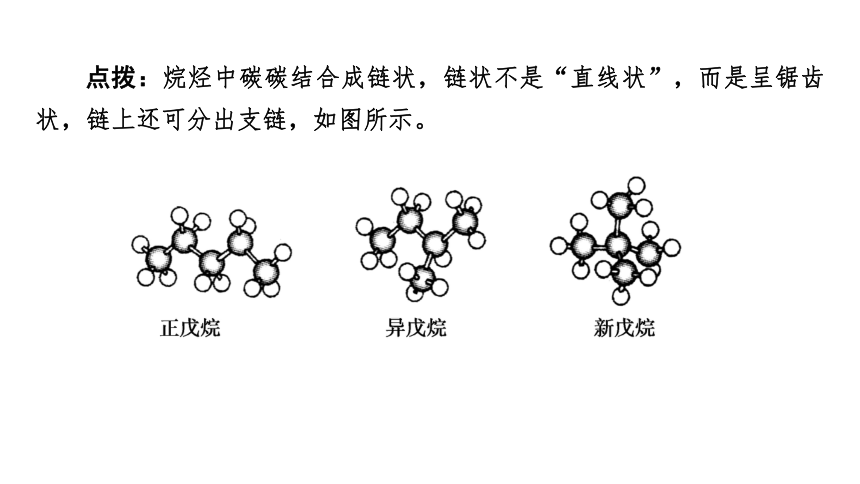
点拨:烷烃中碳碳结合成链状,链状不是“直线状”,而是呈锯齿状,链上还可分出支链,如图所示。
2.烷烃的命名
(1)表示
碳原子数(n)及表示
n≤10
1
2
3
4
5
6
7
8
9
10
_____
_____
_____
_____
_____
_____
_____
_____
_____
_____
n>10
相应汉字数字
甲
乙
丙
丁
戊
己
庚
辛
壬
癸
己烷
十八烷
正丁烷
异丁烷
3.同系物
(1)概念:________相似,在分子组成上相差一个或若干个______________的化合物。
(2)实例:CH4、C2H6、C3H8互为同系物。
(3)判断有机物之间是否互为同系物的方法:
a.同系物间的分子结构相似,属于同一类物质;b.同系物间的组成上相差一个或若干个CH2原子团。
结构
CH2原子团
4.同分异构体
(1)概念
①同分异构现象:化合物具有相同的__________,但具有不同________的现象。
②同分异构体:具有________________的化合物。
(2)写出C4H10的同分异构体:
____________________和__________________。
(3)戊烷的同分异构体有_____种,己烷的同分异构体有_____种。
分子式
结构
同分异构现象
CH3CH2CH2CH3
3
5
小检测:
1.判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)同分异构体具有相同的组成元素。
( )
(2)相对分子质量相同的化合物互为同分异构体。
( )
(3)烷烃都是直线状的。
( )
(4)烷烃都有同分异构体。
( )
√
×
×
×
解析:(1)同分异构体具有相同的分子式,所以组成元素一定相同。
(2)同分异构体具有相同的分子式,相对分子质量一定相同。但相对分子质量相同的化合物不一定是同分异构体。
(3)烷烃的碳原子呈锯齿状。
(4)甲烷、乙烷、丙烷都没有同分异构体。
2.大多数有机物分子里的碳原子与碳原子或碳原子与其他原子相结合的化学键是
( )
A.只有非极性键
B.只有极性键
C.非极性键和极性键
D.只有离子键
解析:因为碳原子有4个价电子,在有机物里,碳原子与碳原子间以非极性键结合,碳原子还可与其它原子形成极性键,所以选C。
C
C
解析:CH3OH中含氧元素,不属烃类,A项错误;烷烃中没有碳碳双键,B项错误;烷烃是链状饱和烃,C项正确,D项错误。
4.下列分子只表示一种物质的是
( )
A.C3H7Cl
B.C3H8
C.C5H12
D.C4H10
B
5.下列分子中,含有极性共价键且呈正四面体结构的是
( )
A.NH3
B.CH2Cl2
C.CCl4
D.P4
C
同系物
问题探究:
1.同系物判断的三个关键点:
知识归纳总结
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14n)。
2.同系物判断的几个“一定”和“不一定”
(1)同系物在分子组成上一定相差一个或若干个“CH2”原子团;但在分子组成上相差一个或若干个“CH2”原子团的有机物不一定是同系物。
(2)同系物具有同一通式,但具有同一通式的有机物不一定是同系物。
(3)同系物的化学性质一定相似,但化学性质相似的物质不一定是同系物。
(4)同系物的相对分子质量一定不相同。
下列关于同系物的说法中,错误的是
( )
A.同系物具有相同的最简式
B.同系物能符合同一通式
C.同系物中,相邻的同系物彼此在组成上相差一个CH2原子团
D.同系物的化学性质基本相似,物理性质随碳原子数增加而呈规律性变化
典例1
A
解析:同系物不一定具有相同的最简式,如甲烷、乙烷、丙烷是烷烃的同系物,其最简式分别是CH4、CH3、C3H8,A项错误;同系物分子式的通式相同,B项正确;由同系物定义知,C项正确;同系物结构相似,化学性质相似,物理性质随碳原子数增加呈规律性变化,D项正确。
变式训练
B
同分异构体的书写与判断
问题探究:
提示:不是同分异构体,由于二者均为四面体结构,为同一种物质。
提示:二者分子式相同,碳原子与碳原子间的连接方式不同,结构不同,是同分异构体;同分异构体可能是不同类的物质,如题干所述两种物质,它们的化学性质不同。
3.丁烷有几种同分异构体?其一氯代物有几种?
提示:丁烷有两种同分异构体,它们分别是正丁烷和异丁烷。其一氯代物共有4种,它们分别是CH3CH2CH2CH2Cl、CH3CH2CHClCH3、(CH3)2CHCH2Cl、(CH3)2CClCH3。
1.烷烃同分异构体的书写规律
(1)方法速记口诀:主链由长到短,支链由整到散,位置由心到边,排列对、邻到间。
(2)书写原则与操作思路:选择最长的碳链为主链;找出中心对称线;碳原子必须满足四个键;主链上的链端不能接甲基,主链上的第二个碳原子或倒数第二个碳原子不能接乙基.否则主链会改变。而容易出现重复结构。
小结:
典例2
B
2.已知某烷烃分子中电子数为42。
(1)该烷烃的分子式为________。
(2)写出该烷烃分子的所有同分异构体的结构简式:
______________________________________________。
变式训练
C5H12
1.烷烃同分异构体的书写——减碳法
(1)遵循的原则
主链由长到短,支链由整到散;位置由心到边,排列对邻到间。
(2)书写的步骤
①先写出碳原子数最多的主链。
②写出少一个碳原子的主链,另一个碳原子作为甲基(—CH3)接在主链某碳原子上。
③写出少两个碳原子的主链,另两个碳原子作为乙基(—CH2CH3)或两个甲基(—CH3)接在主链碳原子上,以此类推。
2.同系物判断的三个关键点
(1)“同”——互为同系物的物质必须属于同一类物质。
(2)“似”——结构相似,是指化学键类型相似,分子中各原子的结合方式相似。
(3)“差”——组成上相差n个CH2原子团(n≥1)。
注意:①同系物一定具有不同的碳原子数(或分子式)。
②同系物一定具有不同的相对分子质量(相差14n)。
3.化学中“四同”比较
?
概念
化学式
结构
性质
同分
异构体
分子式相同、结构不同的化合物
相同,如正丁烷和异丁烷
不同
物理性质不同,化学性质不一定相同
同系物
结构相似,组成相差一个或多个CH2原子团的化合物
组成元素相同,通式相同,相对分子质量相差14n,如C2H6和C3H8等
同一类物质,结构相似
物理性质不同,化学性质相似
(1)互为同系物的是__________________。
(2)互为同分异构体的是________。
(3)互为同位素的是________。
(4)属于同种物质的是________。
解析:(1)结构相似,组成相差一个或多个CH2原子团的一系列化合物互为同系物。(2)分子式相同、结构不同的化合物互为同分异构体。(3)质子数相同、中子数不同的同一元素的不同原子互为同位素。(4)液氯与氯气均为氯气单质。
②④(或⑥)⑦⑩
④⑥
⑧⑨
①③
谢谢大家!
第一节 认识有机化合物
第1课时 有机化合物中碳原子的成键特点
烷烃的结构
第七章 有机化合物
上课啦!
学习目标
核心素养
1.知道有机化合物是有空间结构的,以甲烷为例认识有机物中碳原子的成键特点。
2.知道同系物、同分异构体的概念,能根据结构式或结构简式判断它们是否为同分异构体或同系物。?
宏观辨识与微观辨析:
1.能从原子、分子水平分析烷烃的微观特征,能运用化学符号说明同系物、同分异构现象。
2.能从物质的微观角度说明烷烃的结构特征。
3.能用不同的化学符号描述常见的简单有机物。
导入:
目前,在自然界里发现的和由人工合成的有机化合物已经有几千万种,而且新的有机化合物仍在不断地被发现或合成出来。其中,有些物质有特殊的性质和功能,有些物质与人类的生命活动息息相关。为了人类的生存和发展,化学家们不断地对有机化合物进行研究,逐渐揭开了包括生命之谜在内的许多科学奥秘,也使我们的物质世界更加丰富多彩。
通过初中化学的学习,你已经了解到有机化合物具有一些共同的性质,如大多数有机化合物具有熔点和沸点低、难溶于水、可以燃烧等性质。下面以甲烷为例,进一步研究有机化合物的性质。让我们一起走进丰富多彩前景广阔的有机化学世界,去探索知识的奥秘吧!
一、有机化合物中碳原子的成键特点
1.甲烷是最简单的有机化合物,甲烷的分子式为________,
电子式为___________,结构式为___________。
CH4
2.有机物中碳原子的结构及成键特点
3.有机物种类繁多的原因
(1)碳原子间成键方式多样
①碳碳之间的结合方式有单键(_________)、双键(_________)、三键(______________)。
②多个碳原子可以相互结合成______状,也可以结合成______状(且可带支链),如下图所示。
—C≡C—
链
环
③碳原子还可以和____________________________等多种非金属原子形成共价键。
H、O、N、S、P、卤素
(2)组成有机物的碳原子数目灵活
有机物分子中可能只含有1个或几个碳原子,也可以含有成千上万个碳原子。
正四面体
(2)烷烃结构上的特点
碳碳单键
链状
氢原子
CnH2n+2(n≥1)
点拨:烷烃中碳碳结合成链状,链状不是“直线状”,而是呈锯齿状,链上还可分出支链,如图所示。
2.烷烃的命名
(1)表示
碳原子数(n)及表示
n≤10
1
2
3
4
5
6
7
8
9
10
_____
_____
_____
_____
_____
_____
_____
_____
_____
_____
n>10
相应汉字数字
甲
乙
丙
丁
戊
己
庚
辛
壬
癸
己烷
十八烷
正丁烷
异丁烷
3.同系物
(1)概念:________相似,在分子组成上相差一个或若干个______________的化合物。
(2)实例:CH4、C2H6、C3H8互为同系物。
(3)判断有机物之间是否互为同系物的方法:
a.同系物间的分子结构相似,属于同一类物质;b.同系物间的组成上相差一个或若干个CH2原子团。
结构
CH2原子团
4.同分异构体
(1)概念
①同分异构现象:化合物具有相同的__________,但具有不同________的现象。
②同分异构体:具有________________的化合物。
(2)写出C4H10的同分异构体:
____________________和__________________。
(3)戊烷的同分异构体有_____种,己烷的同分异构体有_____种。
分子式
结构
同分异构现象
CH3CH2CH2CH3
3
5
小检测:
1.判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)同分异构体具有相同的组成元素。
( )
(2)相对分子质量相同的化合物互为同分异构体。
( )
(3)烷烃都是直线状的。
( )
(4)烷烃都有同分异构体。
( )
√
×
×
×
解析:(1)同分异构体具有相同的分子式,所以组成元素一定相同。
(2)同分异构体具有相同的分子式,相对分子质量一定相同。但相对分子质量相同的化合物不一定是同分异构体。
(3)烷烃的碳原子呈锯齿状。
(4)甲烷、乙烷、丙烷都没有同分异构体。
2.大多数有机物分子里的碳原子与碳原子或碳原子与其他原子相结合的化学键是
( )
A.只有非极性键
B.只有极性键
C.非极性键和极性键
D.只有离子键
解析:因为碳原子有4个价电子,在有机物里,碳原子与碳原子间以非极性键结合,碳原子还可与其它原子形成极性键,所以选C。
C
C
解析:CH3OH中含氧元素,不属烃类,A项错误;烷烃中没有碳碳双键,B项错误;烷烃是链状饱和烃,C项正确,D项错误。
4.下列分子只表示一种物质的是
( )
A.C3H7Cl
B.C3H8
C.C5H12
D.C4H10
B
5.下列分子中,含有极性共价键且呈正四面体结构的是
( )
A.NH3
B.CH2Cl2
C.CCl4
D.P4
C
同系物
问题探究:
1.同系物判断的三个关键点:
知识归纳总结
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14n)。
2.同系物判断的几个“一定”和“不一定”
(1)同系物在分子组成上一定相差一个或若干个“CH2”原子团;但在分子组成上相差一个或若干个“CH2”原子团的有机物不一定是同系物。
(2)同系物具有同一通式,但具有同一通式的有机物不一定是同系物。
(3)同系物的化学性质一定相似,但化学性质相似的物质不一定是同系物。
(4)同系物的相对分子质量一定不相同。
下列关于同系物的说法中,错误的是
( )
A.同系物具有相同的最简式
B.同系物能符合同一通式
C.同系物中,相邻的同系物彼此在组成上相差一个CH2原子团
D.同系物的化学性质基本相似,物理性质随碳原子数增加而呈规律性变化
典例1
A
解析:同系物不一定具有相同的最简式,如甲烷、乙烷、丙烷是烷烃的同系物,其最简式分别是CH4、CH3、C3H8,A项错误;同系物分子式的通式相同,B项正确;由同系物定义知,C项正确;同系物结构相似,化学性质相似,物理性质随碳原子数增加呈规律性变化,D项正确。
变式训练
B
同分异构体的书写与判断
问题探究:
提示:不是同分异构体,由于二者均为四面体结构,为同一种物质。
提示:二者分子式相同,碳原子与碳原子间的连接方式不同,结构不同,是同分异构体;同分异构体可能是不同类的物质,如题干所述两种物质,它们的化学性质不同。
3.丁烷有几种同分异构体?其一氯代物有几种?
提示:丁烷有两种同分异构体,它们分别是正丁烷和异丁烷。其一氯代物共有4种,它们分别是CH3CH2CH2CH2Cl、CH3CH2CHClCH3、(CH3)2CHCH2Cl、(CH3)2CClCH3。
1.烷烃同分异构体的书写规律
(1)方法速记口诀:主链由长到短,支链由整到散,位置由心到边,排列对、邻到间。
(2)书写原则与操作思路:选择最长的碳链为主链;找出中心对称线;碳原子必须满足四个键;主链上的链端不能接甲基,主链上的第二个碳原子或倒数第二个碳原子不能接乙基.否则主链会改变。而容易出现重复结构。
小结:
典例2
B
2.已知某烷烃分子中电子数为42。
(1)该烷烃的分子式为________。
(2)写出该烷烃分子的所有同分异构体的结构简式:
______________________________________________。
变式训练
C5H12
1.烷烃同分异构体的书写——减碳法
(1)遵循的原则
主链由长到短,支链由整到散;位置由心到边,排列对邻到间。
(2)书写的步骤
①先写出碳原子数最多的主链。
②写出少一个碳原子的主链,另一个碳原子作为甲基(—CH3)接在主链某碳原子上。
③写出少两个碳原子的主链,另两个碳原子作为乙基(—CH2CH3)或两个甲基(—CH3)接在主链碳原子上,以此类推。
2.同系物判断的三个关键点
(1)“同”——互为同系物的物质必须属于同一类物质。
(2)“似”——结构相似,是指化学键类型相似,分子中各原子的结合方式相似。
(3)“差”——组成上相差n个CH2原子团(n≥1)。
注意:①同系物一定具有不同的碳原子数(或分子式)。
②同系物一定具有不同的相对分子质量(相差14n)。
3.化学中“四同”比较
?
概念
化学式
结构
性质
同分
异构体
分子式相同、结构不同的化合物
相同,如正丁烷和异丁烷
不同
物理性质不同,化学性质不一定相同
同系物
结构相似,组成相差一个或多个CH2原子团的化合物
组成元素相同,通式相同,相对分子质量相差14n,如C2H6和C3H8等
同一类物质,结构相似
物理性质不同,化学性质相似
(1)互为同系物的是__________________。
(2)互为同分异构体的是________。
(3)互为同位素的是________。
(4)属于同种物质的是________。
解析:(1)结构相似,组成相差一个或多个CH2原子团的一系列化合物互为同系物。(2)分子式相同、结构不同的化合物互为同分异构体。(3)质子数相同、中子数不同的同一元素的不同原子互为同位素。(4)液氯与氯气均为氯气单质。
②④(或⑥)⑦⑩
④⑥
⑧⑨
①③
谢谢大家!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
