1.4配制溶液(1、2)(课件 24张PPT)
文档属性
| 名称 | 1.4配制溶液(1、2)(课件 24张PPT) | 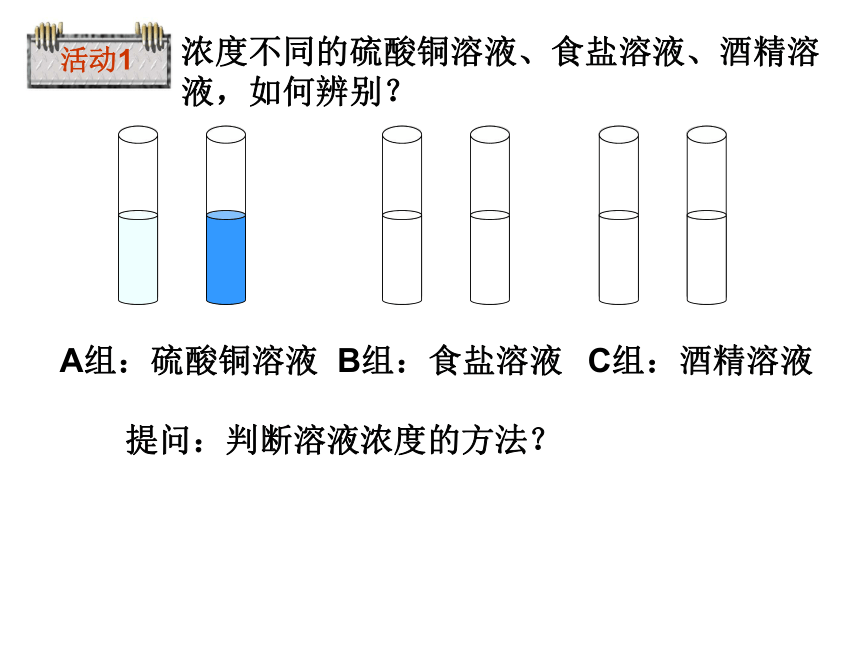 | |
| 格式 | pptx | ||
| 文件大小 | 589.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-03-06 19:09:20 | ||
图片预览






文档简介
浓度不同的硫酸铜溶液、食盐溶液、酒精溶液,如何辨别?
活动1
A组:硫酸铜溶液
B组:食盐溶液
C组:酒精溶液
提问:判断溶液浓度的方法?
方案1
方案2
方案3
方案4
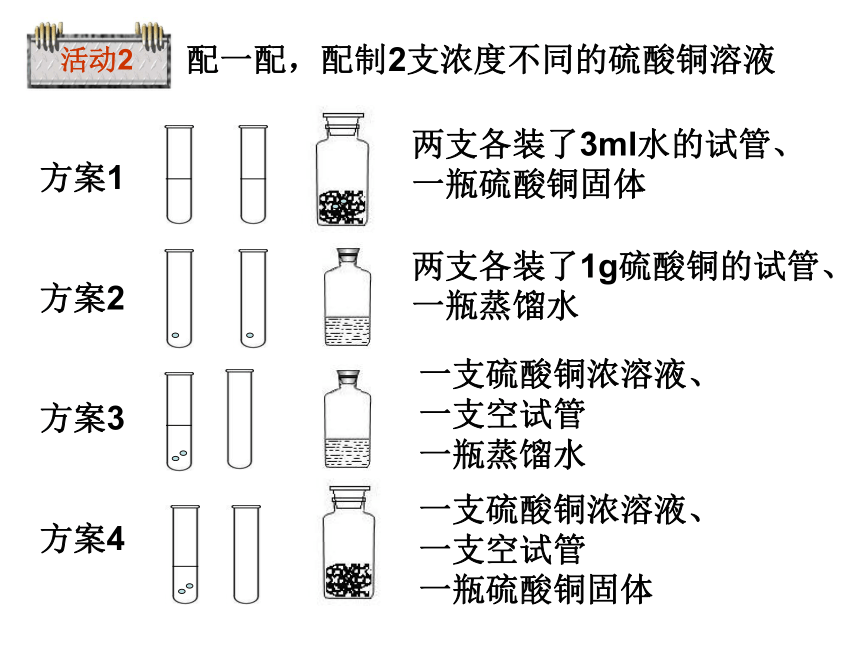
活动2
两支各装了3ml水的试管、一瓶硫酸铜固体
两支各装了1g硫酸铜的试管、一瓶蒸馏水
一支硫酸铜浓溶液、
一支空试管
一瓶蒸馏水
一支硫酸铜浓溶液、
一支空试管
一瓶硫酸铜固体
配一配,配制2支浓度不同的硫酸铜溶液
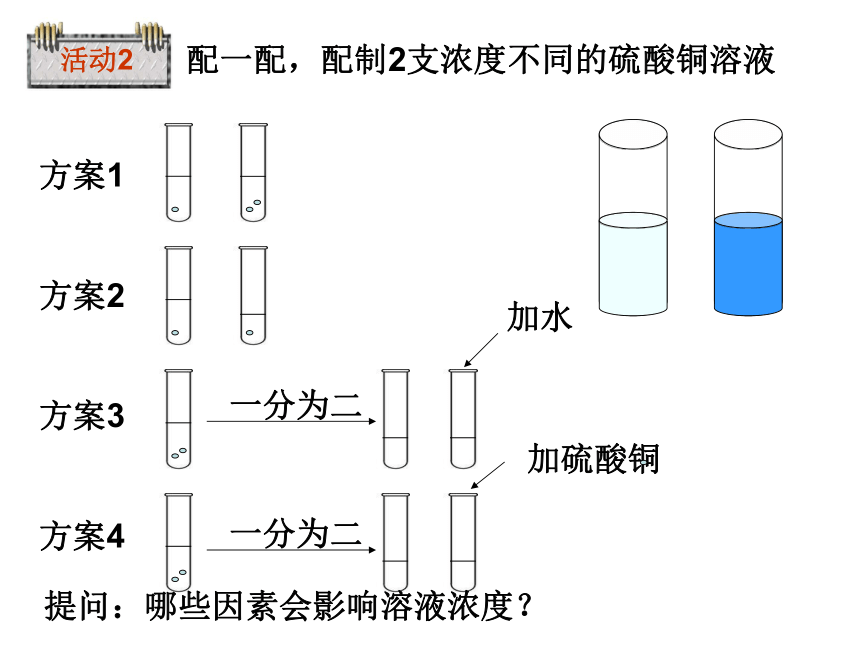
配一配,配制2支浓度不同的硫酸铜溶液
一分为二
方案1
方案2
方案3
方案4
一分为二
加水
加硫酸铜
活动2
提问:哪些因素会影响溶液浓度?
变一变,如何将稀溶液变成浓溶液?
蒸发掉一部分水
加硫酸铜
方案1
方案2
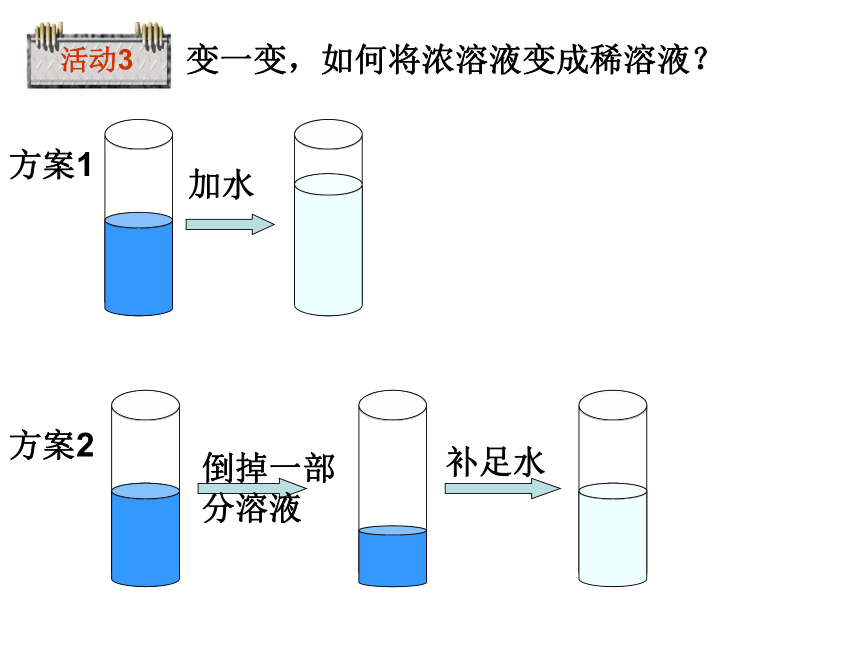
活动3
变一变,如何将浓溶液变成稀溶液?
加水
倒掉一部分溶液
补足水
方案1
方案2
活动3
生理盐水浓度是0.9%。称取0.9克氯化钠,溶解在少量蒸馏水中,并稀释到100毫升。(100ml约等于100g)
消毒酒精浓度是75%。用75体积酒精和25体积的水配制而成。
关注生活
总酸>5.5g/100ml。每100ml醋中醋酸多于5.5g。
实际生活中需要精确地表示溶液的浓度——定性研究
=
溶质的质量
溶液的质量
χ100%
溶质的质量分数
提取概念
=
溶质的体积
溶质的体积+溶剂的体积
χ100%
液体的体积分数
a% =
m溶质
m溶液
× 100%
m溶质
m溶质+m溶剂
× 100%
=
所以科学上用溶质的质量分数来定量的表示溶液的组成(a% 表示把溶液分成100份,那么溶质占了a份)
概念解析
判断
1、100g水中溶解5g氯化钾形成的溶液的溶质的质量分数为5%
2、5ml的硝酸钾溶解在95ml水中形成的溶液的溶质的质量分数5%
3、5g氢氧化钙和95g水混合,得到的溶液的溶质的质量分数为5%
4、5g硝酸铵溶解在95g水中,形成的溶液的溶质的质量分数为5%
错
错
错
对
算一算
例1:求溶质的质量分数
《书》p33 练习1
蒸干35g某氯化钾溶液,得到5g氯化钾,求该溶液的溶质的质量分数?
算一算
变式1:5g氯化钾溶解在100g水中,求所得溶液的溶质的质量分数?
算一算
变式2:将20g 15%的食盐水和20g5%的食盐水混合,求所得溶液的溶质的质量分数?
算一算
例2:求溶质、溶剂质量
《书》P30例题1配制0.9%的氯化钠溶液1500kg,需要蒸馏水和氯化钠各几克?
算一算
变式1:9克氯化钠固体,可以配制0.9%的氯化钠溶液多少?需要加水多少?
算一算
变式2:求右边这瓶硫酸溶液中溶质的质量 ?
=
溶质的质量
溶液的质量
χ100%
变式1
溶质的质量
溶质的质量分数
=
溶液的质量
χ
溶质的质量分数
变式2
溶液的质量
=
溶质的质量
溶质的质量分数
提取概念
算一算
例3:浓溶液稀释配制稀溶液
《书》p30例题2:30g,98%的浓硫酸稀释为20%的稀硫酸需要加水多少克?
提炼:
浓溶液稀释配制稀溶液的过程中溶质的质量保持不变。
算一算
变式:《书》P33练习4
配制15%的盐酸溶液100g,需要市售的36%浓盐酸和水各多少克?
例4:稀溶液配制浓溶液
欲使100g 5%的硝酸钠溶液增大到20%,分别采用下列方法:
⑴ 需加入50%的硝酸钠溶液多少g?
⑵ 需加入硝酸钠固体多少g ?
⑶ 需蒸发水多少g ?
算一算
提炼:找出配置过程中的等量关系
算一算
例5:已知溶解度求溶质的质量分数
20℃时,食盐的溶解度为36g/100g水,把50克食盐放入100克水中,充分溶解,得到溶液中溶质的质量分数是多少?
提炼:饱和溶液的质量分数(S为溶解度)
w% =
S
S+100g
× 100%
算一算
变式:已知t℃时,某饱和溶液的溶质的质量分数是20%,求该温度下该物质的溶解度?
提炼:饱和溶液的质量分数(S为溶解度)
w% =
S
S+100g
× 100%
6、某同学将5克某物质,加到95克水中,所得溶液溶质质量分数为( )
A、小于5% B、等于5%
C、大于 5% D、条件不全,以上答案都不对
D
选一选
7、某同学在某温度下向一定量的水中不断地加入蔗糖,并搅拌。下列图中能正确反应所加入的蔗糖与所得溶液溶质质量分数之间关系的图象是( )
溶质质量分数
溶质质量分数
溶质质量分数
溶质质量分数
A
B
C
D
D
选一选
蔗糖质量
蔗糖质量
蔗糖质量
蔗糖质量
课堂小结
1,溶质质量分数的概念和作用
2,有关溶质质量分数的计算
①计算溶质的质量分数
w% =
m溶质
m溶液
× 100%
m溶质
m溶质+m溶剂
× 100%
=
m溶质=
m溶液×a%
m水 = m稀液 - m浓液
m质1 =m质2
m浓×w1%= m稀×w2%
②计算溶质和溶剂的质量
③有关稀释问题的计算
27℃时配制100g溶质的质量分数为5%的食盐。计算以下4种配制方法需要的药品(计算精确到0.1%)
(1)氯化钠固体和水各需多少克?
(2)溶质的质量分数为10%的氯化钠溶液加入多少水?
(3)溶质的质量分数为2.5%的氯化钠溶液需要蒸发掉多少水?
(4)溶质的质量分数为2.5%的氯化钠溶液需要加入多少氯化钠固体?
(5)溶质的质量分数分别为2.5%和10%的氯化钠溶液各多少克?
课后作业
活动1
A组:硫酸铜溶液
B组:食盐溶液
C组:酒精溶液
提问:判断溶液浓度的方法?
方案1
方案2
方案3
方案4
活动2
两支各装了3ml水的试管、一瓶硫酸铜固体
两支各装了1g硫酸铜的试管、一瓶蒸馏水
一支硫酸铜浓溶液、
一支空试管
一瓶蒸馏水
一支硫酸铜浓溶液、
一支空试管
一瓶硫酸铜固体
配一配,配制2支浓度不同的硫酸铜溶液
配一配,配制2支浓度不同的硫酸铜溶液
一分为二
方案1
方案2
方案3
方案4
一分为二
加水
加硫酸铜
活动2
提问:哪些因素会影响溶液浓度?
变一变,如何将稀溶液变成浓溶液?
蒸发掉一部分水
加硫酸铜
方案1
方案2
活动3
变一变,如何将浓溶液变成稀溶液?
加水
倒掉一部分溶液
补足水
方案1
方案2
活动3
生理盐水浓度是0.9%。称取0.9克氯化钠,溶解在少量蒸馏水中,并稀释到100毫升。(100ml约等于100g)
消毒酒精浓度是75%。用75体积酒精和25体积的水配制而成。
关注生活
总酸>5.5g/100ml。每100ml醋中醋酸多于5.5g。
实际生活中需要精确地表示溶液的浓度——定性研究
=
溶质的质量
溶液的质量
χ100%
溶质的质量分数
提取概念
=
溶质的体积
溶质的体积+溶剂的体积
χ100%
液体的体积分数
a% =
m溶质
m溶液
× 100%
m溶质
m溶质+m溶剂
× 100%
=
所以科学上用溶质的质量分数来定量的表示溶液的组成(a% 表示把溶液分成100份,那么溶质占了a份)
概念解析
判断
1、100g水中溶解5g氯化钾形成的溶液的溶质的质量分数为5%
2、5ml的硝酸钾溶解在95ml水中形成的溶液的溶质的质量分数5%
3、5g氢氧化钙和95g水混合,得到的溶液的溶质的质量分数为5%
4、5g硝酸铵溶解在95g水中,形成的溶液的溶质的质量分数为5%
错
错
错
对
算一算
例1:求溶质的质量分数
《书》p33 练习1
蒸干35g某氯化钾溶液,得到5g氯化钾,求该溶液的溶质的质量分数?
算一算
变式1:5g氯化钾溶解在100g水中,求所得溶液的溶质的质量分数?
算一算
变式2:将20g 15%的食盐水和20g5%的食盐水混合,求所得溶液的溶质的质量分数?
算一算
例2:求溶质、溶剂质量
《书》P30例题1配制0.9%的氯化钠溶液1500kg,需要蒸馏水和氯化钠各几克?
算一算
变式1:9克氯化钠固体,可以配制0.9%的氯化钠溶液多少?需要加水多少?
算一算
变式2:求右边这瓶硫酸溶液中溶质的质量 ?
=
溶质的质量
溶液的质量
χ100%
变式1
溶质的质量
溶质的质量分数
=
溶液的质量
χ
溶质的质量分数
变式2
溶液的质量
=
溶质的质量
溶质的质量分数
提取概念
算一算
例3:浓溶液稀释配制稀溶液
《书》p30例题2:30g,98%的浓硫酸稀释为20%的稀硫酸需要加水多少克?
提炼:
浓溶液稀释配制稀溶液的过程中溶质的质量保持不变。
算一算
变式:《书》P33练习4
配制15%的盐酸溶液100g,需要市售的36%浓盐酸和水各多少克?
例4:稀溶液配制浓溶液
欲使100g 5%的硝酸钠溶液增大到20%,分别采用下列方法:
⑴ 需加入50%的硝酸钠溶液多少g?
⑵ 需加入硝酸钠固体多少g ?
⑶ 需蒸发水多少g ?
算一算
提炼:找出配置过程中的等量关系
算一算
例5:已知溶解度求溶质的质量分数
20℃时,食盐的溶解度为36g/100g水,把50克食盐放入100克水中,充分溶解,得到溶液中溶质的质量分数是多少?
提炼:饱和溶液的质量分数(S为溶解度)
w% =
S
S+100g
× 100%
算一算
变式:已知t℃时,某饱和溶液的溶质的质量分数是20%,求该温度下该物质的溶解度?
提炼:饱和溶液的质量分数(S为溶解度)
w% =
S
S+100g
× 100%
6、某同学将5克某物质,加到95克水中,所得溶液溶质质量分数为( )
A、小于5% B、等于5%
C、大于 5% D、条件不全,以上答案都不对
D
选一选
7、某同学在某温度下向一定量的水中不断地加入蔗糖,并搅拌。下列图中能正确反应所加入的蔗糖与所得溶液溶质质量分数之间关系的图象是( )
溶质质量分数
溶质质量分数
溶质质量分数
溶质质量分数
A
B
C
D
D
选一选
蔗糖质量
蔗糖质量
蔗糖质量
蔗糖质量
课堂小结
1,溶质质量分数的概念和作用
2,有关溶质质量分数的计算
①计算溶质的质量分数
w% =
m溶质
m溶液
× 100%
m溶质
m溶质+m溶剂
× 100%
=
m溶质=
m溶液×a%
m水 = m稀液 - m浓液
m质1 =m质2
m浓×w1%= m稀×w2%
②计算溶质和溶剂的质量
③有关稀释问题的计算
27℃时配制100g溶质的质量分数为5%的食盐。计算以下4种配制方法需要的药品(计算精确到0.1%)
(1)氯化钠固体和水各需多少克?
(2)溶质的质量分数为10%的氯化钠溶液加入多少水?
(3)溶质的质量分数为2.5%的氯化钠溶液需要蒸发掉多少水?
(4)溶质的质量分数为2.5%的氯化钠溶液需要加入多少氯化钠固体?
(5)溶质的质量分数分别为2.5%和10%的氯化钠溶液各多少克?
课后作业
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
