四川省雅安高中2020-2021学年高一下学期开学考试化学试题 Word版缺答案
文档属性
| 名称 | 四川省雅安高中2020-2021学年高一下学期开学考试化学试题 Word版缺答案 |  | |
| 格式 | docx | ||
| 文件大小 | 191.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-08 20:51:46 | ||
图片预览




文档简介
雅安中学高2020级高一下期入学考试
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
可能用到的相对原子质量:C:12 O:16 Ag:108
第I卷(选择题 共42分)
一、单项选择题(本题共21小题,每小题2分,共42分)
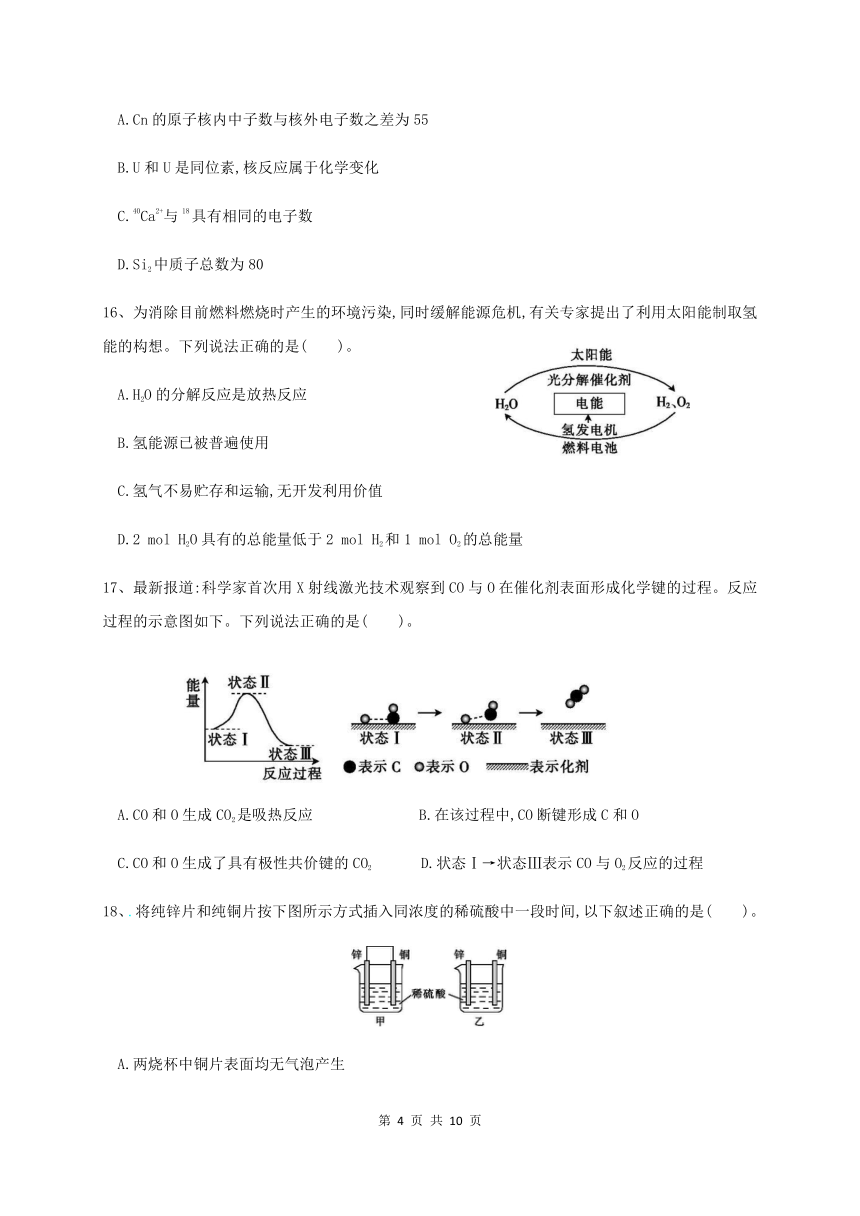
1、为纪念编制元素周期表的俄国化学家,人们把第101号元素命名为钔(元素符号为Md),这位科学家是( )。
A.拉瓦锡 B.阿伏加德罗 C.门捷列夫 D.道尔顿
2、下列有关元素周期表的说法正确的是( )。
A.元素周期表有七个周期
B.元素周期表有18个族
C.ⅠA族的元素全部是金属元素
D.短周期是指第一、二、三、四周期
3、下列各原子结构示意图中所表示的核外电子排布正确的是( )
4、下列关于原子结构的叙述中正确的是( )。
A.所有的原子核都由质子和中子构成 B.原子的最外层电子数不超过8
C.稀有气体原子的最外层电子数均为8 D.原子的次外层电子数都是8
5、下列反应既是氧化还原反应,又是放热反应的是( )。
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.NaOH溶液滴定稀盐酸的反应
D.红热的焦炭与水蒸气的反应
6、下列判断正确的是( )。
A.核电荷数:AlAl
C.原子序数:Na>Cl D.原子半径:Cl>Na
7、下列物质不是离子化合物的是( )。
A.KCl B.CO2
C.NH4Cl D.Na2SO4
8、下列说法正确的是( )。
A.微粒半径大小:Na>Na+ B.碱性强弱:NaOHC.酸性强弱:H2SO4>HClO4 D.最高正价:P>S>Cl
9、下列说法中,不符合ⅦA族元素性质特征的是( )。
A.从上到下原子半径逐渐减小
B.易形成-1价离子
C.最高价氧化物对应的水化物呈酸性
D.从上到下氢化物的稳定性逐渐减弱
10、下列各组中,互为同位素关系的是( )。
A.金刚石与石墨 B.T2O与H2O
C.40K与39K D.16O与16O2-
11、.钠和锂有相似的化学性质,下列说法中能较好地解释这个事实的是( )。
A.都是金属元素 B.原子半径相差不大
C.原子的最外层电子数相同 D.化合价相同
12、下列关于卤素(用X表示)的叙述正确的是( )。
A.卤素单质与水反应均可用X2+H2OHXO+HX表示
B.HX都极易溶于水,它们的热稳定性随核电荷数的增加而增强
C.卤素单质的颜色从F2→I2随相对分子质量的增大而加深
D.还原性F-从其盐溶液里置换出来
13、镭元素位于元素周期表第七周期第ⅡA族。下列关于镭的性质的说法不正确的是( )。
A.氢氧化物呈两性
B.单质与水反应放出氢气
C.在化合物中呈+2价
D.单质的还原性比镁强
378587039179514、Y、Z、U、W为四种短周期非金属元素,它们的原子半径与原子序数的关系如图所示,其中W的单质呈黄绿色。下列有关这四种元素的单质的用途说法不正确的是( )。
A.W的单质可用于自来水消毒
B.U的单质为光导纤维的主要成分
C.Z的单质可用作氧化剂
D.Y的单质可用作灯泡保护气
15、.已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将第112号元素的符号定为“Cn”,汉语名为“”;②合理利用核能符合“低碳经济”的要求U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β-锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列对上述表述所涉及元素的说法正确的是( )。
A.Cn的原子核内中子数与核外电子数之差为55
B.U和U是同位素,核反应属于化学变化
C.40Ca2+与18具有相同的电子数
D.Si2中质子总数为80
346011542862516、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )。
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2的总能量
17、最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下。下列说法正确的是( )。
58737557150A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
18、.将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )。
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.产生气泡的速率甲比乙慢
19、已知化学反应2C(s)+O2(g)2CO(g)、2CO(g)+O2(g)2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )。
A.12 g C(s)所具有的能量一定高于28 g CO(g)所具有的能量
B.56 g CO(g)和32 g O2(g)所具有的总能量大于88 g CO2(g)所具有的总能量
C.12 g C(s)和32 g O2(g)所具有的总能量大于44 g CO2(g)所具有的总能量
D.将一定质量的C(s)燃烧,生成CO2(g)放出的热量比生成CO(g)时多
20、将4 mol A(g)和2 mol B(g)置于2 L的密闭容器中,混合后发生反应2A(g)+B(g)2C (g)。若经2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )。
A.用物质A表示的反应速率为0.6 mol·L-1·s-1
B.用物质B表示的反应速率为0.3 mol·L-1·s-1
C.2 s时物质A的转化率为30%
D.2 s时物质B的浓度为0.3 mol·L-1
21、下列说法正确的是( )。
A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
第II卷(非选择题 共58分)
22、根据如图所示的元素周期表回答下列问题:
(1)在上图的元素周期表中,全部是金属元素的区域为 (填字母)。?
A.Ⅰ区 B.Ⅱ区 C.Ⅲ区 D.Ⅳ区
(2)表中所列元素中化学性质最不活泼的是 (填元素符号,下同)元素。?
(3)表中所列元素中只有负化合价而无正化合价的是 。?
(4)表中所列元素中最高价氧化物对应水化物呈两性的是 (填化学式,下同),写出它分别与a、l的最高价氧化物对应的水化物反应的离子方程式: 、 。?
(5)a、c的最高价氧化物对应水化物的碱性: > 。?
23、依据化学能与热能的相关知识回答下列问题:
Ⅰ、键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。如H—H键的键能是436 kJ·mol-1,是指使1 mol H2分子变成2 mol H原子需要吸收436 kJ的能量。
(1)已知H—Cl键的键能为431 kJ·mol-1,下列叙述正确的是 (填字母,下同)。?
A.每生成1 mol H—Cl键放出431 kJ能量
B.每生成1 mol H—Cl键吸收431 kJ能量
C.每拆开1 mol H—Cl键放出431 kJ能量
D.每拆开1 mol H—Cl键吸收431 kJ能量
(2)已知键能:H—H键为436 kJ·mol-1;H—F键为565 kJ·mol-1;H—Cl键为431 kJ·mol-1;H—Br键为366 kJ·mol-1。则下列分子受热时最稳定的是 。?
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是 。?
A.氮气的化学性质比氧气稳定
B.常温常压下溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
Ⅱ、已知化学反应N2+3H22NH3的能量变化如图所示,回答下列问题:
(1)1 mol N原子和3 mol H原子生成1 mol NH3(g)的过程 (填“吸收”或“放出”)________kJ能量。?
(2)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程 (填“吸收”或“放出”)_________kJ能量。?
(3)1 mol NH3(l)生成1 mol N原子和3 mol H原子的过程 (填“吸收”或“放出”)________kJ能量。?
24、根据化学能转化电能的相关知识,回答下列问题:
Ⅰ、理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是 ,发生 (填“氧化”或“还原”)反应,电解质溶液是 。?
(2)正极上出现的现象是 。?
(3)若导线上转移电子1 mol,则生成银 g。?
Ⅱ、有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式: 。
(2)乙中负极为 ,总反应的离子方程式: 。
(3)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有 。?
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
25、根据化学反应速率和和化学反应限度的知识回答下列问题:
Ⅰ、某温度时,在2 L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化的曲线如图所示:
(1)该反应的化学方程式为 。?
(2)反应开始至4 min时,A的平均反应速率为 。?
(3)4 min时,反应是否达平衡状态? (填“是”或“否”),8 min时,v正 (填“>”“<”或“=”)v逆。?
Ⅱ、氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g)2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为 。?
(2)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为 。?
②反应达到平衡时,放出的热量 (填字母,下同)。?
A.小于92.4 kJ
B.等于92.4 kJ
C.大于92.4 kJ
D.可能大于、小于或等于92.4 kJ
(3)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为 。?
A.压强不变
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1∶3∶2
D.混合气体的质量不变
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
可能用到的相对原子质量:C:12 O:16 Ag:108
第I卷(选择题 共42分)
一、单项选择题(本题共21小题,每小题2分,共42分)
1、为纪念编制元素周期表的俄国化学家,人们把第101号元素命名为钔(元素符号为Md),这位科学家是( )。
A.拉瓦锡 B.阿伏加德罗 C.门捷列夫 D.道尔顿
2、下列有关元素周期表的说法正确的是( )。
A.元素周期表有七个周期
B.元素周期表有18个族
C.ⅠA族的元素全部是金属元素
D.短周期是指第一、二、三、四周期
3、下列各原子结构示意图中所表示的核外电子排布正确的是( )
4、下列关于原子结构的叙述中正确的是( )。
A.所有的原子核都由质子和中子构成 B.原子的最外层电子数不超过8
C.稀有气体原子的最外层电子数均为8 D.原子的次外层电子数都是8
5、下列反应既是氧化还原反应,又是放热反应的是( )。
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.NaOH溶液滴定稀盐酸的反应
D.红热的焦炭与水蒸气的反应
6、下列判断正确的是( )。
A.核电荷数:Al
C.原子序数:Na>Cl D.原子半径:Cl>Na
7、下列物质不是离子化合物的是( )。
A.KCl B.CO2
C.NH4Cl D.Na2SO4
8、下列说法正确的是( )。
A.微粒半径大小:Na>Na+ B.碱性强弱:NaOH
9、下列说法中,不符合ⅦA族元素性质特征的是( )。
A.从上到下原子半径逐渐减小
B.易形成-1价离子
C.最高价氧化物对应的水化物呈酸性
D.从上到下氢化物的稳定性逐渐减弱
10、下列各组中,互为同位素关系的是( )。
A.金刚石与石墨 B.T2O与H2O
C.40K与39K D.16O与16O2-
11、.钠和锂有相似的化学性质,下列说法中能较好地解释这个事实的是( )。
A.都是金属元素 B.原子半径相差不大
C.原子的最外层电子数相同 D.化合价相同
12、下列关于卤素(用X表示)的叙述正确的是( )。
A.卤素单质与水反应均可用X2+H2OHXO+HX表示
B.HX都极易溶于水,它们的热稳定性随核电荷数的增加而增强
C.卤素单质的颜色从F2→I2随相对分子质量的增大而加深
D.还原性F-
13、镭元素位于元素周期表第七周期第ⅡA族。下列关于镭的性质的说法不正确的是( )。
A.氢氧化物呈两性
B.单质与水反应放出氢气
C.在化合物中呈+2价
D.单质的还原性比镁强
378587039179514、Y、Z、U、W为四种短周期非金属元素,它们的原子半径与原子序数的关系如图所示,其中W的单质呈黄绿色。下列有关这四种元素的单质的用途说法不正确的是( )。
A.W的单质可用于自来水消毒
B.U的单质为光导纤维的主要成分
C.Z的单质可用作氧化剂
D.Y的单质可用作灯泡保护气
15、.已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将第112号元素的符号定为“Cn”,汉语名为“”;②合理利用核能符合“低碳经济”的要求U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β-锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列对上述表述所涉及元素的说法正确的是( )。
A.Cn的原子核内中子数与核外电子数之差为55
B.U和U是同位素,核反应属于化学变化
C.40Ca2+与18具有相同的电子数
D.Si2中质子总数为80
346011542862516、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )。
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2的总能量
17、最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下。下列说法正确的是( )。
58737557150A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
18、.将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )。
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.产生气泡的速率甲比乙慢
19、已知化学反应2C(s)+O2(g)2CO(g)、2CO(g)+O2(g)2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )。
A.12 g C(s)所具有的能量一定高于28 g CO(g)所具有的能量
B.56 g CO(g)和32 g O2(g)所具有的总能量大于88 g CO2(g)所具有的总能量
C.12 g C(s)和32 g O2(g)所具有的总能量大于44 g CO2(g)所具有的总能量
D.将一定质量的C(s)燃烧,生成CO2(g)放出的热量比生成CO(g)时多
20、将4 mol A(g)和2 mol B(g)置于2 L的密闭容器中,混合后发生反应2A(g)+B(g)2C (g)。若经2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )。
A.用物质A表示的反应速率为0.6 mol·L-1·s-1
B.用物质B表示的反应速率为0.3 mol·L-1·s-1
C.2 s时物质A的转化率为30%
D.2 s时物质B的浓度为0.3 mol·L-1
21、下列说法正确的是( )。
A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
第II卷(非选择题 共58分)
22、根据如图所示的元素周期表回答下列问题:
(1)在上图的元素周期表中,全部是金属元素的区域为 (填字母)。?
A.Ⅰ区 B.Ⅱ区 C.Ⅲ区 D.Ⅳ区
(2)表中所列元素中化学性质最不活泼的是 (填元素符号,下同)元素。?
(3)表中所列元素中只有负化合价而无正化合价的是 。?
(4)表中所列元素中最高价氧化物对应水化物呈两性的是 (填化学式,下同),写出它分别与a、l的最高价氧化物对应的水化物反应的离子方程式: 、 。?
(5)a、c的最高价氧化物对应水化物的碱性: > 。?
23、依据化学能与热能的相关知识回答下列问题:
Ⅰ、键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。如H—H键的键能是436 kJ·mol-1,是指使1 mol H2分子变成2 mol H原子需要吸收436 kJ的能量。
(1)已知H—Cl键的键能为431 kJ·mol-1,下列叙述正确的是 (填字母,下同)。?
A.每生成1 mol H—Cl键放出431 kJ能量
B.每生成1 mol H—Cl键吸收431 kJ能量
C.每拆开1 mol H—Cl键放出431 kJ能量
D.每拆开1 mol H—Cl键吸收431 kJ能量
(2)已知键能:H—H键为436 kJ·mol-1;H—F键为565 kJ·mol-1;H—Cl键为431 kJ·mol-1;H—Br键为366 kJ·mol-1。则下列分子受热时最稳定的是 。?
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是 。?
A.氮气的化学性质比氧气稳定
B.常温常压下溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
Ⅱ、已知化学反应N2+3H22NH3的能量变化如图所示,回答下列问题:
(1)1 mol N原子和3 mol H原子生成1 mol NH3(g)的过程 (填“吸收”或“放出”)________kJ能量。?
(2)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程 (填“吸收”或“放出”)_________kJ能量。?
(3)1 mol NH3(l)生成1 mol N原子和3 mol H原子的过程 (填“吸收”或“放出”)________kJ能量。?
24、根据化学能转化电能的相关知识,回答下列问题:
Ⅰ、理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是 ,发生 (填“氧化”或“还原”)反应,电解质溶液是 。?
(2)正极上出现的现象是 。?
(3)若导线上转移电子1 mol,则生成银 g。?
Ⅱ、有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式: 。
(2)乙中负极为 ,总反应的离子方程式: 。
(3)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有 。?
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
25、根据化学反应速率和和化学反应限度的知识回答下列问题:
Ⅰ、某温度时,在2 L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化的曲线如图所示:
(1)该反应的化学方程式为 。?
(2)反应开始至4 min时,A的平均反应速率为 。?
(3)4 min时,反应是否达平衡状态? (填“是”或“否”),8 min时,v正 (填“>”“<”或“=”)v逆。?
Ⅱ、氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g)2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为 。?
(2)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为 。?
②反应达到平衡时,放出的热量 (填字母,下同)。?
A.小于92.4 kJ
B.等于92.4 kJ
C.大于92.4 kJ
D.可能大于、小于或等于92.4 kJ
(3)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为 。?
A.压强不变
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1∶3∶2
D.混合气体的质量不变
同课章节目录
