6.2.1化学反应的速率 同步练习-云南省弥勒市第一中学2020-2021学年高一化学人教版(2019)必修第二册
文档属性
| 名称 | 6.2.1化学反应的速率 同步练习-云南省弥勒市第一中学2020-2021学年高一化学人教版(2019)必修第二册 |

|
|
| 格式 | doc | ||
| 文件大小 | 394.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-09 00:00:00 | ||
图片预览



文档简介
第二节 化学反应的速率与限度
第1课时 化学反应的速率
一、单选题
1.下列关于化学反应速率的说法正确的是( )
A.增加反应物的量、提高反应温度都能增大反应速率
B.化学反应速率为0.8是指1s时某物质的浓度为0.8
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.决定反应速率的主要因素是反应物的浓度
2.对于化学反应来说,下列有关说法不正确的是( )
A.增加木炭的物质的量,化学反应速率会加快
B.升高温度,化学反应速率会加快
C.将反应容器的容积缩小,化学反应速率会加快
D.将木炭粉碎成粉末状,化学反应速率会加快
3.对于可逆反应2A(g)+3B(g)4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=1.0 mol·L-1·min-1 B.v(B)=1.8 mol·L-1·min-1
C.v(D)=0.2 mol·L-1·s-1 D.v(C)=0.6 mol·L-1·min-1
4.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应,经2min后测得D的浓度为0.5,,以C表示的平均速率,下列说法正确的是( )
A.反应速率 B.该反应方程式中x=1
C.2min时,A的物质的量为1.5 D.2min时,B的物质的量为0.5
5.反应在一容积可变的密闭容器中进行,下列条件的改变对反应速率几乎没有影响的是( )
A.保持体积不变,充入氮气使体系的压强增大 B.升温
C.将容器的体积缩小为一半 D.保持体积不变,增加的量
6.已知,反应速率分别用、、、表示,正确的是( )
A. B.
C. D.
7.下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.NH3的催化氧化是一个放热的反应,所以,升高温度,反应的速率减慢
D.在一定温度下固定容积的容器中,发生SO2的催化反应,充入He,反应速率不变
8.在C(s)+CO2(g)2CO(g)反应中可使反应速率增大的措施是?(?? )
①缩小容器的体积 ②增加碳的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥通入CO
A.①③⑤ B.②④⑥ C.①③⑥ D.③⑤⑥
二、填空题
9.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10s,X的物质的量减少了_______ mol,Z的物质的量浓度增大了 _______ ?mol/L,用Z表示的反应速率为 _______ ?mol/(L?s)。
(2)该曲线对应的化学方程式:_______(用X、Y、Z表示)
10.为探究化学反应速率的影响因素,学生设计了锌与过量的c mol/L 100mL盐酸起反应的实验,得到了下面的结果:
序号 锌的质量/g 锌的形状 温度/℃ 完全溶解于酸的时间/s
① 2.0 薄片 15 200
② 2.0 薄片 25 100
③ 2.0 薄片 30 t1
④ 2.0 薄片 35 50
⑤ 2.0 颗粒 25 t2
⑥ 2.0 粉末 25 t3
(1)上述实验中①②③④是探究_____________对化学反应速率的影响;__________(填序号)是探究固体表面积对化学反应速率的影响。
(2)②中气泡生成的速率与时间的关系大致如图。推测从0到t速率不减反增的原因可能是___________________。
(3)某同学为了探究化学腐蚀与电化学腐蚀的速率,设计实验与②进行对照。操作如下: 25℃时,另取一个烧杯,放入与实验②完全相同的锌片,先加入2mL某浓度的_________溶液,再加入与②相同的盐酸。可以观察到__________________。
三、选做题
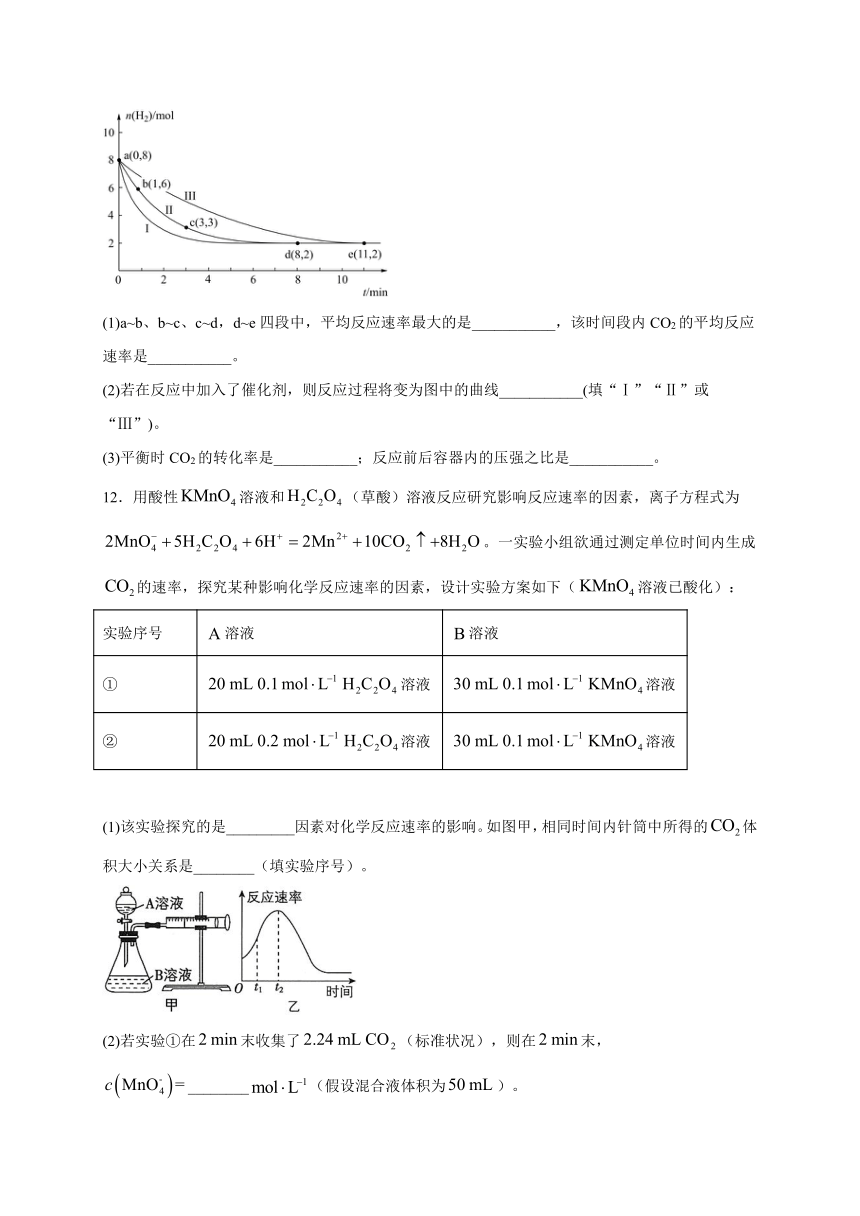
11.固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:。某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图中曲线Ⅱ所示。a、b、c、d、e括号内数据表示坐标。
(1)a~b、b~c、c~d,d~e四段中,平均反应速率最大的是___________,该时间段内CO2的平均反应速率是___________。
(2)若在反应中加入了催化剂,则反应过程将变为图中的曲线___________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(3)平衡时CO2的转化率是___________;反应前后容器内的压强之比是___________。
12.用酸性溶液和(草酸)溶液反应研究影响反应速率的因素,离子方程式为。一实验小组欲通过测定单位时间内生成的速率,探究某种影响化学反应速率的因素,设计实验方案如下(溶液已酸化):
实验序号 溶液 溶液
① 溶液 溶液
② 溶液 溶液
(1)该实验探究的是_________因素对化学反应速率的影响。如图甲,相同时间内针筒中所得的体积大小关系是________(填实验序号)。
(2)若实验①在末收集了(标准状况),则在末,________(假设混合液体积为)。
(3)除通过测定一定时间内的体积来比较反应速率外,本实验还可通过测定________来比较化学反应速率。
(4)小组同学发现反应速率总是如图乙所示,其中时间内速率变快的主要原因可能是①产物是该反应的催化剂、②_________。
第二节化学反应的速率与限度
第1课时 化学反应的速率
1.C
【详解】
A.若反应物为固体和纯液体,增加量并不可以增大浓度,速率基本不变,A错误;
B.化学反应速率为0.8是指1s内浓度的变化量为0.8,B错误;
C.根据化学反应速率的大小可以知道化学反应进行的快慢,C正确;
D.决定反应速率的主要因素是反应物自身的性质,D错误;故选C。
2.A
解析:木炭是固体,增加木炭的量浓度不变,所以增加木炭的物质的量,化学反应速率不变,故A错误根据影响反应速率的因素,升高温度,化学反应速率一定会加快,故B正确;若将反应容器的容积缩小,氧气、二氧化碳的浓度增大,化学反应速率加快,故C正确;将木炭粉碎成粉末状,增大了木炭与氧气的接触面积,化学反应速率会加快,故D正确。
3.C
【解析】
根据化学反应速率之比等于化学计量数之比。用A表示所有物质的化学反应速率。A. v(A)=1.0 mol·L-1·min-1 ;B. v(B)=1.8 mol·L-1·min-1则 v(A)= 1.8 mol·L-1·min-1/32=1.2 mol·L-1·min-1;C. v(D)=0.2 mol·L-1·s-1,则v(A)= 0.2 mol·L-1·s-1/4260=6.0 mol·L-1·min-1;D. v(C)=0.6 mol·L-1·min-1,v(A)= 0.6 mol·L-1·min-1,所以C选项最快。答案:C.
4 .C
【详解】
A.题意得,则根据化学反应速率之比等于方程式中化学计量数之比可知,,A错误;
B.由题中信息可知,,,根据化学反应速率之比等于方程式中化学计量数之比可知,B错误;
C.2min时,D的物质的量是,所以消耗A、B的物质的量分别是1.5,0.5,设A、B的起始物质的量均为y,则剩余A、B的物质的量分别是、,根据可得,解得;所以2min时,A的物质的量为,C正确;
D.根据,A的物质的量为,B的物质的量为,D错误;
故选C。
5.A
【详解】
A. 保持体积不变,充入氮气,体系中各物质的浓度不变,反应速率不变,对反应速率几乎没有影响,A正确;
B. 温度越高反应速率越快,所以升温反应速率加快,B错误;
C. 将容器的体积缩小一半,反应体系中物质的浓度增大,化学反应速率增大,C错误;
D. 浓度越大,化学反应速率越快,所以增加的量,反应速率加快,D错误;
故选A。
6.A
【分析】
根据化学反应速率之比等于化学计量数之比进行解题。
【详解】
A.化学反应速率之比等于化学计量数之比,故,即,故A正确;
B.,即,故B错误;
C.,即,故C错误;
D.,即,故D错误;
故答案为A。
7.D
【详解】
A.常温下,铁在浓硫酸中发生钝化现象,故用铁片和稀硫酸反应制取氢气时,若改用98%的浓硫酸不会产生氢气,故A错误;
B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,锌与氯化钠溶液不反应,但盐酸的浓度降低,反应速率减慢,故B错误;
C.不管吸热反应还是放热反应,升高温度反应速率均加快,故NH3的催化氧化是一个放热的反应,升高温度,反应速率加快,故C错误;
D.在一定温度下固定容积的容器中,发生SO2的催化反应,充入He,反应物浓度不变,反应速率不变,故D正确;
故选D。
8.C
解析:在C(s)+CO2(g)2CO(g)反应中要增大反应速率,可以升高温度,可以增大压强,增大浓度(除了固体和纯液体),使用催化剂,增大接触面积等都可以;恒压下充入N2,与反应体系无关,反应速率不变,故选C。
9.0.8 0.8 0.08 X(g)+Y(g)?2Z(g)
【详解】
(1)根据图像可知,从反应开始到10 s,X的物质的量减少了1.2mol-0.4mol=0.8mol,Z的物质的量浓度增大了,用Z表示的反应速率为;
(2)根据图像可知,从反应开始到10 s,X的物质的量减少了1.2mol-0.4mol=0.8mol,Y的物质的量减少了1.0mol-0.2mol=0.8mol,Z的物质的量增大了1.6mol,根据化学计量数之比等于各物质的物质的量变化量之比可知,该曲线对应的化学方程式为X(g)+Y(g)?2Z(g)。
10.温度 ②⑤⑥ 反应放热使温度升高,加快了化学反应速率 硫酸铜(或CuSO4) 放出气泡的速率明显比②快
【分析】
影响化学反应速率的因素有很多,如温度、浓度、压强、催化剂、固体表面积等,探究一个因素对反应速率的影响时用控制变量法保证其他因素相同;(2)中计算反应时间t1时,利用表中数据推出升高温度,反应速率随温度变化的公式进行作答;(3)中反应速率可能同时受多个因素的影响,抓住某时间段内反应速率的主要影响因素进行分析。
11.a~b Ⅰ 33.3% 7∶5
【详解】
(1)刚开始时,反应物的浓度大,所以平均反应速率最大的是a~b段;0~1min内,,则;
(2)反应中加入了催化剂,则反应速率加快,达到平衡所用的时间减少,但平衡状态相同,反应过程将变为图中的曲线Ⅰ。
(3)平衡时,则反应消耗的氢气为,消耗的二氧化碳为,故平衡时CO2的转化率是;平衡时生成的、的物质的量均为,反应前后容器内的压强之比等于反应前后气体的物质的量之比,则反应前后压强之比为。
12.浓度 ②>① 0.0596 生成相同体积的所需时间或相同时间内溶液颜色变化的程度 该反应放热
【分析】
(1)实验中草酸浓度不同,高锰酸钾均过量,②中草酸的物质的量大生成气体多;
(2)在2min末收集了2.24mL CO2(标准状况下),其物质的量为,由反应可知参加反应的;
(3)测定一定时间内CO2的体积来比较反应速率或测定产生相同体积气体所需的时间,或测定相同时间内高锰酸钾溶液颜色变化的程度;
(4)t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂,或反应放热使温度升高,加快反应速率。
第1课时 化学反应的速率
一、单选题
1.下列关于化学反应速率的说法正确的是( )
A.增加反应物的量、提高反应温度都能增大反应速率
B.化学反应速率为0.8是指1s时某物质的浓度为0.8
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.决定反应速率的主要因素是反应物的浓度
2.对于化学反应来说,下列有关说法不正确的是( )
A.增加木炭的物质的量,化学反应速率会加快
B.升高温度,化学反应速率会加快
C.将反应容器的容积缩小,化学反应速率会加快
D.将木炭粉碎成粉末状,化学反应速率会加快
3.对于可逆反应2A(g)+3B(g)4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=1.0 mol·L-1·min-1 B.v(B)=1.8 mol·L-1·min-1
C.v(D)=0.2 mol·L-1·s-1 D.v(C)=0.6 mol·L-1·min-1
4.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应,经2min后测得D的浓度为0.5,,以C表示的平均速率,下列说法正确的是( )
A.反应速率 B.该反应方程式中x=1
C.2min时,A的物质的量为1.5 D.2min时,B的物质的量为0.5
5.反应在一容积可变的密闭容器中进行,下列条件的改变对反应速率几乎没有影响的是( )
A.保持体积不变,充入氮气使体系的压强增大 B.升温
C.将容器的体积缩小为一半 D.保持体积不变,增加的量
6.已知,反应速率分别用、、、表示,正确的是( )
A. B.
C. D.
7.下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.NH3的催化氧化是一个放热的反应,所以,升高温度,反应的速率减慢
D.在一定温度下固定容积的容器中,发生SO2的催化反应,充入He,反应速率不变
8.在C(s)+CO2(g)2CO(g)反应中可使反应速率增大的措施是?(?? )
①缩小容器的体积 ②增加碳的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥通入CO
A.①③⑤ B.②④⑥ C.①③⑥ D.③⑤⑥
二、填空题
9.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10s,X的物质的量减少了_______ mol,Z的物质的量浓度增大了 _______ ?mol/L,用Z表示的反应速率为 _______ ?mol/(L?s)。
(2)该曲线对应的化学方程式:_______(用X、Y、Z表示)
10.为探究化学反应速率的影响因素,学生设计了锌与过量的c mol/L 100mL盐酸起反应的实验,得到了下面的结果:
序号 锌的质量/g 锌的形状 温度/℃ 完全溶解于酸的时间/s
① 2.0 薄片 15 200
② 2.0 薄片 25 100
③ 2.0 薄片 30 t1
④ 2.0 薄片 35 50
⑤ 2.0 颗粒 25 t2
⑥ 2.0 粉末 25 t3
(1)上述实验中①②③④是探究_____________对化学反应速率的影响;__________(填序号)是探究固体表面积对化学反应速率的影响。
(2)②中气泡生成的速率与时间的关系大致如图。推测从0到t速率不减反增的原因可能是___________________。
(3)某同学为了探究化学腐蚀与电化学腐蚀的速率,设计实验与②进行对照。操作如下: 25℃时,另取一个烧杯,放入与实验②完全相同的锌片,先加入2mL某浓度的_________溶液,再加入与②相同的盐酸。可以观察到__________________。
三、选做题
11.固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:。某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图中曲线Ⅱ所示。a、b、c、d、e括号内数据表示坐标。
(1)a~b、b~c、c~d,d~e四段中,平均反应速率最大的是___________,该时间段内CO2的平均反应速率是___________。
(2)若在反应中加入了催化剂,则反应过程将变为图中的曲线___________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(3)平衡时CO2的转化率是___________;反应前后容器内的压强之比是___________。
12.用酸性溶液和(草酸)溶液反应研究影响反应速率的因素,离子方程式为。一实验小组欲通过测定单位时间内生成的速率,探究某种影响化学反应速率的因素,设计实验方案如下(溶液已酸化):
实验序号 溶液 溶液
① 溶液 溶液
② 溶液 溶液
(1)该实验探究的是_________因素对化学反应速率的影响。如图甲,相同时间内针筒中所得的体积大小关系是________(填实验序号)。
(2)若实验①在末收集了(标准状况),则在末,________(假设混合液体积为)。
(3)除通过测定一定时间内的体积来比较反应速率外,本实验还可通过测定________来比较化学反应速率。
(4)小组同学发现反应速率总是如图乙所示,其中时间内速率变快的主要原因可能是①产物是该反应的催化剂、②_________。
第二节化学反应的速率与限度
第1课时 化学反应的速率
1.C
【详解】
A.若反应物为固体和纯液体,增加量并不可以增大浓度,速率基本不变,A错误;
B.化学反应速率为0.8是指1s内浓度的变化量为0.8,B错误;
C.根据化学反应速率的大小可以知道化学反应进行的快慢,C正确;
D.决定反应速率的主要因素是反应物自身的性质,D错误;故选C。
2.A
解析:木炭是固体,增加木炭的量浓度不变,所以增加木炭的物质的量,化学反应速率不变,故A错误根据影响反应速率的因素,升高温度,化学反应速率一定会加快,故B正确;若将反应容器的容积缩小,氧气、二氧化碳的浓度增大,化学反应速率加快,故C正确;将木炭粉碎成粉末状,增大了木炭与氧气的接触面积,化学反应速率会加快,故D正确。
3.C
【解析】
根据化学反应速率之比等于化学计量数之比。用A表示所有物质的化学反应速率。A. v(A)=1.0 mol·L-1·min-1 ;B. v(B)=1.8 mol·L-1·min-1则 v(A)= 1.8 mol·L-1·min-1/32=1.2 mol·L-1·min-1;C. v(D)=0.2 mol·L-1·s-1,则v(A)= 0.2 mol·L-1·s-1/4260=6.0 mol·L-1·min-1;D. v(C)=0.6 mol·L-1·min-1,v(A)= 0.6 mol·L-1·min-1,所以C选项最快。答案:C.
4 .C
【详解】
A.题意得,则根据化学反应速率之比等于方程式中化学计量数之比可知,,A错误;
B.由题中信息可知,,,根据化学反应速率之比等于方程式中化学计量数之比可知,B错误;
C.2min时,D的物质的量是,所以消耗A、B的物质的量分别是1.5,0.5,设A、B的起始物质的量均为y,则剩余A、B的物质的量分别是、,根据可得,解得;所以2min时,A的物质的量为,C正确;
D.根据,A的物质的量为,B的物质的量为,D错误;
故选C。
5.A
【详解】
A. 保持体积不变,充入氮气,体系中各物质的浓度不变,反应速率不变,对反应速率几乎没有影响,A正确;
B. 温度越高反应速率越快,所以升温反应速率加快,B错误;
C. 将容器的体积缩小一半,反应体系中物质的浓度增大,化学反应速率增大,C错误;
D. 浓度越大,化学反应速率越快,所以增加的量,反应速率加快,D错误;
故选A。
6.A
【分析】
根据化学反应速率之比等于化学计量数之比进行解题。
【详解】
A.化学反应速率之比等于化学计量数之比,故,即,故A正确;
B.,即,故B错误;
C.,即,故C错误;
D.,即,故D错误;
故答案为A。
7.D
【详解】
A.常温下,铁在浓硫酸中发生钝化现象,故用铁片和稀硫酸反应制取氢气时,若改用98%的浓硫酸不会产生氢气,故A错误;
B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,锌与氯化钠溶液不反应,但盐酸的浓度降低,反应速率减慢,故B错误;
C.不管吸热反应还是放热反应,升高温度反应速率均加快,故NH3的催化氧化是一个放热的反应,升高温度,反应速率加快,故C错误;
D.在一定温度下固定容积的容器中,发生SO2的催化反应,充入He,反应物浓度不变,反应速率不变,故D正确;
故选D。
8.C
解析:在C(s)+CO2(g)2CO(g)反应中要增大反应速率,可以升高温度,可以增大压强,增大浓度(除了固体和纯液体),使用催化剂,增大接触面积等都可以;恒压下充入N2,与反应体系无关,反应速率不变,故选C。
9.0.8 0.8 0.08 X(g)+Y(g)?2Z(g)
【详解】
(1)根据图像可知,从反应开始到10 s,X的物质的量减少了1.2mol-0.4mol=0.8mol,Z的物质的量浓度增大了,用Z表示的反应速率为;
(2)根据图像可知,从反应开始到10 s,X的物质的量减少了1.2mol-0.4mol=0.8mol,Y的物质的量减少了1.0mol-0.2mol=0.8mol,Z的物质的量增大了1.6mol,根据化学计量数之比等于各物质的物质的量变化量之比可知,该曲线对应的化学方程式为X(g)+Y(g)?2Z(g)。
10.温度 ②⑤⑥ 反应放热使温度升高,加快了化学反应速率 硫酸铜(或CuSO4) 放出气泡的速率明显比②快
【分析】
影响化学反应速率的因素有很多,如温度、浓度、压强、催化剂、固体表面积等,探究一个因素对反应速率的影响时用控制变量法保证其他因素相同;(2)中计算反应时间t1时,利用表中数据推出升高温度,反应速率随温度变化的公式进行作答;(3)中反应速率可能同时受多个因素的影响,抓住某时间段内反应速率的主要影响因素进行分析。
11.a~b Ⅰ 33.3% 7∶5
【详解】
(1)刚开始时,反应物的浓度大,所以平均反应速率最大的是a~b段;0~1min内,,则;
(2)反应中加入了催化剂,则反应速率加快,达到平衡所用的时间减少,但平衡状态相同,反应过程将变为图中的曲线Ⅰ。
(3)平衡时,则反应消耗的氢气为,消耗的二氧化碳为,故平衡时CO2的转化率是;平衡时生成的、的物质的量均为,反应前后容器内的压强之比等于反应前后气体的物质的量之比,则反应前后压强之比为。
12.浓度 ②>① 0.0596 生成相同体积的所需时间或相同时间内溶液颜色变化的程度 该反应放热
【分析】
(1)实验中草酸浓度不同,高锰酸钾均过量,②中草酸的物质的量大生成气体多;
(2)在2min末收集了2.24mL CO2(标准状况下),其物质的量为,由反应可知参加反应的;
(3)测定一定时间内CO2的体积来比较反应速率或测定产生相同体积气体所需的时间,或测定相同时间内高锰酸钾溶液颜色变化的程度;
(4)t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂,或反应放热使温度升高,加快反应速率。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
