2021届高三化学一轮复习《晶体结构与性质中知识的归纳》教学设计
文档属性
| 名称 | 2021届高三化学一轮复习《晶体结构与性质中知识的归纳》教学设计 |

|
|
| 格式 | zip | ||
| 文件大小 | 501.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 00:00:00 | ||
图片预览



文档简介
《晶体结构与性质中知识的归纳》教学设计
课程标准
1.能说出晶体与非晶体的区别;结合实例描述晶体中微粒排列的周期性规律。
2.借助分子晶体、原子晶体、离子晶体、金属晶体等模型说明晶体中的微粒及其微粒间的相互作用。
主要内容
1.晶体与非晶体的比较
晶体
非晶体
结构特征
结构微粒周期性有序排列
结构微粒无序排列
性质特征
自范性
有
无
熔点
固定
不固定
异同表现
各向异性
各向同性
二者区
别方法
间接方法
看是否有固定的熔点
科学方法
对固体进行X?射线衍射实验
得到晶体的途径
(1)熔融态物质凝固。
(2)气态物质冷却不经液态直接凝固(凝华)。
(3)溶质从溶液中析出。
2.
晶胞
(1)概念:描述晶体结构的基本单元。
(2)晶体中晶胞的排列——无隙并置
无隙:相邻晶胞之间没有任何间隙。
并置:所有晶胞都是平行排列、取向相同。
晶胞计算——“均摊法”
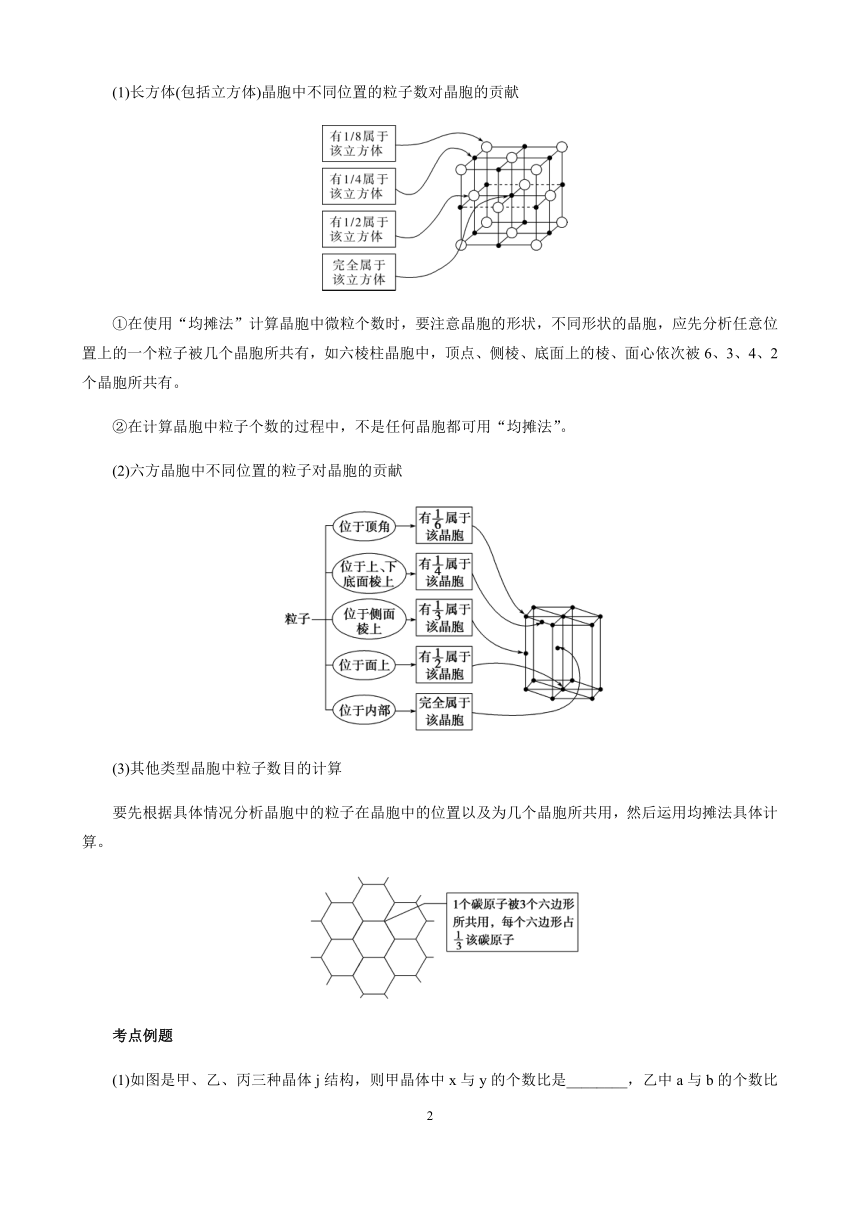
(1)长方体(包括立方体)晶胞中不同位置的粒子数对晶胞的贡献
①在使用“均摊法”计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用“均摊法”。
(2)六方晶胞中不同位置的粒子对晶胞的贡献
(3)其他类型晶胞中粒子数目的计算
要先根据具体情况分析晶胞中的粒子在晶胞中的位置以及为几个晶胞所共用,然后运用均摊法具体计算。
考点例题
(1)如图是甲、乙、丙三种晶体j结构,则甲晶体中x与y的个数比是________,乙中a与b的个数比是________,丙中一个晶胞中有________个c离子和________个d离子。
答案 2∶1 1∶1 4 4
(2)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如下图所示。则该化合物的化学式为________。
答案 CuH
(3)硼化镁晶体在39
K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。
答案 (1)MgB2
4.
晶胞密度的相关计算
(2)晶体密度计算公式:其中N为1个晶胞中所含“分子”数目,M为摩尔质量,NA为阿伏加德罗常数的值,V为1个晶胞的体积。
注意:①单位的换算:1nm
=10-7
cm
;
1
pm
=
10-10
cm
②晶胞参数与原子半径间的关系(设棱长为a,原子半径为r)
考点例题
(1)[2020·天津]CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,
则CoO晶体的密度为
g?cm﹣3。
答案
(2)
[2018·全国卷Ⅰ]Li2O具有反萤石结构,晶胞如图所示。
已知晶胞参数为0.4665
nm,阿伏加德罗常数的值为NA,则Li2O的密度为______________
g·cm-3(列出计算式)。
解析:1个氧化锂晶胞含O的个数为,含Li的个数为8,1
nm=10-7
nm,代入密度公式计算可得Li2O的密度为g·cm-3。
(3)[2018·全国卷Ⅱ]FeS2晶体的晶胞如图所示。晶胞边长为a
nm,FeS2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为________nm。
解析:该晶胞中Fe2+位于棱上和体心,个数为12×+1=4,S位于顶点和面心,个数为8×+6×=4,故晶体密度为
g÷(a×10-7
cm)3=×1021
g·cm-3。根据晶胞结构可知,S所形成的正八面体的边长为该晶胞中相邻面的面心之间的连线之长,即为晶胞边长的,故该正八面体的边长为a
nm。
二、常见晶体模型的微观结构分析
(一)原子晶体、分子晶体、离子晶体、混合型晶体
晶体
晶体结构
晶体详解
原子晶体(共价
晶体)
金刚石
(1)每个C与相邻的4个C以共价键结合,形成正四面体结构
(2)键角均为109°28′
(3)最小碳环由6个C原子组成且6个C原子不在同一平面内
(4)每个C参与4条C—C键的形成,C原子数与C—C键数之比为1∶2
SiO2
(1)每个Si与4个O以共价键结合,形成正四面体结构
(2)每个正面四体占有1个Si,4个“O”,n(Si)∶n(O)=1∶2
(3)最小环上有12个原子,即6个O和6个Si
分子
晶体
干冰
(1)每8个CO2分子构成立方体且在6个面心又各占据1个CO2分子
(2)每个CO2分子周围等距离且紧邻的CO2分子有12个
冰
每个水分子与相邻的4个水分子以氢键相连接,含1
mol
H2O的冰中,最多可形成2
mol氢键
离子
晶体
NaCl型
(1)每个Na+(Cl-)周围等距离且紧邻的Cl-(Na+)有6个,每个Na+周围等距离且紧邻的Na+有12个
(2)每个晶胞中含4个Na+和4个Cl-
CsCl型
(1)每个Cs+(Cl-)周围等距离且紧邻的Cs+(Cl-)有6个;每个Cs+周围等距离且紧邻的Cl-有8个
(2)每个晶胞中含1个Cs+和1个Cl-
混合型
晶体
石墨
(1)石墨层状晶体中,层与层之间的作用是范德华力
(2)平均每个正六边形拥有的碳原子个数是2,C原子采取的杂化方式是sp2
(3)每层中存在σ键和π键,还有金属键
(4)C—C键的键长比金刚石的C—C键的键长短,熔点比金刚石的高
(5)硬度不大、有滑腻感、能导电
(五)金属晶体
1.含义:金属原子通过金属键形成的晶体,金属单质形成的晶体就是金属晶体。
2.
金属键的形成:晶体中金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而将所有的金属原子维系在一起;金属键无饱和性、方向性。
考点例题
按要求回答问题
(1)在金刚石晶体中最小碳环含有________个C原子;每个C原子被________个最小碳环共用。
(2)在干冰中粒子间作用力有_____________________________________________。
(3)含1
mol
H2O的冰中形成氢键的数目为________。
(4)在NaCl晶体中,每个Na+周围有________个距离最近且相等的Na+,每个Na+周围有________个距离最近且相等的Cl-,其立体构型为____________。
(5)在CaF2晶体中,每个Ca2+周围距离最近且等距离的F-有________个;每个F-周围距离最近且等距离的Ca2+有________个。
答案 (1)6 12 (2)共价键、范德华力 (3)2NA
(4)12 6 正八面体形 (5)8 4
三、离子晶体的晶格能
1.定义
气态离子形成
1
mol离子晶体释放的能量,通常取正值,单位:kJ·mol-1。
2.影响因素
(1)离子所带电荷数:离子所带电荷数越多,晶格能越大。
(2)离子的半径:离子的半径越小,晶格能越大。
3.与离子晶体性质的关系
晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
四、晶体熔、沸点的比较
1.不同类型晶体熔、沸点的比较
(1)不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。
(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
2.同种类型晶体熔、沸点的比较
(1)共价晶体
原子半径越小,键长越短,键能越大,熔、沸点越高,如金刚石>碳化硅>硅。
(2)离子晶体
一般来说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如MgO>NaCl>CsCl。
(3)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
④同分异构体支链越多,熔、沸点越低,如
CH3—CH2—CH2—CH2—CH3>。
(4)金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点越高,如Na考点例题
(1)[2017·高考全国卷Ⅰ,35(2)]K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是________________________________________________________________________。
(2)[2016·高考全国卷Ⅲ,37(4)]GaF3的熔点高于1
000
℃,GaCl3的熔点为77.9
℃,其原因是______________________________________________________________________。
答案:(1)K原子半径较大且价电子数较少,金属键较弱
(2)GaF3为离子晶体,GaCl3为分子晶体
五、判断晶体类型的方法
1.
根据各类晶体的特征性质判断
如低熔、沸点的物质一般形成分子晶体;
熔、沸点较高,且在水溶液中或熔融状态下能导电的化合物形成离子晶体;熔、沸点很高,不导电,不溶于一般溶剂的物质形成原子晶体;
能导电、传热、具有延展性的晶体为金属晶体。
2.
根据物质的分类判断
离子晶体:金属氧化物、强碱和绝大多数的盐类;
分子晶体:大多数非金属单质、气态氢化物、非金属氧化物、酸、绝大多数有机物(有机盐除外)。
原子晶体:单质有金刚石、晶体硅、晶体硼等,化合物有碳化硅、二氧化硅等。
金属晶体:金属单质与合金。
考点例题
(1)[2019·高考全国卷Ⅲ,35(3)]苯胺()的晶体类型是________________。
(2)[2015·高考全国卷Ⅰ,37(4)]CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253
K,沸点为376
K,其固体属于________晶体。
(3)[2015·高考全国卷Ⅱ,37(2)改编]氧和钠的氢化物所属的晶体类型分别为________和________。
答案:(1)分子晶体 (2)分子 (3)分子晶体 离子晶体
课程标准
1.能说出晶体与非晶体的区别;结合实例描述晶体中微粒排列的周期性规律。
2.借助分子晶体、原子晶体、离子晶体、金属晶体等模型说明晶体中的微粒及其微粒间的相互作用。
主要内容
1.晶体与非晶体的比较
晶体
非晶体
结构特征
结构微粒周期性有序排列
结构微粒无序排列
性质特征
自范性
有
无
熔点
固定
不固定
异同表现
各向异性
各向同性
二者区
别方法
间接方法
看是否有固定的熔点
科学方法
对固体进行X?射线衍射实验
得到晶体的途径
(1)熔融态物质凝固。
(2)气态物质冷却不经液态直接凝固(凝华)。
(3)溶质从溶液中析出。
2.
晶胞
(1)概念:描述晶体结构的基本单元。
(2)晶体中晶胞的排列——无隙并置
无隙:相邻晶胞之间没有任何间隙。
并置:所有晶胞都是平行排列、取向相同。
晶胞计算——“均摊法”
(1)长方体(包括立方体)晶胞中不同位置的粒子数对晶胞的贡献
①在使用“均摊法”计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用“均摊法”。
(2)六方晶胞中不同位置的粒子对晶胞的贡献
(3)其他类型晶胞中粒子数目的计算
要先根据具体情况分析晶胞中的粒子在晶胞中的位置以及为几个晶胞所共用,然后运用均摊法具体计算。
考点例题
(1)如图是甲、乙、丙三种晶体j结构,则甲晶体中x与y的个数比是________,乙中a与b的个数比是________,丙中一个晶胞中有________个c离子和________个d离子。
答案 2∶1 1∶1 4 4
(2)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如下图所示。则该化合物的化学式为________。
答案 CuH
(3)硼化镁晶体在39
K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。
答案 (1)MgB2
4.
晶胞密度的相关计算
(2)晶体密度计算公式:其中N为1个晶胞中所含“分子”数目,M为摩尔质量,NA为阿伏加德罗常数的值,V为1个晶胞的体积。
注意:①单位的换算:1nm
=10-7
cm
;
1
pm
=
10-10
cm
②晶胞参数与原子半径间的关系(设棱长为a,原子半径为r)
考点例题
(1)[2020·天津]CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,
则CoO晶体的密度为
g?cm﹣3。
答案
(2)
[2018·全国卷Ⅰ]Li2O具有反萤石结构,晶胞如图所示。
已知晶胞参数为0.4665
nm,阿伏加德罗常数的值为NA,则Li2O的密度为______________
g·cm-3(列出计算式)。
解析:1个氧化锂晶胞含O的个数为,含Li的个数为8,1
nm=10-7
nm,代入密度公式计算可得Li2O的密度为g·cm-3。
(3)[2018·全国卷Ⅱ]FeS2晶体的晶胞如图所示。晶胞边长为a
nm,FeS2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为________nm。
解析:该晶胞中Fe2+位于棱上和体心,个数为12×+1=4,S位于顶点和面心,个数为8×+6×=4,故晶体密度为
g÷(a×10-7
cm)3=×1021
g·cm-3。根据晶胞结构可知,S所形成的正八面体的边长为该晶胞中相邻面的面心之间的连线之长,即为晶胞边长的,故该正八面体的边长为a
nm。
二、常见晶体模型的微观结构分析
(一)原子晶体、分子晶体、离子晶体、混合型晶体
晶体
晶体结构
晶体详解
原子晶体(共价
晶体)
金刚石
(1)每个C与相邻的4个C以共价键结合,形成正四面体结构
(2)键角均为109°28′
(3)最小碳环由6个C原子组成且6个C原子不在同一平面内
(4)每个C参与4条C—C键的形成,C原子数与C—C键数之比为1∶2
SiO2
(1)每个Si与4个O以共价键结合,形成正四面体结构
(2)每个正面四体占有1个Si,4个“O”,n(Si)∶n(O)=1∶2
(3)最小环上有12个原子,即6个O和6个Si
分子
晶体
干冰
(1)每8个CO2分子构成立方体且在6个面心又各占据1个CO2分子
(2)每个CO2分子周围等距离且紧邻的CO2分子有12个
冰
每个水分子与相邻的4个水分子以氢键相连接,含1
mol
H2O的冰中,最多可形成2
mol氢键
离子
晶体
NaCl型
(1)每个Na+(Cl-)周围等距离且紧邻的Cl-(Na+)有6个,每个Na+周围等距离且紧邻的Na+有12个
(2)每个晶胞中含4个Na+和4个Cl-
CsCl型
(1)每个Cs+(Cl-)周围等距离且紧邻的Cs+(Cl-)有6个;每个Cs+周围等距离且紧邻的Cl-有8个
(2)每个晶胞中含1个Cs+和1个Cl-
混合型
晶体
石墨
(1)石墨层状晶体中,层与层之间的作用是范德华力
(2)平均每个正六边形拥有的碳原子个数是2,C原子采取的杂化方式是sp2
(3)每层中存在σ键和π键,还有金属键
(4)C—C键的键长比金刚石的C—C键的键长短,熔点比金刚石的高
(5)硬度不大、有滑腻感、能导电
(五)金属晶体
1.含义:金属原子通过金属键形成的晶体,金属单质形成的晶体就是金属晶体。
2.
金属键的形成:晶体中金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而将所有的金属原子维系在一起;金属键无饱和性、方向性。
考点例题
按要求回答问题
(1)在金刚石晶体中最小碳环含有________个C原子;每个C原子被________个最小碳环共用。
(2)在干冰中粒子间作用力有_____________________________________________。
(3)含1
mol
H2O的冰中形成氢键的数目为________。
(4)在NaCl晶体中,每个Na+周围有________个距离最近且相等的Na+,每个Na+周围有________个距离最近且相等的Cl-,其立体构型为____________。
(5)在CaF2晶体中,每个Ca2+周围距离最近且等距离的F-有________个;每个F-周围距离最近且等距离的Ca2+有________个。
答案 (1)6 12 (2)共价键、范德华力 (3)2NA
(4)12 6 正八面体形 (5)8 4
三、离子晶体的晶格能
1.定义
气态离子形成
1
mol离子晶体释放的能量,通常取正值,单位:kJ·mol-1。
2.影响因素
(1)离子所带电荷数:离子所带电荷数越多,晶格能越大。
(2)离子的半径:离子的半径越小,晶格能越大。
3.与离子晶体性质的关系
晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
四、晶体熔、沸点的比较
1.不同类型晶体熔、沸点的比较
(1)不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。
(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
2.同种类型晶体熔、沸点的比较
(1)共价晶体
原子半径越小,键长越短,键能越大,熔、沸点越高,如金刚石>碳化硅>硅。
(2)离子晶体
一般来说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如MgO>NaCl>CsCl。
(3)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
④同分异构体支链越多,熔、沸点越低,如
CH3—CH2—CH2—CH2—CH3>。
(4)金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点越高,如Na
(1)[2017·高考全国卷Ⅰ,35(2)]K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是________________________________________________________________________。
(2)[2016·高考全国卷Ⅲ,37(4)]GaF3的熔点高于1
000
℃,GaCl3的熔点为77.9
℃,其原因是______________________________________________________________________。
答案:(1)K原子半径较大且价电子数较少,金属键较弱
(2)GaF3为离子晶体,GaCl3为分子晶体
五、判断晶体类型的方法
1.
根据各类晶体的特征性质判断
如低熔、沸点的物质一般形成分子晶体;
熔、沸点较高,且在水溶液中或熔融状态下能导电的化合物形成离子晶体;熔、沸点很高,不导电,不溶于一般溶剂的物质形成原子晶体;
能导电、传热、具有延展性的晶体为金属晶体。
2.
根据物质的分类判断
离子晶体:金属氧化物、强碱和绝大多数的盐类;
分子晶体:大多数非金属单质、气态氢化物、非金属氧化物、酸、绝大多数有机物(有机盐除外)。
原子晶体:单质有金刚石、晶体硅、晶体硼等,化合物有碳化硅、二氧化硅等。
金属晶体:金属单质与合金。
考点例题
(1)[2019·高考全国卷Ⅲ,35(3)]苯胺()的晶体类型是________________。
(2)[2015·高考全国卷Ⅰ,37(4)]CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253
K,沸点为376
K,其固体属于________晶体。
(3)[2015·高考全国卷Ⅱ,37(2)改编]氧和钠的氢化物所属的晶体类型分别为________和________。
答案:(1)分子晶体 (2)分子 (3)分子晶体 离子晶体
同课章节目录
