2020-2021学年人教版九年级化学下册9.2 溶解度同步测试 (含答案)
文档属性
| 名称 | 2020-2021学年人教版九年级化学下册9.2 溶解度同步测试 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 49.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-08 22:04:36 | ||
图片预览

文档简介
(
…
)
课题二
溶解度
同步测试题
一、选择题
1.下列因素中,与固体物质的溶解度无关的是(
??)
A.溶质的种类??
B.溶剂的种类??
C.温度的高低????
D.溶质、溶剂量的多少
2.下列加速物质溶解的措施中,可以改变固体溶解度的是()
A.搅拌??
??
B.振荡?
?
??C.粉碎??
D.加热
3.通常要使一种不饱和溶液变为饱和溶液,最简单的方法是(????
)
A.加入溶质??
B.降低温度
C.升高温度??
D.恒温蒸发溶剂
4.生活中的下列现象不能说明气体溶解度随温度升高而减小的是(???
)
A.烧开水时,沸腾前有气泡逸出
B.阳光充足时,充满水的鱼缸壁上有小气泡
C.启开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼浮出水面
5.可证明一瓶硝酸钾溶液是饱和溶液的方法是(???
)
A.蒸发掉1
g水,有少量固体析出
B.降低温度,有少量固体析出
C.加入少量硝酸钾固体,固体不再溶解
D.加入少量水,没有固体析出
6.把60℃的饱和硝酸钾溶液降温到20℃,下列说法中正确的是(??
)
①溶液的质量不变 ②溶质的质量不变 ③溶剂的质量不变 ④仍是饱和状态
A.①和②???B.③和④?
C.①和③??
D.②和④
7.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是(??
)
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
8.有关饱和溶液的下列叙述正确的是(??
)
A.在饱和溶液里再加入任何物质都不能溶解
B.温度不变下,某饱和溶液中再加入这种溶质,溶液的质量不变
C.20℃时,向100g氯化钠饱和溶液中加入10g氯化钠,溶液的质量是110g
D.20℃时,从100g氯化钠的饱和溶液中取出5g,剩下的95g溶液变成不饱和溶液
9.在一个大萝卜上挖个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,在相同温度下,发现倒出的溶液还能溶解少量的食盐,这说明倒出的溶液(
)
A.还是该温度下的饱和溶液
B.是该温度下的不饱和溶液
C.食盐的溶解度变大了
D.食盐的溶解度变小了
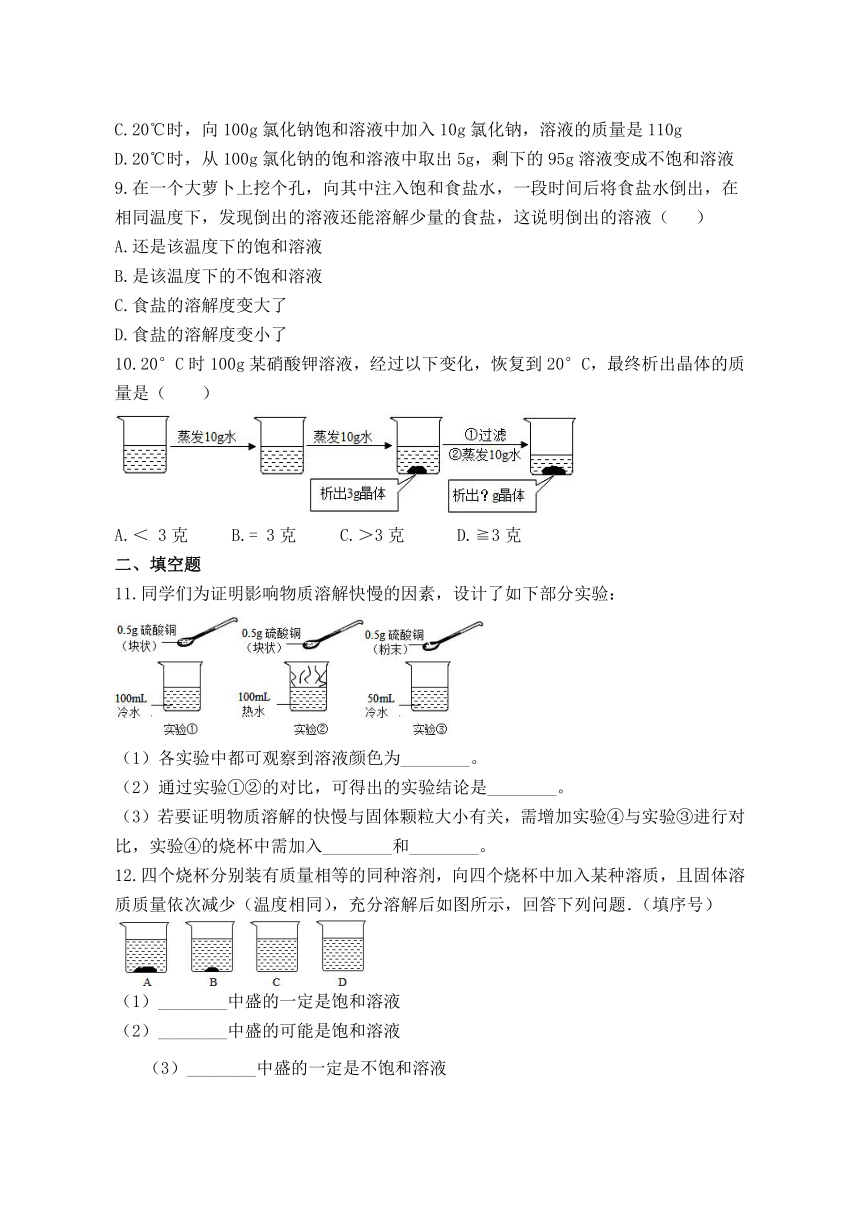
10.20°C时100g某硝酸钾溶液,经过以下变化,恢复到20°C,最终析出晶体的质量是( )
A.<
3克?
B.=
3克
C.>3克
D.≧3克
二、填空题
11.同学们为证明影响物质溶解快慢的因素,设计了如下部分实验:
(1)各实验中都可观察到溶液颜色为________。
(2)通过实验①②的对比,可得出的实验结论是________。
(3)若要证明物质溶解的快慢与固体颗粒大小有关,需增加实验④与实验③进行对比,实验④的烧杯中需加入________和________。
12.四个烧杯分别装有质量相等的同种溶剂,向四个烧杯中加入某种溶质,且固体溶质质量依次减少(温度相同),充分溶解后如图所示,回答下列问题.(填序号)
(1)________中盛的一定是饱和溶液
(2)________中盛的可能是饱和溶液
(3)________中盛的一定是不饱和溶液
(4)若固体溶质是KNO3,
对A、B两烧杯进行加热,随着温度的升高,先变成不饱和溶液的是________。
(5)在一定温度下,向A、B中分别加入相同质量的水,B中固体刚好全溶,A中是否也全溶?________。
13.图1是甲、乙两种物质的溶解度曲线图,图2所示两个烧杯中各盛有20℃时上述两种物质的饱和溶液。请你通过分析,回答下列问题:
(1)溶解度随温度升高而增大的物质是________;(填“甲”或“乙”)
(2)40℃时,甲物质与乙物质的溶解度________;(填“相等”或“不相等”)
(3)80℃时,向100g水中加入甲物质80g所得为不饱和溶液,欲使其变为饱和溶液,还应加入甲物质________g,此时溶液的溶质质量分数是________。(计算结果精确到0.1%)
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增加,则B烧杯溶液中的溶质是________(填“甲”或“乙”)。
三、探究题
14.某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在与t2℃的________(填“饱和”或”不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至________℃。
(3)t2℃时,若M点所示溶液的质量为70g,其中含溶质________g.再将该溶液降温到t1℃,溶液的溶质质量分数变为________(保留一位小数)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)
A.M、N点均不动
B.M、N点均垂直上移
C.M点沿曲线下移;N点垂直上移
D.M点不动:N点垂直上移至曲线,不再变动
15.根据下表回答问题。
温度(℃)
20
40
50
60
80
溶解度
(g/100g水)
NaCl
36.0
36.6
37.0
37.3
38.4
NH4Cl
37.2
45.8
50.4
55.2
65.6
KNO3
31.6
63.9
85.5
110
169
(1)上表中的三种物质在20℃时,________的溶解度最大;
(2)将40
℃时NH4Cl和NaCl的两种饱和溶液升温至60
℃,则两种溶液的溶质质量分数大小关系是:NaCl________NH4Cl(填写“>”、“<”或“=”)。
(3)饱和KNO3
溶液中混有少量的NaCl,要得到KNO3
晶体的方法是________。
(4)A是80℃含有120
g水的KNO3溶液。经过如下操作,得到102
gKNO3固体。
对以上过程的分析,正确的是________(选填编号)。
①
A到B的过程中,溶质质量没有改变
②
B中溶质与溶剂的质量比为
169:100
③
开始析出KNO3固体的温度在60℃至80℃之间
④
A溶液的质量等于222
g
课题二
溶解度
同步测试题
参考答案
一、选择题
1.D
2.D
3.A
4.C
5.C
6.B
7.B
8.B
9.B
10.D
二、填空题
11.(1)蓝色(2)温度越高,溶解速率越快(3)50mL冷水;0.5g硫酸铜粉末
12.(1)AB(2)C(3)D(4)B(5)否
13.(1)甲(2)相等(3)20;50.0%(4)乙
三、探究题
14.(1)饱和(2)t3
(3)20;16.7%
(4)D
15.(1)
(2)<(3)将固体溶解,加热浓缩,降温结晶,过滤,洗涤干燥
(4)①③
…
)
课题二
溶解度
同步测试题
一、选择题
1.下列因素中,与固体物质的溶解度无关的是(
??)
A.溶质的种类??
B.溶剂的种类??
C.温度的高低????
D.溶质、溶剂量的多少
2.下列加速物质溶解的措施中,可以改变固体溶解度的是()
A.搅拌??
??
B.振荡?
?
??C.粉碎??
D.加热
3.通常要使一种不饱和溶液变为饱和溶液,最简单的方法是(????
)
A.加入溶质??
B.降低温度
C.升高温度??
D.恒温蒸发溶剂
4.生活中的下列现象不能说明气体溶解度随温度升高而减小的是(???
)
A.烧开水时,沸腾前有气泡逸出
B.阳光充足时,充满水的鱼缸壁上有小气泡
C.启开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼浮出水面
5.可证明一瓶硝酸钾溶液是饱和溶液的方法是(???
)
A.蒸发掉1
g水,有少量固体析出
B.降低温度,有少量固体析出
C.加入少量硝酸钾固体,固体不再溶解
D.加入少量水,没有固体析出
6.把60℃的饱和硝酸钾溶液降温到20℃,下列说法中正确的是(??
)
①溶液的质量不变 ②溶质的质量不变 ③溶剂的质量不变 ④仍是饱和状态
A.①和②???B.③和④?
C.①和③??
D.②和④
7.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是(??
)
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
8.有关饱和溶液的下列叙述正确的是(??
)
A.在饱和溶液里再加入任何物质都不能溶解
B.温度不变下,某饱和溶液中再加入这种溶质,溶液的质量不变
C.20℃时,向100g氯化钠饱和溶液中加入10g氯化钠,溶液的质量是110g
D.20℃时,从100g氯化钠的饱和溶液中取出5g,剩下的95g溶液变成不饱和溶液
9.在一个大萝卜上挖个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,在相同温度下,发现倒出的溶液还能溶解少量的食盐,这说明倒出的溶液(
)
A.还是该温度下的饱和溶液
B.是该温度下的不饱和溶液
C.食盐的溶解度变大了
D.食盐的溶解度变小了
10.20°C时100g某硝酸钾溶液,经过以下变化,恢复到20°C,最终析出晶体的质量是( )
A.<
3克?
B.=
3克
C.>3克
D.≧3克
二、填空题
11.同学们为证明影响物质溶解快慢的因素,设计了如下部分实验:
(1)各实验中都可观察到溶液颜色为________。
(2)通过实验①②的对比,可得出的实验结论是________。
(3)若要证明物质溶解的快慢与固体颗粒大小有关,需增加实验④与实验③进行对比,实验④的烧杯中需加入________和________。
12.四个烧杯分别装有质量相等的同种溶剂,向四个烧杯中加入某种溶质,且固体溶质质量依次减少(温度相同),充分溶解后如图所示,回答下列问题.(填序号)
(1)________中盛的一定是饱和溶液
(2)________中盛的可能是饱和溶液
(3)________中盛的一定是不饱和溶液
(4)若固体溶质是KNO3,
对A、B两烧杯进行加热,随着温度的升高,先变成不饱和溶液的是________。
(5)在一定温度下,向A、B中分别加入相同质量的水,B中固体刚好全溶,A中是否也全溶?________。
13.图1是甲、乙两种物质的溶解度曲线图,图2所示两个烧杯中各盛有20℃时上述两种物质的饱和溶液。请你通过分析,回答下列问题:
(1)溶解度随温度升高而增大的物质是________;(填“甲”或“乙”)
(2)40℃时,甲物质与乙物质的溶解度________;(填“相等”或“不相等”)
(3)80℃时,向100g水中加入甲物质80g所得为不饱和溶液,欲使其变为饱和溶液,还应加入甲物质________g,此时溶液的溶质质量分数是________。(计算结果精确到0.1%)
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增加,则B烧杯溶液中的溶质是________(填“甲”或“乙”)。
三、探究题
14.某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在与t2℃的________(填“饱和”或”不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至________℃。
(3)t2℃时,若M点所示溶液的质量为70g,其中含溶质________g.再将该溶液降温到t1℃,溶液的溶质质量分数变为________(保留一位小数)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)
A.M、N点均不动
B.M、N点均垂直上移
C.M点沿曲线下移;N点垂直上移
D.M点不动:N点垂直上移至曲线,不再变动
15.根据下表回答问题。
温度(℃)
20
40
50
60
80
溶解度
(g/100g水)
NaCl
36.0
36.6
37.0
37.3
38.4
NH4Cl
37.2
45.8
50.4
55.2
65.6
KNO3
31.6
63.9
85.5
110
169
(1)上表中的三种物质在20℃时,________的溶解度最大;
(2)将40
℃时NH4Cl和NaCl的两种饱和溶液升温至60
℃,则两种溶液的溶质质量分数大小关系是:NaCl________NH4Cl(填写“>”、“<”或“=”)。
(3)饱和KNO3
溶液中混有少量的NaCl,要得到KNO3
晶体的方法是________。
(4)A是80℃含有120
g水的KNO3溶液。经过如下操作,得到102
gKNO3固体。
对以上过程的分析,正确的是________(选填编号)。
①
A到B的过程中,溶质质量没有改变
②
B中溶质与溶剂的质量比为
169:100
③
开始析出KNO3固体的温度在60℃至80℃之间
④
A溶液的质量等于222
g
课题二
溶解度
同步测试题
参考答案
一、选择题
1.D
2.D
3.A
4.C
5.C
6.B
7.B
8.B
9.B
10.D
二、填空题
11.(1)蓝色(2)温度越高,溶解速率越快(3)50mL冷水;0.5g硫酸铜粉末
12.(1)AB(2)C(3)D(4)B(5)否
13.(1)甲(2)相等(3)20;50.0%(4)乙
三、探究题
14.(1)饱和(2)t3
(3)20;16.7%
(4)D
15.(1)
(2)<(3)将固体溶解,加热浓缩,降温结晶,过滤,洗涤干燥
(4)①③
同课章节目录
