新人教版高一化学必修第二册第七章第三节《乙醇与乙酸》第1课时 乙醇 教学课件 (23张ppt)
文档属性
| 名称 | 新人教版高一化学必修第二册第七章第三节《乙醇与乙酸》第1课时 乙醇 教学课件 (23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 979.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 15:13:01 | ||
图片预览







文档简介
(共23张PPT)
第三节《乙醇与乙酸》
第1课时
乙醇
新人教版高一化学必修第二册第七章
阅读课本77页第二段,归纳和总结乙醇的物理性质。
活动.探究
气
味:
无色透明
特殊香味
液体
比水小
20℃时,密度是0.7893g/ml
跟水以任意比互溶能够溶解多种无机物和
有机物,重要的有机溶剂。
易挥发,沸点78.5℃
一、乙醇(俗称
酒精)
颜
色:
溶解性:
密
度:
挥发性:
状
态:
1、乙醇的物理性质
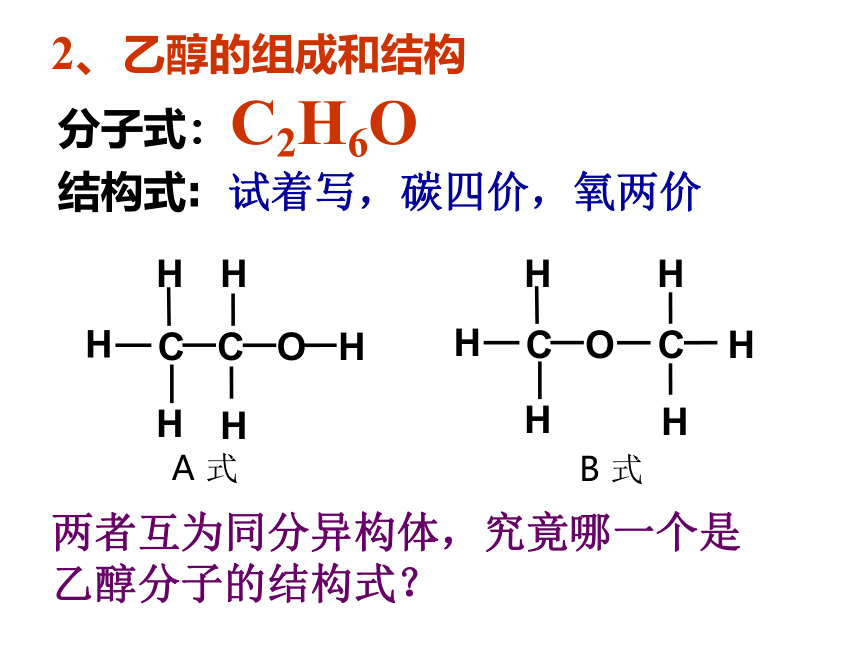
C
C
O
H
H
H
H
H
H
A
式
C
O
C
H
H
H
H
H
H
B
式
两者互为同分异构体,究竟哪一个是乙醇分子的结构式?
分子式:C2H6O
2、乙醇的组成和结构
结构式:
试着写,碳四价,氧两价
实验7-4:网上搜索钠与乙醇反应的实验视频并观看
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2
NaOH
+H2↑
?
仍是块状
[交流讨论]
经测定1mol乙醇与足量的钠反应,生成0.5mol的氢气,据此判断乙醇的结构式为哪种?
C
C
O
H
H
H
H
H
H
A
式
2CH3CH2OH+2Na=2CH3CH2ONa+H2
C
O
C
H
H
H
H
H
H
B
式
C—C—O—H
H
H
H
H
H
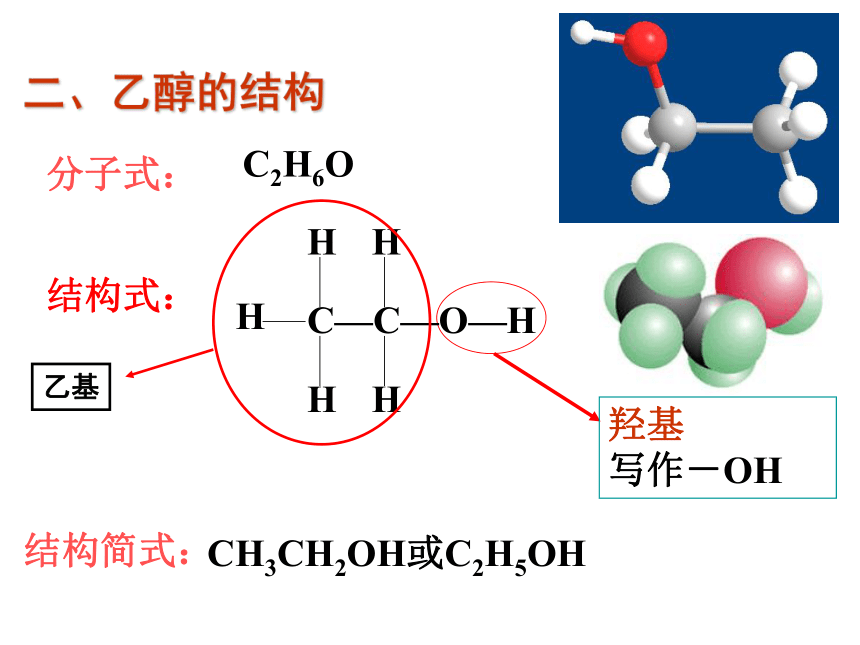
结构式:
CH3CH2OH或C2H5OH
羟基
写作-OH
分子式:
二、乙醇的结构
C2H6O
结构简式:
乙基
请完成下表:
氢氧根OH-
羟基-OH
电子式
带电性
稳定性
存在
[
]-
O
H
·
·
·
·
×
·
·
×
O
H
·
·
·
·
×
·
·
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
判断方法:出含有碳氢元素外还含有其他元素。
讨论:
什么是烃?乙醇是烃吗?
例子:卤代烃:一氯甲烷、二氯甲烷、
1、2-二溴乙烷
三、乙醇的化学性质
1、与活泼金属反应
产物名称:乙醇钠。注意:断键处在羟基中的氢氧键
2C2H5OH+2Na
2C2H5ONa+H2
2H2O
+
2
Na
=
2
NaOH
+
H2
H
H
H-C-C-O—H
H
H
置换反应
其它活泼金属如钾、钙、镁等也可与乙醇反应。
比较乙醇与水羟基上的H的活泼性强弱。
电离出氢离子的能力:
水
(大于或小于)乙醇
大于
⑴燃烧
2、氧化反应
点燃
CH3CH2OH
+
3O2
2CO2
+
3
H2O
现象:乙醇在空气中燃烧,发出淡蓝色的火焰,烧杯壁上出现液滴,
生成的气体能使澄清石灰水变浑浊.
乙醇汽油由90%的普通汽油与10%的燃料乙醇调和而成。
【实验7-5】搜索视频乙醇的催化氧化并观看
在试管中加入3-5mL无水乙醇,将铜丝烧热,迅速插入乙醇中,反复多次,观察铜丝颜色和乙醇气味的变化。
实
验
现
象
将铜丝在火焰上烧热
铜丝由红色变成黑色
将烧热的铜丝插入无水乙醇中
铜丝由黑色变成红色,反复多次后闻到刺激性气味
2CH3CH2OH
+
O2
→
2CH3CHO
+
2H2O
Cu
△
1、铜在反应中起着
的作用.
催化
2、乙醇在实验中是
(填“被氧化”或“被还原”),乙醇发生了
反应。
被氧化
氧化反应
注:-CHO
不能写成
-COH
⑵催化氧化
乙醇催化氧化的断键位置
分析讨论
⑶与强氧化剂反应
乙醇与酸性高锰酸钾或酸性重铬酸钾溶液反应,被直接氧化成乙酸
K2Cr2O7+C2H5OH+H2SO4=
橙红色
Cr2(SO4)3+CH3COOH+
K2SO4+H2O
绿色
在有机反应中,把有机化合物在反应中脱氢或者加氧的反应看成是氧化反应;
把有机化合物在反应中加氢或者脱氧的反应看成是还原反应。
拓展
官能团:官能团是指决定有机化合物的化学性质的原子或原子团。
例如:
卤代烃中卤原子(-X),X代表卤族元素(F,Cl,Br,I);
羟基(-OH);
烯烃中的碳碳双键(>C=C<)
炔烃中的碳碳叁键
思考:
乙醇发生置换反应、催化氧化反应的断键位置在什么地方?这说明了什么问题?
四、醇
(1)结构特点:
(2)官能团:羟基
(3)化学性质:
置换反应:活泼金属
氧化反应(燃烧、催化氧化、强氧化剂)
—OH
课堂小结
一、乙醇的结构
二、乙醇的物理性质
三、乙醇的化学性质
1.与活泼金属的置换反应
2.氧化反应(催化氧化、燃烧、强氧化剂)
杜康酒的由来
少年的杜康以放牧为生,带的饭食挂在树上,常常忘了吃。一段时间后,少康发现挂在树上的剩饭变了味,产生的汁水竟甘美异常,这引起了他的兴趣,就反复地研究思索,终于发现了自然发酵的原理,遂有意识地进行效仿,并不断改进,终于形成了一套完整的酿酒工艺,从而奠定了杜康中国酿酒业开山鼻祖的地位,其所造之酒也被命名为“杜康酒”。
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2+H2O
乙醛脱氢酶
(ALDH)
乙醇有加速人体血液循环、使人兴奋并改变人的情绪和行为的作用。人如果在短时间内饮用大量酒精,初始酒精会使人兴奋、减轻抑郁程度,这是因为酒精压抑了某些大脑中枢的活动,这些中枢在平时对极兴奋行为起抑制作用。但很快大部分人会变得安静、忧郁、恍惚、直至不省人事,严重时甚至会因心脏被麻醉或呼吸中枢失去功能而造成窒息死亡。
乙醇在人体中可直接被肠胃吸收,并很快扩散进入血液分布至全身各器官,主要是肝脏和大脑中。通常情况下,一个健康成人在24h中能够排出的酒精最大含量为50g。
第三节《乙醇与乙酸》
第1课时
乙醇
新人教版高一化学必修第二册第七章
阅读课本77页第二段,归纳和总结乙醇的物理性质。
活动.探究
气
味:
无色透明
特殊香味
液体
比水小
20℃时,密度是0.7893g/ml
跟水以任意比互溶能够溶解多种无机物和
有机物,重要的有机溶剂。
易挥发,沸点78.5℃
一、乙醇(俗称
酒精)
颜
色:
溶解性:
密
度:
挥发性:
状
态:
1、乙醇的物理性质
C
C
O
H
H
H
H
H
H
A
式
C
O
C
H
H
H
H
H
H
B
式
两者互为同分异构体,究竟哪一个是乙醇分子的结构式?
分子式:C2H6O
2、乙醇的组成和结构
结构式:
试着写,碳四价,氧两价
实验7-4:网上搜索钠与乙醇反应的实验视频并观看
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2
NaOH
+H2↑
?
仍是块状
[交流讨论]
经测定1mol乙醇与足量的钠反应,生成0.5mol的氢气,据此判断乙醇的结构式为哪种?
C
C
O
H
H
H
H
H
H
A
式
2CH3CH2OH+2Na=2CH3CH2ONa+H2
C
O
C
H
H
H
H
H
H
B
式
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH或C2H5OH
羟基
写作-OH
分子式:
二、乙醇的结构
C2H6O
结构简式:
乙基
请完成下表:
氢氧根OH-
羟基-OH
电子式
带电性
稳定性
存在
[
]-
O
H
·
·
·
·
×
·
·
×
O
H
·
·
·
·
×
·
·
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
判断方法:出含有碳氢元素外还含有其他元素。
讨论:
什么是烃?乙醇是烃吗?
例子:卤代烃:一氯甲烷、二氯甲烷、
1、2-二溴乙烷
三、乙醇的化学性质
1、与活泼金属反应
产物名称:乙醇钠。注意:断键处在羟基中的氢氧键
2C2H5OH+2Na
2C2H5ONa+H2
2H2O
+
2
Na
=
2
NaOH
+
H2
H
H
H-C-C-O—H
H
H
置换反应
其它活泼金属如钾、钙、镁等也可与乙醇反应。
比较乙醇与水羟基上的H的活泼性强弱。
电离出氢离子的能力:
水
(大于或小于)乙醇
大于
⑴燃烧
2、氧化反应
点燃
CH3CH2OH
+
3O2
2CO2
+
3
H2O
现象:乙醇在空气中燃烧,发出淡蓝色的火焰,烧杯壁上出现液滴,
生成的气体能使澄清石灰水变浑浊.
乙醇汽油由90%的普通汽油与10%的燃料乙醇调和而成。
【实验7-5】搜索视频乙醇的催化氧化并观看
在试管中加入3-5mL无水乙醇,将铜丝烧热,迅速插入乙醇中,反复多次,观察铜丝颜色和乙醇气味的变化。
实
验
现
象
将铜丝在火焰上烧热
铜丝由红色变成黑色
将烧热的铜丝插入无水乙醇中
铜丝由黑色变成红色,反复多次后闻到刺激性气味
2CH3CH2OH
+
O2
→
2CH3CHO
+
2H2O
Cu
△
1、铜在反应中起着
的作用.
催化
2、乙醇在实验中是
(填“被氧化”或“被还原”),乙醇发生了
反应。
被氧化
氧化反应
注:-CHO
不能写成
-COH
⑵催化氧化
乙醇催化氧化的断键位置
分析讨论
⑶与强氧化剂反应
乙醇与酸性高锰酸钾或酸性重铬酸钾溶液反应,被直接氧化成乙酸
K2Cr2O7+C2H5OH+H2SO4=
橙红色
Cr2(SO4)3+CH3COOH+
K2SO4+H2O
绿色
在有机反应中,把有机化合物在反应中脱氢或者加氧的反应看成是氧化反应;
把有机化合物在反应中加氢或者脱氧的反应看成是还原反应。
拓展
官能团:官能团是指决定有机化合物的化学性质的原子或原子团。
例如:
卤代烃中卤原子(-X),X代表卤族元素(F,Cl,Br,I);
羟基(-OH);
烯烃中的碳碳双键(>C=C<)
炔烃中的碳碳叁键
思考:
乙醇发生置换反应、催化氧化反应的断键位置在什么地方?这说明了什么问题?
四、醇
(1)结构特点:
(2)官能团:羟基
(3)化学性质:
置换反应:活泼金属
氧化反应(燃烧、催化氧化、强氧化剂)
—OH
课堂小结
一、乙醇的结构
二、乙醇的物理性质
三、乙醇的化学性质
1.与活泼金属的置换反应
2.氧化反应(催化氧化、燃烧、强氧化剂)
杜康酒的由来
少年的杜康以放牧为生,带的饭食挂在树上,常常忘了吃。一段时间后,少康发现挂在树上的剩饭变了味,产生的汁水竟甘美异常,这引起了他的兴趣,就反复地研究思索,终于发现了自然发酵的原理,遂有意识地进行效仿,并不断改进,终于形成了一套完整的酿酒工艺,从而奠定了杜康中国酿酒业开山鼻祖的地位,其所造之酒也被命名为“杜康酒”。
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2+H2O
乙醛脱氢酶
(ALDH)
乙醇有加速人体血液循环、使人兴奋并改变人的情绪和行为的作用。人如果在短时间内饮用大量酒精,初始酒精会使人兴奋、减轻抑郁程度,这是因为酒精压抑了某些大脑中枢的活动,这些中枢在平时对极兴奋行为起抑制作用。但很快大部分人会变得安静、忧郁、恍惚、直至不省人事,严重时甚至会因心脏被麻醉或呼吸中枢失去功能而造成窒息死亡。
乙醇在人体中可直接被肠胃吸收,并很快扩散进入血液分布至全身各器官,主要是肝脏和大脑中。通常情况下,一个健康成人在24h中能够排出的酒精最大含量为50g。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
