2020-2021学年人教版高二化学选修3第二章2-2(2)轨道杂化 课件(30张ppt)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3第二章2-2(2)轨道杂化 课件(30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 21:51:40 | ||
图片预览





文档简介
分子结构与性质
第二章
第二节 分子的立体构型
2021-03-W
学习目标
杂化轨道理论
01
1.认识杂化轨道理论的要点
2.进一步了解有机化合物中碳的成键特征
3.根据杂化轨道理论判断简单分子或离子的构型
重难点
重点:杂化轨道理论的要点
难点:分子的立体结构,杂化轨道理论
思考1:根据甲烷的外围电子排布为2s22p2来看,甲烷外围的s和p轨道上的电子均与氢原子的s轨道上的电子形成了共用电子对,既有s-s σ键形成的轨道,也有s-p σ键形成的轨道,为什么甲烷是四对价电子均相同的正四面体空间构型呢?
思考与交流
C
H
H
H
H
正四面体
:
:
:
H C H
:
H
H
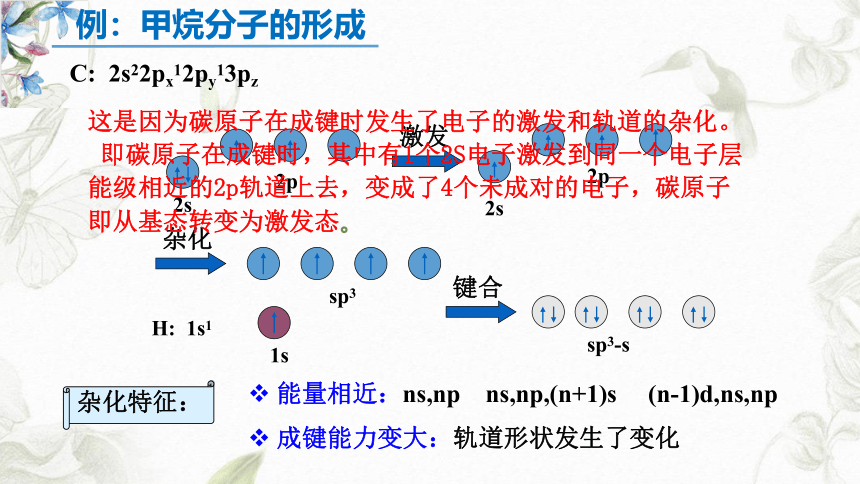
C: 2s22px12py13pz
2s
2p
1s
sp3
2s
2p
激发
杂化
H: 1s1
sp3-s
键合
杂化特征:
能量相近:ns,np ns,np,(n+1)s (n-1)d,ns,np
成键能力变大:轨道形状发生了变化
这是因为碳原子在成键时发生了电子的激发和轨道的杂化。
即碳原子在成键时,其中有1个2S电子激发到同一个电子层能级相近的2p轨道上去,变成了4个未成对的电子,碳原子即从基态转变为激发态。
例:甲烷分子的形成
三、杂化轨道理论简介
1.杂化轨道理论的概念
杂化后形成的新的一组能量相同的原子轨道
(1)轨道的杂化:
(2) 杂化轨道:
原子形成分子时,同一原子中能量相近的不同类
型的原子轨道在成键过程中混合组成新的原子轨道
三、杂化轨道理论简介
2.杂化轨道的类型
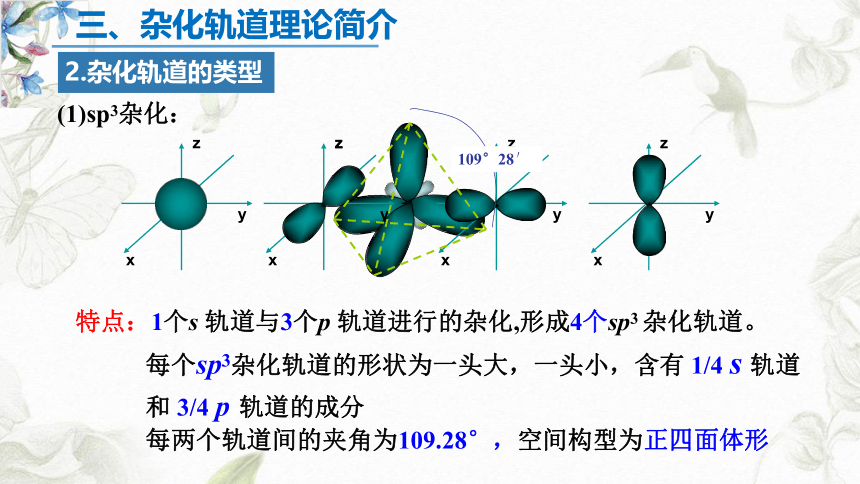
(1)sp3杂化:
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
特点:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状为一头大,一头小,含有 1/4 s 轨道和 3/4 p 轨道的成分
每两个轨道间的夹角为109.28°,空间构型为正四面体形
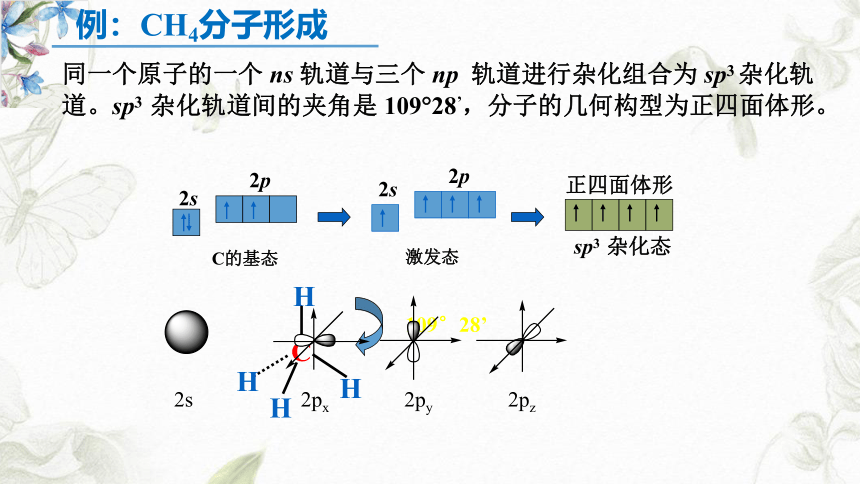
同一个原子的一个 ns 轨道与三个 np 轨道进行杂化组合为 sp3 杂化轨道。sp3 杂化轨道间的夹角是 109?28’,分子的几何构型为正四面体形。
2s
2p
C的基态
2s
2p
激发态
正四面体形
sp3 杂化态
C
H
H
H
H
109°28’
2s 2px 2py 2pz
例:CH4分子形成
三、杂化轨道理论简介
2.杂化轨道的类型
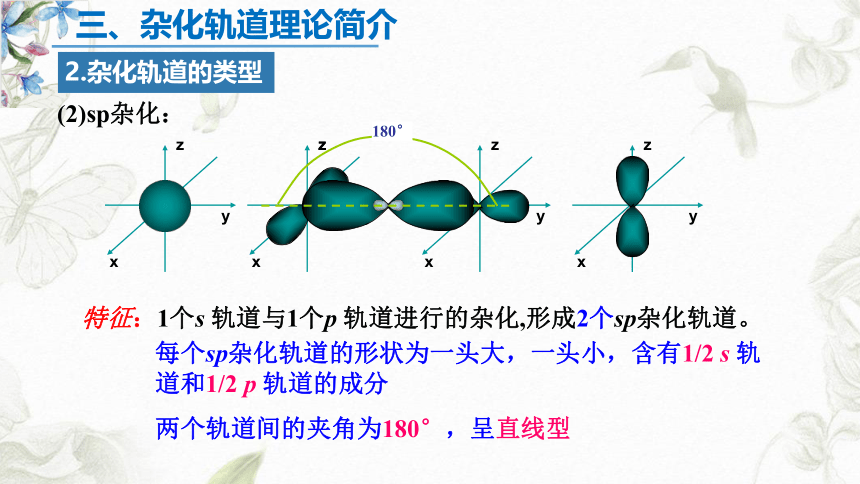
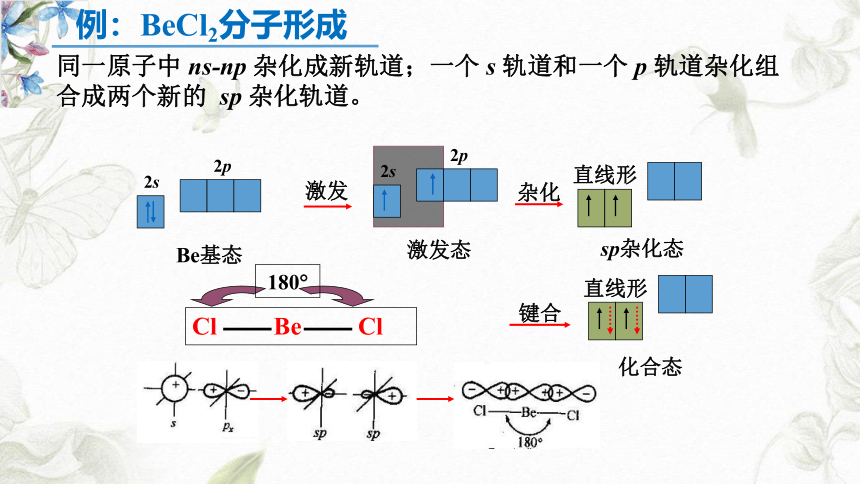
(2)sp杂化:
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
每个sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分
两个轨道间的夹角为180°,呈直线型
特征:1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。
同一原子中 ns-np 杂化成新轨道;一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。
激发
2s
2p
Be基态
2s
2p
激发态
杂化
键合
直线形
sp杂化态
直线形
化合态
Cl Be Cl
180?
例:BeCl2分子形成
三、杂化轨道理论简介
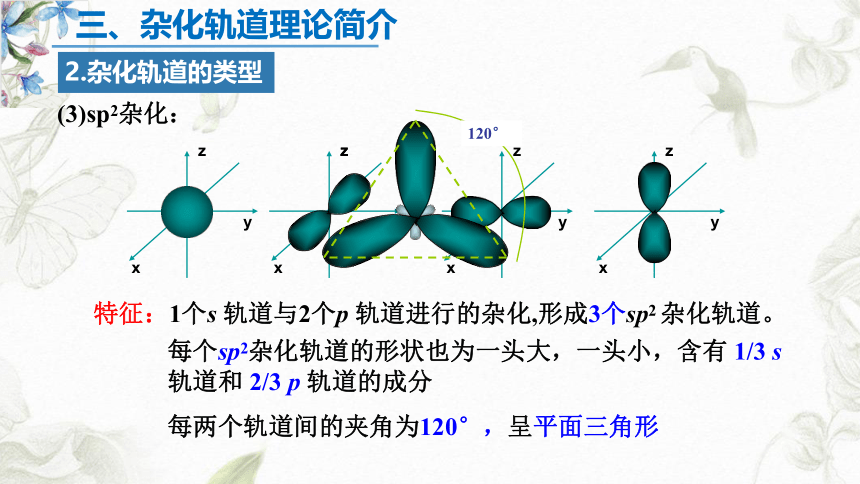
2.杂化轨道的类型
(3)sp2杂化:
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分
每两个轨道间的夹角为120°,呈平面三角形
特征:1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
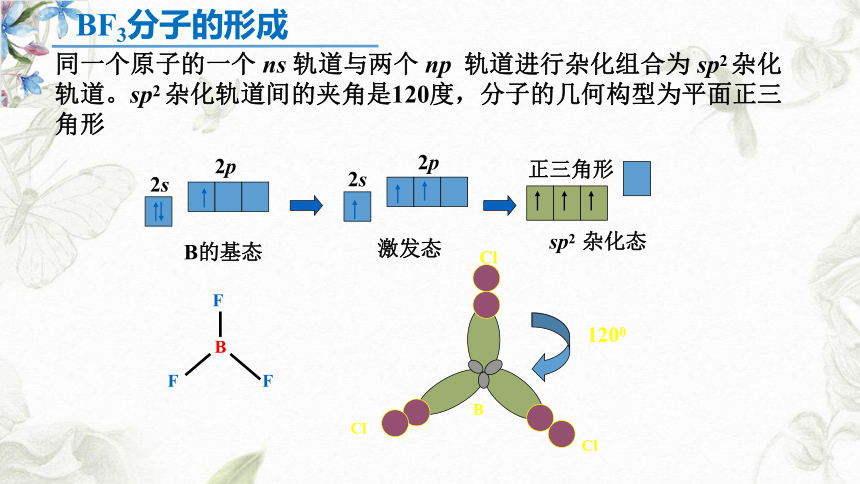
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120度,分子的几何构型为平面正三角形
2s
2p
B的基态
2s
2p
激发态
正三角形
sp2 杂化态
B
F
F
F
B
Cl
1200
Cl
Cl
BF3分子的形成
思考2:(1)写出HCN分子和CH2O分子的电子式。
(2)用VSEPR模型对HCN分子和CH2O分子的立体结构进行预测(用立体结构模型表示)
(3)写出HCN分子和CH2O分子的中心原子的杂化类型。
(4)分析HCN分子和CH2O分子中的π键。
思考与交流
(2)直线型 平面三角型
(3)sp杂化 sp2杂化
三、杂化轨道理论简介
3.杂化轨道类型的判断
VSEPR模型与中心原子杂化类型的关系:
分子
CO2
SO2
H2O
SO3
NH3
CH4
VSEPR模型名称
中心原子的杂化类型
平面三
角形
四面体
平面三角形
直线形
四面体
正四面体
sp
sp2
sp3
sp2
sp3
sp3
价层电子对:2 sp杂化
价层电子对:3 sp2杂化
价层电子对:4 sp3杂化
2015·山东(3)
F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
链节高考
2019全国1. (2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、_______。
???????????????????????????????????
?
2019江苏(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____________;
????????????、????????????
?
2019全国3.
(4)NH4H2PO4中,电负性最高的元素是_____;P的_____杂化轨道与O的2p轨道形成_____键。
O
sp3
σ
????形
?
????????????
?
杂化轨道理论的要点
(1)在形成多原子分子时,中心原子价电子层上的某些能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程,叫做轨道的杂化。双原子分子中,不存在杂化过程,原子数大于2的分子才会杂化。
(2)只有能量相近的轨道才能杂化(ns,np)。
(3)杂化过程中,原子轨道总数不变,即杂化轨道的数目与参与杂化的原子轨道数目相等。
知识小结
杂化轨道理论的要点
(4)杂化过程中,轨道的形状发生变化。
(5)杂化轨道的形状相同,能量相等。
(6)杂化轨道之间要满足最小排斥原理。
(7)杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。 π键是由未杂化的p轨道来形成的
知识小结
思考3:用杂化轨道理论分析CH4的杂化类型和呈正四面体形的原因?
在形成CH4分子时,碳原子的一个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4个σ键之间作用力相等,键角相等形成正四面体形。
思考与交流
思考4:试用杂化轨道理论分析乙烯和乙炔分子的成键情况?
思考与交流
思考4:试用杂化轨道理论分析乙烯和乙炔分子的成键情况?
思考与交流
C原子在形成乙烯分子时,碳原子的2s轨道与2个2p轨道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形的三个顶点。每个C原子的2个sp2杂化轨道分别与2个H原子的1s轨道形成2个相同的σ键,各自剩余的1个sp2杂化轨道相互重叠形成一个σ键,各自没有杂化的l个2p轨道则垂直于杂化轨道所在的平面,彼此肩并肩重叠形成π键。所以,在乙烯分子中双键由一个σ键和一个π键构成。
思考4:试用杂化轨道理论分析乙烯和乙炔分子的成键情况?
思考与交流
C原子在形成乙炔分子时发生sp杂化,两个碳原子以sp杂化轨道与氢原子的1s轨道结合形成σ键。各自剩余的1个sp杂化轨道相互形成1个σ键,两个碳原子的未杂化2p轨道分别在Y轴和Z轴方向重叠形成π键。所以乙炔分子中碳原子间以三键相结合。
平面正六边形,大π键。
苯分子中的键
苯分子中的σ键
苯分子中的????键
?
苯分子中的键
1.苯环中的碳均是以sp2杂化成夹角为1200三个sp2杂化轨道.
2.苯环中六个碳之间形成6个σ键,每个碳与氢形成1个σ键.
3.苯环中六个碳中未杂化的P轨道彼此形成一个大π键.
4.形成大π键比一般的π键更稳定,因此苯环体现特殊的稳定性
苯分子中的σ键
苯分子中的????键
?
通过看中心原子有没有形成双键或三键来判断中心原子的杂化类型。
规律:若中心原子有1个三键或2个双键,则其中有2个π键,用去2个P轨道,形成的是SP杂化(如CS2、C2H2与HCN);若中心原子有1个双键则其中必有1个π键,用去1个P轨道,形成的是SP2杂化(如C2H4与CH2O ) ;如果全部是单键,则形成SP3杂化(如CCl4)。
重要结论:价层电子对数=杂化后的杂化轨道数→杂化类型
知识小结
1.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是 ( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
课堂练习
A
C
课堂练习
2.下列分子中的中心原子采取sp2杂化的是( )
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥BeCl2 ⑦SO3 ⑧BF3
A.①②⑥⑦ B.③⑤⑦⑧
C.①③⑦⑧ D.③⑤⑥⑦
C
B
课堂练习
A
课堂练习
6.下列说法不正确的是( )
A.OF2的中心原子是SP3杂化,其空间构型为 V形
B.H3O+空间构型为三角锥形,SO32-的中心原子是SP3杂化
C.O3的空间构型为直线形,CO含有共价三键
D.乙醇中的C均为SP3杂化,H2O2中O也为SP3 杂化
C
课堂练习
感谢聆听
2021-03-W
第二章
第二节 分子的立体构型
2021-03-W
学习目标
杂化轨道理论
01
1.认识杂化轨道理论的要点
2.进一步了解有机化合物中碳的成键特征
3.根据杂化轨道理论判断简单分子或离子的构型
重难点
重点:杂化轨道理论的要点
难点:分子的立体结构,杂化轨道理论
思考1:根据甲烷的外围电子排布为2s22p2来看,甲烷外围的s和p轨道上的电子均与氢原子的s轨道上的电子形成了共用电子对,既有s-s σ键形成的轨道,也有s-p σ键形成的轨道,为什么甲烷是四对价电子均相同的正四面体空间构型呢?
思考与交流
C
H
H
H
H
正四面体
:
:
:
H C H
:
H
H
C: 2s22px12py13pz
2s
2p
1s
sp3
2s
2p
激发
杂化
H: 1s1
sp3-s
键合
杂化特征:
能量相近:ns,np ns,np,(n+1)s (n-1)d,ns,np
成键能力变大:轨道形状发生了变化
这是因为碳原子在成键时发生了电子的激发和轨道的杂化。
即碳原子在成键时,其中有1个2S电子激发到同一个电子层能级相近的2p轨道上去,变成了4个未成对的电子,碳原子即从基态转变为激发态。
例:甲烷分子的形成
三、杂化轨道理论简介
1.杂化轨道理论的概念
杂化后形成的新的一组能量相同的原子轨道
(1)轨道的杂化:
(2) 杂化轨道:
原子形成分子时,同一原子中能量相近的不同类
型的原子轨道在成键过程中混合组成新的原子轨道
三、杂化轨道理论简介
2.杂化轨道的类型
(1)sp3杂化:
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
特点:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状为一头大,一头小,含有 1/4 s 轨道和 3/4 p 轨道的成分
每两个轨道间的夹角为109.28°,空间构型为正四面体形
同一个原子的一个 ns 轨道与三个 np 轨道进行杂化组合为 sp3 杂化轨道。sp3 杂化轨道间的夹角是 109?28’,分子的几何构型为正四面体形。
2s
2p
C的基态
2s
2p
激发态
正四面体形
sp3 杂化态
C
H
H
H
H
109°28’
2s 2px 2py 2pz
例:CH4分子形成
三、杂化轨道理论简介
2.杂化轨道的类型
(2)sp杂化:
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
每个sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分
两个轨道间的夹角为180°,呈直线型
特征:1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。
同一原子中 ns-np 杂化成新轨道;一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。
激发
2s
2p
Be基态
2s
2p
激发态
杂化
键合
直线形
sp杂化态
直线形
化合态
Cl Be Cl
180?
例:BeCl2分子形成
三、杂化轨道理论简介
2.杂化轨道的类型
(3)sp2杂化:
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分
每两个轨道间的夹角为120°,呈平面三角形
特征:1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120度,分子的几何构型为平面正三角形
2s
2p
B的基态
2s
2p
激发态
正三角形
sp2 杂化态
B
F
F
F
B
Cl
1200
Cl
Cl
BF3分子的形成
思考2:(1)写出HCN分子和CH2O分子的电子式。
(2)用VSEPR模型对HCN分子和CH2O分子的立体结构进行预测(用立体结构模型表示)
(3)写出HCN分子和CH2O分子的中心原子的杂化类型。
(4)分析HCN分子和CH2O分子中的π键。
思考与交流
(2)直线型 平面三角型
(3)sp杂化 sp2杂化
三、杂化轨道理论简介
3.杂化轨道类型的判断
VSEPR模型与中心原子杂化类型的关系:
分子
CO2
SO2
H2O
SO3
NH3
CH4
VSEPR模型名称
中心原子的杂化类型
平面三
角形
四面体
平面三角形
直线形
四面体
正四面体
sp
sp2
sp3
sp2
sp3
sp3
价层电子对:2 sp杂化
价层电子对:3 sp2杂化
价层电子对:4 sp3杂化
2015·山东(3)
F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
链节高考
2019全国1. (2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、_______。
???????????????????????????????????
?
2019江苏(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____________;
????????????、????????????
?
2019全国3.
(4)NH4H2PO4中,电负性最高的元素是_____;P的_____杂化轨道与O的2p轨道形成_____键。
O
sp3
σ
????形
?
????????????
?
杂化轨道理论的要点
(1)在形成多原子分子时,中心原子价电子层上的某些能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程,叫做轨道的杂化。双原子分子中,不存在杂化过程,原子数大于2的分子才会杂化。
(2)只有能量相近的轨道才能杂化(ns,np)。
(3)杂化过程中,原子轨道总数不变,即杂化轨道的数目与参与杂化的原子轨道数目相等。
知识小结
杂化轨道理论的要点
(4)杂化过程中,轨道的形状发生变化。
(5)杂化轨道的形状相同,能量相等。
(6)杂化轨道之间要满足最小排斥原理。
(7)杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。 π键是由未杂化的p轨道来形成的
知识小结
思考3:用杂化轨道理论分析CH4的杂化类型和呈正四面体形的原因?
在形成CH4分子时,碳原子的一个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4个σ键之间作用力相等,键角相等形成正四面体形。
思考与交流
思考4:试用杂化轨道理论分析乙烯和乙炔分子的成键情况?
思考与交流
思考4:试用杂化轨道理论分析乙烯和乙炔分子的成键情况?
思考与交流
C原子在形成乙烯分子时,碳原子的2s轨道与2个2p轨道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形的三个顶点。每个C原子的2个sp2杂化轨道分别与2个H原子的1s轨道形成2个相同的σ键,各自剩余的1个sp2杂化轨道相互重叠形成一个σ键,各自没有杂化的l个2p轨道则垂直于杂化轨道所在的平面,彼此肩并肩重叠形成π键。所以,在乙烯分子中双键由一个σ键和一个π键构成。
思考4:试用杂化轨道理论分析乙烯和乙炔分子的成键情况?
思考与交流
C原子在形成乙炔分子时发生sp杂化,两个碳原子以sp杂化轨道与氢原子的1s轨道结合形成σ键。各自剩余的1个sp杂化轨道相互形成1个σ键,两个碳原子的未杂化2p轨道分别在Y轴和Z轴方向重叠形成π键。所以乙炔分子中碳原子间以三键相结合。
平面正六边形,大π键。
苯分子中的键
苯分子中的σ键
苯分子中的????键
?
苯分子中的键
1.苯环中的碳均是以sp2杂化成夹角为1200三个sp2杂化轨道.
2.苯环中六个碳之间形成6个σ键,每个碳与氢形成1个σ键.
3.苯环中六个碳中未杂化的P轨道彼此形成一个大π键.
4.形成大π键比一般的π键更稳定,因此苯环体现特殊的稳定性
苯分子中的σ键
苯分子中的????键
?
通过看中心原子有没有形成双键或三键来判断中心原子的杂化类型。
规律:若中心原子有1个三键或2个双键,则其中有2个π键,用去2个P轨道,形成的是SP杂化(如CS2、C2H2与HCN);若中心原子有1个双键则其中必有1个π键,用去1个P轨道,形成的是SP2杂化(如C2H4与CH2O ) ;如果全部是单键,则形成SP3杂化(如CCl4)。
重要结论:价层电子对数=杂化后的杂化轨道数→杂化类型
知识小结
1.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是 ( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
课堂练习
A
C
课堂练习
2.下列分子中的中心原子采取sp2杂化的是( )
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥BeCl2 ⑦SO3 ⑧BF3
A.①②⑥⑦ B.③⑤⑦⑧
C.①③⑦⑧ D.③⑤⑥⑦
C
B
课堂练习
A
课堂练习
6.下列说法不正确的是( )
A.OF2的中心原子是SP3杂化,其空间构型为 V形
B.H3O+空间构型为三角锥形,SO32-的中心原子是SP3杂化
C.O3的空间构型为直线形,CO含有共价三键
D.乙醇中的C均为SP3杂化,H2O2中O也为SP3 杂化
C
课堂练习
感谢聆听
2021-03-W
