2020-2021学年人教版高二化学选修3第二章2-3(2)范德华力氢键 课件(19张ppt)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3第二章2-3(2)范德华力氢键 课件(19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 15.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 21:54:10 | ||
图片预览


文档简介
分子的结构与性质
第三节 分子的性质
W:2021.3
学习目标:
1.
范德华力、氢键及其对物质性质的影响
2.
能举例说明化学键和分子间作用力的区别
3.
例举含有氢键的物质
重难点:
分子间作用力、氢键及其对物质性质的影响
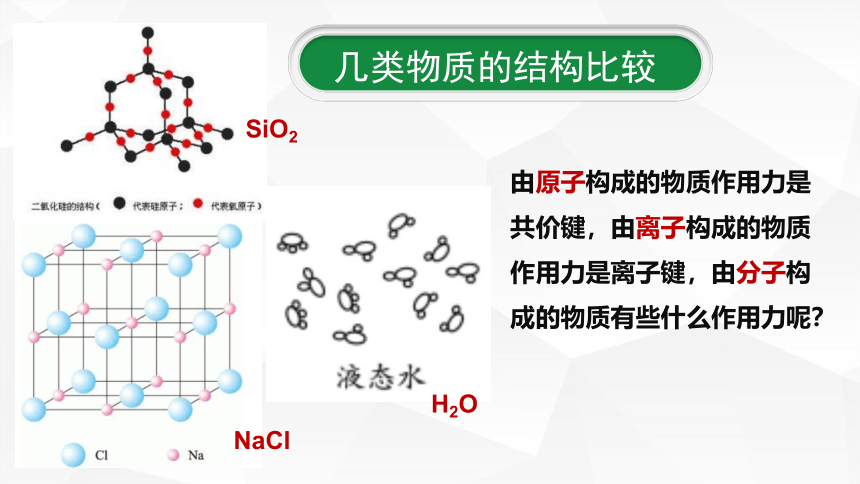
由原子构成的物质作用力是共价键,由离子构成的物质作用力是离子键,由分子构成的物质有些什么作用力呢?
几类物质的结构比较
SiO2
NaCl
H2O
思考与交流:
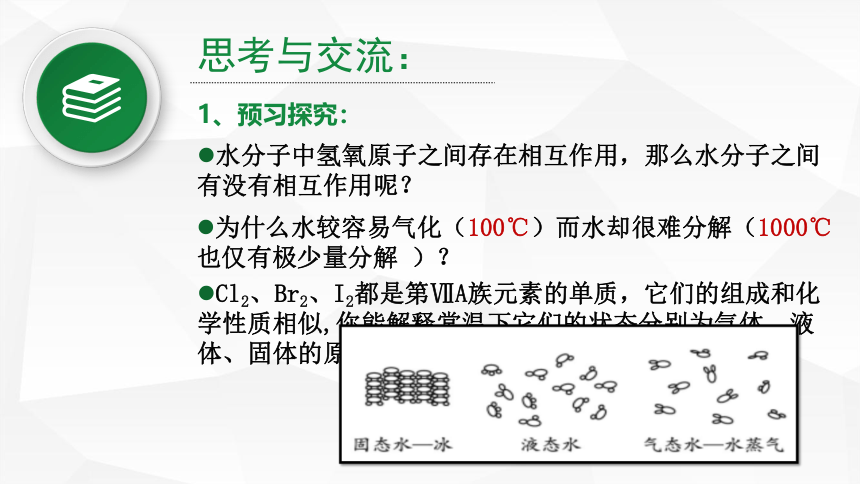
1、预习探究:
水分子中氢氧原子之间存在相互作用,那么水分子之间有没有相互作用呢?
为什么水较容易气化(100℃)而水却很难分解(1000℃也仅有极少量分解 )?
Cl2、Br2、I2都是第ⅦA族元素的单质,它们的组成和化学性质相似,你能解释常温下它们的状态分别为气体、液体、固体的原因吗?
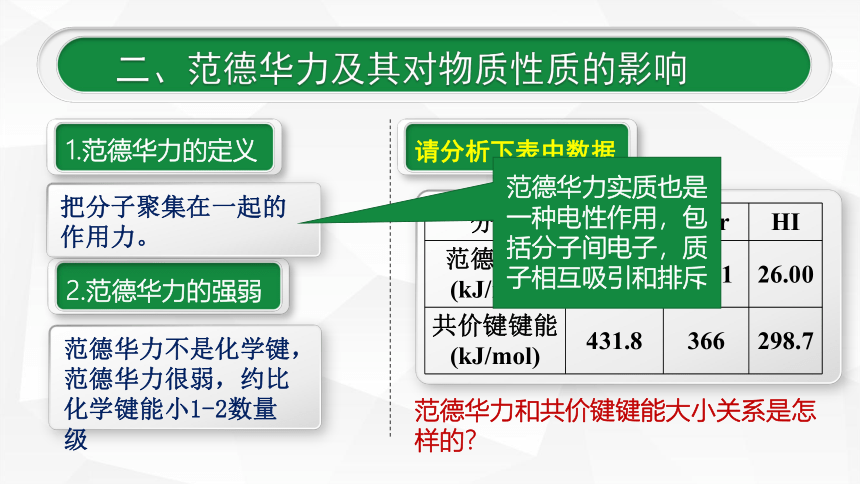
1.范德华力的定义
请分析下表中数据
2.范德华力的强弱
把分子聚集在一起的作用力。
范德华力不是化学键,范德华力很弱,约比化学键能小1-2数量级
二、范德华力及其对物质性质的影响
分子
HCl
HBr
HI
范德华力(kJ/mol)
21.14
23.11
26.00
共价键键能(kJ/mol)
431.8
366
298.7
范德华力和共价键键能大小关系是怎样的?
范德华力实质也是一种电性作用,包括分子间电子,质子相互吸引和排斥
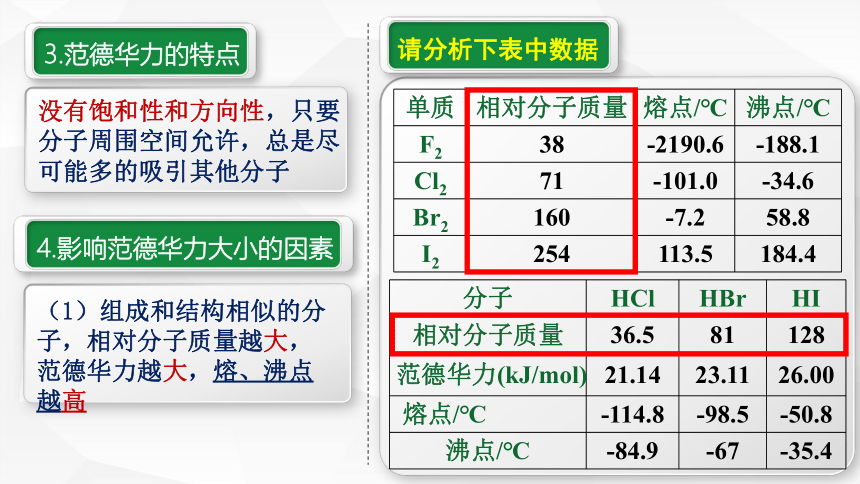
3.范德华力的特点
请分析下表中数据
4.影响范德华力大小的因素
没有饱和性和方向性,只要分子周围空间允许,总是尽可能多的吸引其他分子
单质
相对分子质量
熔点/℃
沸点/℃
F2
38
-2190.6
-188.1
Cl2
71
-101.0
-34.6
Br2
160
-7.2
58.8
I2
254
113.5
184.4
分子
HCl
HBr
HI
相对分子质量
36.5
81
128
范德华力(kJ/mol)
21.14
23.11
26.00
熔点/℃
-114.8
-98.5
-50.8
沸点/℃
-84.9
-67
-35.4
(1)组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高
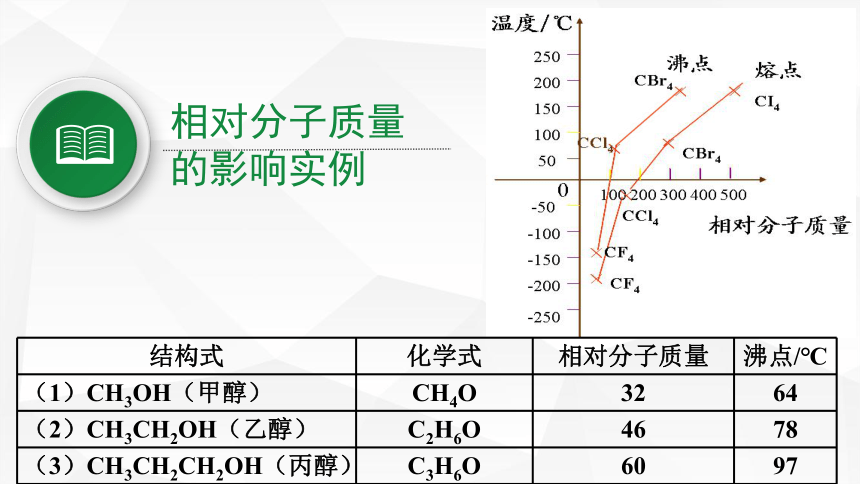
相对分子质量
的影响实例
结构式
化学式
相对分子质量
沸点/℃
(1)CH3OH(甲醇)
CH4O
32
64
(2)CH3CH2OH(乙醇)
C2H6O
46
78
(3)CH3CH2CH2OH(丙醇)
C3H6O
60
97
解题思路
烷烃的熔沸点随着C原子数增多有什么变化规律,烷烃的同分异构体呢(如正戊烷、异戊烷、新戊烷)?
随碳原子数增多,相对分子质量增大,分子间作用力增强,熔沸点增大,若为同分异构体,其相对分子质量相同,支链越多,熔沸点越低。
正戊烷>异戊烷>新戊烷
2.
思考与交流:
请分析下表中数据
4.影响范德华力大小的因素
(1)组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高
分子
相对分子质量
分子的
极性
熔点/℃
沸点/℃
CO
28
极性
-205.05
-191.49
N2
28
非极性
-210.00
-195.81
(2)相对分子质量相同或相近时,分子的极性越大,范德华力越大,熔、沸点越高
注意:范德华力主要影响物理性质(熔、沸点,溶解性等);化学键主要影响物质的化学性质。
还有什么因素对分子间作用力有影响?
某化学科研小组对范德华力提出了以下几种观点,你认为正确的是 。
A.范德华力存在于所有物质中
B.范德华力是影响所有物质物理性质的因素
C.Cl2相对于其他气体来说,是易液化的气体,由此可以得出结论,范德华力属于一种强作用
D.范德华力属于既没有方向性也没有饱和性的静电作用
E.范德华力是普遍存在的一种分子间作用力,属于电性作用
F.范德华力比较弱,但范德华力越强,物质的熔点和沸点越高
标题
1.
课堂训练
DEF
标题
2.
将干冰气化,破坏了CO2分子晶体的 ,将CO2气体溶于水,破坏了CO2分子 。
范德华力
共价键
标题
3.
3、解释CCl4(液体)CH4及CF4是气体,CI4是固体的原因。
它们均是正四面体结构,它们分子间范德华力随相对分子质量增大而增大,相对分子质量越大,范德华力越大。
范德华力大小: C I4> CCl4 >CF4 >CH4
思考与交流:
3、对于同一主族非金属元素的氢化物而言,从上到下,相对分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
一些氢化物的沸点
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用.这种作用就是氢键.
1.氢键的定义
例如:
氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力
三、氢键及其对物质性质的影响
在HF中 F 的电负性相当大, 电子对强烈地偏向 F, 而 H 几乎成了质子(H+), 这种 H 与另一个HF分子中电负性相当大、半径小的F相互接近时, 产生一种特殊的分子间力 —— 氢键.
F-H F-H
δ+
δ-
δ+
δ-
???
3.氢键的表示方法
一般表示为: X—H???Y — (其中X、Y为F、O、N)
“—”表示共价键,“ ???”表示氢键。
2.氢键的形成条件
(1)必须有与电负性很强的原子(如F, O, N)相连的 H
(2)分子中必须有原子半径小、带孤对电子的电负性很强的原子(如F, O, N)存在
注意:
一般来说,能形成氢键的元素有N、O、F。所以氢键一般存在于含N—H、H—O、H—F键的物质中,或有机化合物中的醇类和羧酸类等物质中。
F-H ??? F
例如:
4.氢键的特征
饱和性
方向性
5.氢键的类型
分子间氢键
分子内氢键
属于分子间作用力
不属于化学键,不属于分子间作用力,
109°28?
例如:
分子间氢键存在于如HF、H2O、NH3 、C2H5OH、CH3COOH 相互之间
分子内氢键某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构.
分子间氢键
分子内氢键
5.氢键的类型
思考与交流:
4.(1)氨水溶液中有哪些氢键,请用氢键表示式表示出来。
氨水中的氢键有三种,分别是氨分子与氨分子之间(N-H???N)、水分子与水分子之间(O-H ??? O)、氨分子与水分子之间(O-H ??? N或N-H ??? O)。
(2)氨分子与水分子间的氢键,下图中合理的是 。
b
例如:
6.氢键对物质性质的影响
(1)氢键对物质熔沸点的影响
(2)氢键影响物质的溶解性
乙醇与水以任意比互溶,是因为乙醇与水分子间能形成氢键。
(3)氢键影响物质的密度
注意:氢键主要影响物理性质(熔、沸点,溶解性,密度等);化学键主要影响物质的化学性质。
液态水
在水蒸气中水以单个的H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n(如上图);在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上.
下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
标题
1.
课堂训练
C
标题
2.
下列关于范德华力与氢键的叙述中正确的是( )
A.任何物质中都存在范德华力,而氢键只存在于含有N、O、F的物质中
B.范德华力比氢键的作用还要弱
C.范德华力与氢键共同决定物质的物理性质
D.范德华力与氢键的强弱都只与相对分子质量有关
B
标题
3.
下列分子或离子中,不能形成分子间氢键的有 (填序号) 。
③④⑤
在HF2-即[F-H???F]-中,已经存在分子内氢键,所以没有可以形成分子间氢键的氢原子。
⑤形成分子间氢键和分子内氢键哪一种熔沸点高?
范德华力
氢键
分子间作用力
形成条件
对物质性质的影响
定义、特点、强弱
对物质性质影响
知识小结
第三节 分子的性质
W:2021.3
学习目标:
1.
范德华力、氢键及其对物质性质的影响
2.
能举例说明化学键和分子间作用力的区别
3.
例举含有氢键的物质
重难点:
分子间作用力、氢键及其对物质性质的影响
由原子构成的物质作用力是共价键,由离子构成的物质作用力是离子键,由分子构成的物质有些什么作用力呢?
几类物质的结构比较
SiO2
NaCl
H2O
思考与交流:
1、预习探究:
水分子中氢氧原子之间存在相互作用,那么水分子之间有没有相互作用呢?
为什么水较容易气化(100℃)而水却很难分解(1000℃也仅有极少量分解 )?
Cl2、Br2、I2都是第ⅦA族元素的单质,它们的组成和化学性质相似,你能解释常温下它们的状态分别为气体、液体、固体的原因吗?
1.范德华力的定义
请分析下表中数据
2.范德华力的强弱
把分子聚集在一起的作用力。
范德华力不是化学键,范德华力很弱,约比化学键能小1-2数量级
二、范德华力及其对物质性质的影响
分子
HCl
HBr
HI
范德华力(kJ/mol)
21.14
23.11
26.00
共价键键能(kJ/mol)
431.8
366
298.7
范德华力和共价键键能大小关系是怎样的?
范德华力实质也是一种电性作用,包括分子间电子,质子相互吸引和排斥
3.范德华力的特点
请分析下表中数据
4.影响范德华力大小的因素
没有饱和性和方向性,只要分子周围空间允许,总是尽可能多的吸引其他分子
单质
相对分子质量
熔点/℃
沸点/℃
F2
38
-2190.6
-188.1
Cl2
71
-101.0
-34.6
Br2
160
-7.2
58.8
I2
254
113.5
184.4
分子
HCl
HBr
HI
相对分子质量
36.5
81
128
范德华力(kJ/mol)
21.14
23.11
26.00
熔点/℃
-114.8
-98.5
-50.8
沸点/℃
-84.9
-67
-35.4
(1)组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高
相对分子质量
的影响实例
结构式
化学式
相对分子质量
沸点/℃
(1)CH3OH(甲醇)
CH4O
32
64
(2)CH3CH2OH(乙醇)
C2H6O
46
78
(3)CH3CH2CH2OH(丙醇)
C3H6O
60
97
解题思路
烷烃的熔沸点随着C原子数增多有什么变化规律,烷烃的同分异构体呢(如正戊烷、异戊烷、新戊烷)?
随碳原子数增多,相对分子质量增大,分子间作用力增强,熔沸点增大,若为同分异构体,其相对分子质量相同,支链越多,熔沸点越低。
正戊烷>异戊烷>新戊烷
2.
思考与交流:
请分析下表中数据
4.影响范德华力大小的因素
(1)组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高
分子
相对分子质量
分子的
极性
熔点/℃
沸点/℃
CO
28
极性
-205.05
-191.49
N2
28
非极性
-210.00
-195.81
(2)相对分子质量相同或相近时,分子的极性越大,范德华力越大,熔、沸点越高
注意:范德华力主要影响物理性质(熔、沸点,溶解性等);化学键主要影响物质的化学性质。
还有什么因素对分子间作用力有影响?
某化学科研小组对范德华力提出了以下几种观点,你认为正确的是 。
A.范德华力存在于所有物质中
B.范德华力是影响所有物质物理性质的因素
C.Cl2相对于其他气体来说,是易液化的气体,由此可以得出结论,范德华力属于一种强作用
D.范德华力属于既没有方向性也没有饱和性的静电作用
E.范德华力是普遍存在的一种分子间作用力,属于电性作用
F.范德华力比较弱,但范德华力越强,物质的熔点和沸点越高
标题
1.
课堂训练
DEF
标题
2.
将干冰气化,破坏了CO2分子晶体的 ,将CO2气体溶于水,破坏了CO2分子 。
范德华力
共价键
标题
3.
3、解释CCl4(液体)CH4及CF4是气体,CI4是固体的原因。
它们均是正四面体结构,它们分子间范德华力随相对分子质量增大而增大,相对分子质量越大,范德华力越大。
范德华力大小: C I4> CCl4 >CF4 >CH4
思考与交流:
3、对于同一主族非金属元素的氢化物而言,从上到下,相对分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
一些氢化物的沸点
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用.这种作用就是氢键.
1.氢键的定义
例如:
氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力
三、氢键及其对物质性质的影响
在HF中 F 的电负性相当大, 电子对强烈地偏向 F, 而 H 几乎成了质子(H+), 这种 H 与另一个HF分子中电负性相当大、半径小的F相互接近时, 产生一种特殊的分子间力 —— 氢键.
F-H F-H
δ+
δ-
δ+
δ-
???
3.氢键的表示方法
一般表示为: X—H???Y — (其中X、Y为F、O、N)
“—”表示共价键,“ ???”表示氢键。
2.氢键的形成条件
(1)必须有与电负性很强的原子(如F, O, N)相连的 H
(2)分子中必须有原子半径小、带孤对电子的电负性很强的原子(如F, O, N)存在
注意:
一般来说,能形成氢键的元素有N、O、F。所以氢键一般存在于含N—H、H—O、H—F键的物质中,或有机化合物中的醇类和羧酸类等物质中。
F-H ??? F
例如:
4.氢键的特征
饱和性
方向性
5.氢键的类型
分子间氢键
分子内氢键
属于分子间作用力
不属于化学键,不属于分子间作用力,
109°28?
例如:
分子间氢键存在于如HF、H2O、NH3 、C2H5OH、CH3COOH 相互之间
分子内氢键某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构.
分子间氢键
分子内氢键
5.氢键的类型
思考与交流:
4.(1)氨水溶液中有哪些氢键,请用氢键表示式表示出来。
氨水中的氢键有三种,分别是氨分子与氨分子之间(N-H???N)、水分子与水分子之间(O-H ??? O)、氨分子与水分子之间(O-H ??? N或N-H ??? O)。
(2)氨分子与水分子间的氢键,下图中合理的是 。
b
例如:
6.氢键对物质性质的影响
(1)氢键对物质熔沸点的影响
(2)氢键影响物质的溶解性
乙醇与水以任意比互溶,是因为乙醇与水分子间能形成氢键。
(3)氢键影响物质的密度
注意:氢键主要影响物理性质(熔、沸点,溶解性,密度等);化学键主要影响物质的化学性质。
液态水
在水蒸气中水以单个的H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n(如上图);在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上.
下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
标题
1.
课堂训练
C
标题
2.
下列关于范德华力与氢键的叙述中正确的是( )
A.任何物质中都存在范德华力,而氢键只存在于含有N、O、F的物质中
B.范德华力比氢键的作用还要弱
C.范德华力与氢键共同决定物质的物理性质
D.范德华力与氢键的强弱都只与相对分子质量有关
B
标题
3.
下列分子或离子中,不能形成分子间氢键的有 (填序号) 。
③④⑤
在HF2-即[F-H???F]-中,已经存在分子内氢键,所以没有可以形成分子间氢键的氢原子。
⑤形成分子间氢键和分子内氢键哪一种熔沸点高?
范德华力
氢键
分子间作用力
形成条件
对物质性质的影响
定义、特点、强弱
对物质性质影响
知识小结
