2020-2021学年人教版高二化学选修3第二章2-3(3)手性分子含氧酸 课件(20张ppt)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3第二章2-3(3)手性分子含氧酸 课件(20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 00:00:00 | ||
图片预览






文档简介
分子的结构与性质
第三节 分子的性质
W:2021.3
学习目标:
1.
从分子的角度认识“相似相溶”规律
2.
了解“手性分子”在生命科学方面的应用
3.
能用分子结构的知识解释无机含氧酸分子的酸性
重难点:
手性分子,无机含氧酸分子的酸性
迁移训练 在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是 。?
(2)以极性键相结合,具有直线形结构的非极性分子是 。?
(3)以极性键相结合,具有三角锥形结构的极性分子是 。?
(4)以极性键相结合,具有正四面体结构的非极性分子是 。?
(5)以极性键相结合,具有V形结构的极性分子是 。?
(6)以极性键相结合,而且分子极性最大的是 。
标题
1.
课前练习
N2
标题
2.
下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2单质的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下也难分解
D.干冰汽化
C
标题
3.
下列关于甲醛结构及性质的分析正确的是( )
A.C原子采取sp3杂化,O原子采取sp杂化
B.甲醛分子中心原子上的价层电子对数为4,含有一对孤电子对,是三角锥形结构
C.甲醛分子与水分子间可以形成氢键
D.甲醛分子为非极性分子
C
CS2
NH3
CH4
H2O
HF
思考与交流:
1.影响物质溶解性的外在因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2、 为什么HCl和NH3易溶于水,难溶于四氯化碳;而苯和碘却易溶于四氯化碳,难溶于水?
氨、HCl、水是极性分子,而苯、碘、四氯化碳是非极性分子。通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律。
温度
温度 压强
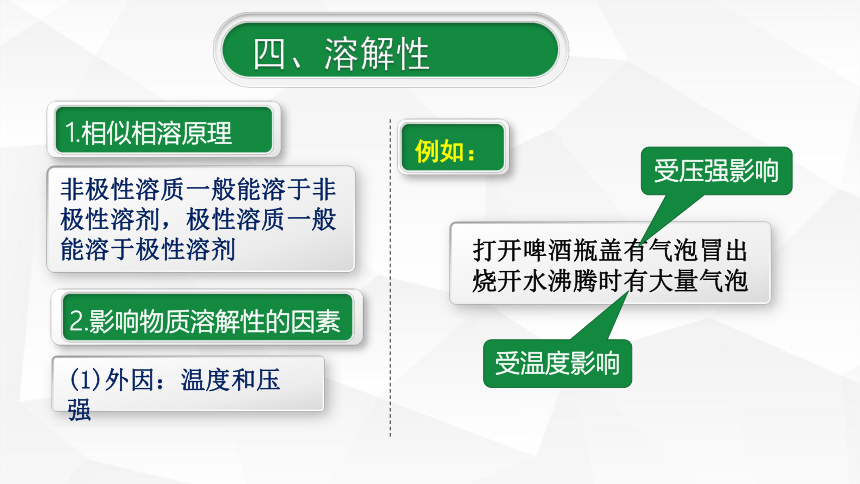
1.相似相溶原理
例如:
2.影响物质溶解性的因素
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂
(1)外因:温度和压强
四、溶解性
打开啤酒瓶盖有气泡冒出
烧开水沸腾时有大量气泡
受压强影响
受温度影响
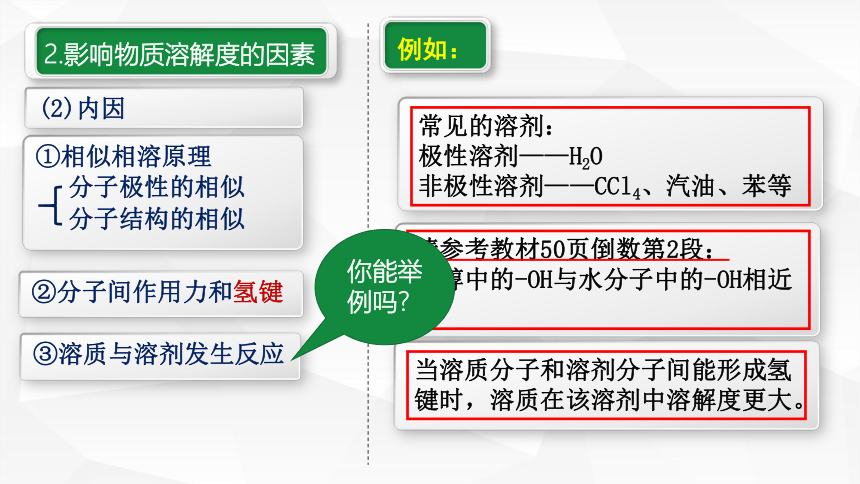
2.影响物质溶解度的因素
例如:
(2)内因
①相似相溶原理
②分子间作用力和氢键
分子极性的相似
分子结构的相似
常见的溶剂:
极性溶剂——H2O
非极性溶剂——CCl4、汽油、苯等
请参考教材50页倒数第2段:
乙醇中的-OH与水分子中的-OH相近
③溶质与溶剂发生反应
当溶质分子和溶剂分子间能形成氢键时,溶质在该溶剂中溶解度更大。
你能举例吗?
解题思路
比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
因为CH4是非极性分子,而NH3是极性分子,根据相似相溶规律,NH3易溶于极性溶剂H2O 中,且NH3与H2O之间还可形成氢键,也促进了NH3的溶解。
3.
思考与交流(51页):
4.
为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
因为油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水是极性溶剂。根据相似相溶规律,应用有机溶剂溶解油漆而不用水
从碘水中提取碘,可供选择的有机溶剂是 ( )
A.苯、酒精 B.汽油、甘油
C.四氯化碳、汽油 D.二硫化碳、酒精
标题
1.
课堂训练
C
标题
2.
碘单质在水中的溶解度很小,但在CCl4中的溶解度很大,这是因为( )
A.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B.CCl4与I2都是直线形分子,而H2O不是直线形分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
D
标题
3.
下列操作利用了相似相溶原理的是( )
A 用稀硝酸洗做过银镜反应实验的试管
B 用盐酸洗涤盛过石灰水的烧杯
C 用酒精洗做过碘升华实验的烧杯
D 用汽油洗干净沾上油漆的手
CD
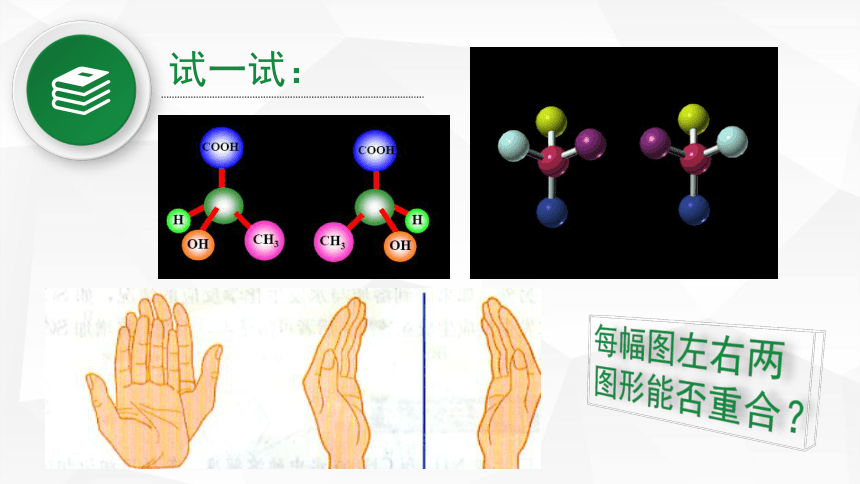
试一试:
每幅图左右两图形能否重合?
(α)右旋弹簧与左旋弹簧;(b)蜗牛壳;(c)左螺纹与右螺纹螺丝钉
物体与其镜像不能重合
1.手性
例如:
镜像对称,在三维空间里不能重叠。
五、手性
2.手性异构体
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。
4.手性碳原子
当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。
3.手性分子
有手性异构体的分子。
例如:
下列化合物中含有手性碳原子的是( )
A.CCl2F2
B.CH3CH2OH
标题
4.
课堂训练
D
标题
5.
分子式为C4H10O的有机物中含“手性”碳原子的结构简式为_____________。
CH3—C—CH2—CH3
H
OH
注意:
5.判断具有手性的依据
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。
当分子中只有一个C* ,分子一定有手性。
当分子中有多个手性中心时,要借助对称因素。无对称面,又无对称中心的分子,必是手性分子。
CH3—C—CH2—C — CH3
H H
OH OH
标题
6.
课堂训练
C
下列有机物分子中属于手性分子的是( )
①乳酸[CH3CH(OH)COOH] ②2-丁醇
A.① B.①②
C.①②③ D.①②③④
1.同主族元素或同周期元素最高价含氧酸的酸性比较,根据非金属性强弱去比较
⑴同一主族,自上而下,非金属元素最高价含氧酸酸性逐渐 ;
⑵同一周期,从左向右,非金属元素最高价含氧酸酸性逐渐 。
知识回顾
减弱
增强
2.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;
如:HClO< HClO2< HClO3用方程式证明S和Cl的非金属性强弱?
怎样用实验证明非金属性N>C>Si?
Cl2+H2S=S↓+2HCl
无机含氧酸酸性规律
例如:
1. (HO)mROn,如果成酸元素 ,则n值越大,即酸性越 。
六、无机含氧酸的酸性
2. (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。
H2SO3: (HO)2SO n=1
H2SO4 : (HO)2SO2 n=2
∴H2SO4 ﹥ H2SO3
HNO2: (HO)NO n=1
HNO3 : (HO)NO2 n=2
∴ HNO3 > HNO2
比较HClO、 HClO2、 HClO3 、HClO4的酸性强弱
强
R相同
HClO: (HO) Cl n=0
HClO2: (HO) ClO n=1
HClO3 : (HO) ClO2 n=2 HClO4 : (HO) ClO3 n=3
∴ HClO4 > HClO3 > HClO2 > HClO
观察归纳小结:
已知含氧酸可用通式XOm(OH)n表示,如X是S,m=2,n=2,则这个式子表示为H2SO4,下列各含氧酸中酸性最强的是( )
A.HClO3 B.H2SeO3
C.H2BO2 D.HMnO4
标题
7.
课堂训练
C
标题
8.
H3AsO4中强
不一致
CO2在水中的溶解度不大且不能完全转化为H2CO3
手性
含氧酸酸性
重点
酸性比较
非羟基氧的个数
手性碳原子
溶解性影响因素
知识小结
第三节 分子的性质
W:2021.3
学习目标:
1.
从分子的角度认识“相似相溶”规律
2.
了解“手性分子”在生命科学方面的应用
3.
能用分子结构的知识解释无机含氧酸分子的酸性
重难点:
手性分子,无机含氧酸分子的酸性
迁移训练 在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是 。?
(2)以极性键相结合,具有直线形结构的非极性分子是 。?
(3)以极性键相结合,具有三角锥形结构的极性分子是 。?
(4)以极性键相结合,具有正四面体结构的非极性分子是 。?
(5)以极性键相结合,具有V形结构的极性分子是 。?
(6)以极性键相结合,而且分子极性最大的是 。
标题
1.
课前练习
N2
标题
2.
下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2单质的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下也难分解
D.干冰汽化
C
标题
3.
下列关于甲醛结构及性质的分析正确的是( )
A.C原子采取sp3杂化,O原子采取sp杂化
B.甲醛分子中心原子上的价层电子对数为4,含有一对孤电子对,是三角锥形结构
C.甲醛分子与水分子间可以形成氢键
D.甲醛分子为非极性分子
C
CS2
NH3
CH4
H2O
HF
思考与交流:
1.影响物质溶解性的外在因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2、 为什么HCl和NH3易溶于水,难溶于四氯化碳;而苯和碘却易溶于四氯化碳,难溶于水?
氨、HCl、水是极性分子,而苯、碘、四氯化碳是非极性分子。通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律。
温度
温度 压强
1.相似相溶原理
例如:
2.影响物质溶解性的因素
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂
(1)外因:温度和压强
四、溶解性
打开啤酒瓶盖有气泡冒出
烧开水沸腾时有大量气泡
受压强影响
受温度影响
2.影响物质溶解度的因素
例如:
(2)内因
①相似相溶原理
②分子间作用力和氢键
分子极性的相似
分子结构的相似
常见的溶剂:
极性溶剂——H2O
非极性溶剂——CCl4、汽油、苯等
请参考教材50页倒数第2段:
乙醇中的-OH与水分子中的-OH相近
③溶质与溶剂发生反应
当溶质分子和溶剂分子间能形成氢键时,溶质在该溶剂中溶解度更大。
你能举例吗?
解题思路
比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
因为CH4是非极性分子,而NH3是极性分子,根据相似相溶规律,NH3易溶于极性溶剂H2O 中,且NH3与H2O之间还可形成氢键,也促进了NH3的溶解。
3.
思考与交流(51页):
4.
为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
因为油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水是极性溶剂。根据相似相溶规律,应用有机溶剂溶解油漆而不用水
从碘水中提取碘,可供选择的有机溶剂是 ( )
A.苯、酒精 B.汽油、甘油
C.四氯化碳、汽油 D.二硫化碳、酒精
标题
1.
课堂训练
C
标题
2.
碘单质在水中的溶解度很小,但在CCl4中的溶解度很大,这是因为( )
A.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B.CCl4与I2都是直线形分子,而H2O不是直线形分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
D
标题
3.
下列操作利用了相似相溶原理的是( )
A 用稀硝酸洗做过银镜反应实验的试管
B 用盐酸洗涤盛过石灰水的烧杯
C 用酒精洗做过碘升华实验的烧杯
D 用汽油洗干净沾上油漆的手
CD
试一试:
每幅图左右两图形能否重合?
(α)右旋弹簧与左旋弹簧;(b)蜗牛壳;(c)左螺纹与右螺纹螺丝钉
物体与其镜像不能重合
1.手性
例如:
镜像对称,在三维空间里不能重叠。
五、手性
2.手性异构体
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。
4.手性碳原子
当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。
3.手性分子
有手性异构体的分子。
例如:
下列化合物中含有手性碳原子的是( )
A.CCl2F2
B.CH3CH2OH
标题
4.
课堂训练
D
标题
5.
分子式为C4H10O的有机物中含“手性”碳原子的结构简式为_____________。
CH3—C—CH2—CH3
H
OH
注意:
5.判断具有手性的依据
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。
当分子中只有一个C* ,分子一定有手性。
当分子中有多个手性中心时,要借助对称因素。无对称面,又无对称中心的分子,必是手性分子。
CH3—C—CH2—C — CH3
H H
OH OH
标题
6.
课堂训练
C
下列有机物分子中属于手性分子的是( )
①乳酸[CH3CH(OH)COOH] ②2-丁醇
A.① B.①②
C.①②③ D.①②③④
1.同主族元素或同周期元素最高价含氧酸的酸性比较,根据非金属性强弱去比较
⑴同一主族,自上而下,非金属元素最高价含氧酸酸性逐渐 ;
⑵同一周期,从左向右,非金属元素最高价含氧酸酸性逐渐 。
知识回顾
减弱
增强
2.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;
如:HClO< HClO2< HClO3
怎样用实验证明非金属性N>C>Si?
Cl2+H2S=S↓+2HCl
无机含氧酸酸性规律
例如:
1. (HO)mROn,如果成酸元素 ,则n值越大,即酸性越 。
六、无机含氧酸的酸性
2. (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。
H2SO3: (HO)2SO n=1
H2SO4 : (HO)2SO2 n=2
∴H2SO4 ﹥ H2SO3
HNO2: (HO)NO n=1
HNO3 : (HO)NO2 n=2
∴ HNO3 > HNO2
比较HClO、 HClO2、 HClO3 、HClO4的酸性强弱
强
R相同
HClO: (HO) Cl n=0
HClO2: (HO) ClO n=1
HClO3 : (HO) ClO2 n=2 HClO4 : (HO) ClO3 n=3
∴ HClO4 > HClO3 > HClO2 > HClO
观察归纳小结:
已知含氧酸可用通式XOm(OH)n表示,如X是S,m=2,n=2,则这个式子表示为H2SO4,下列各含氧酸中酸性最强的是( )
A.HClO3 B.H2SeO3
C.H2BO2 D.HMnO4
标题
7.
课堂训练
C
标题
8.
H3AsO4
不一致
CO2在水中的溶解度不大且不能完全转化为H2CO3
手性
含氧酸酸性
重点
酸性比较
非羟基氧的个数
手性碳原子
溶解性影响因素
知识小结
