2020-2021学年人教版高二化学选修5第二章2.1 脂肪烃(2) 课件 (37张ppt)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修5第二章2.1 脂肪烃(2) 课件 (37张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 28.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 00:00:00 | ||
图片预览







文档简介
第二章
烃和卤代烃
2021.03: W
学习
目标
第一节
脂肪烃
1.以乙炔为例,了解炔烃的组成、结构、性质及其递变规律。
2.了解脂肪烃的来源及其应用。
3.能根据有机反应原理,初步学习实验方案的设计、评价、优选并完成实验。
计算:某烃含C 92.3%, 在相同条件下,对H2的相对密度为13,用最简式法求其分子式.
课前练习
解:
N(C) : N(H) =
92.3%12 :7.7%1
?
= 7.7 : 7.7
= 1 : 1
该物质的最简式为:CH
该物质的相对分子质量为:13×2 =26
?
(CH)n = 26
13n = 26
n = 2
该物质的分子式为:C2H2
三.乙炔和炔烃
1、乙炔
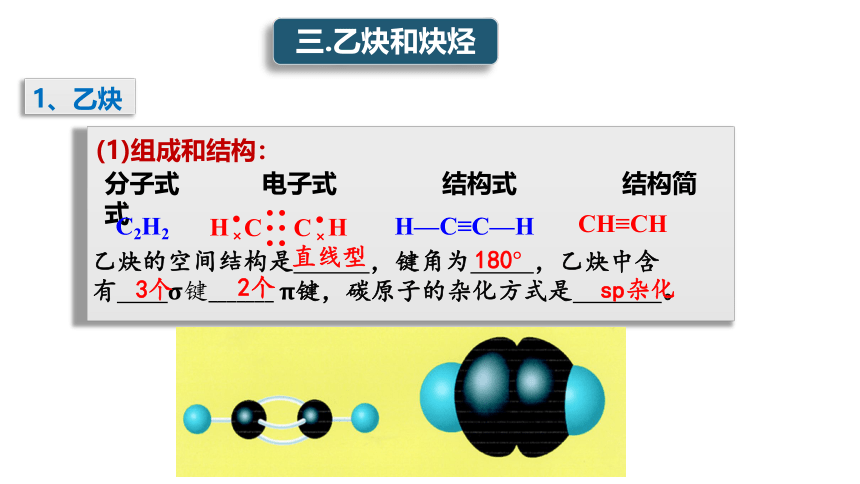
(1)组成和结构:
分子式 电子式 结构式 结构简式
C2H2
C
● ×
H
●●●
●●●
C
● ×
H
H—C≡C—H
CH≡CH
乙炔的空间结构是 ,键角为 ,乙炔中含有 ????键_______?????键,碳原子的杂化方式是 。
?
直线型
180°
?
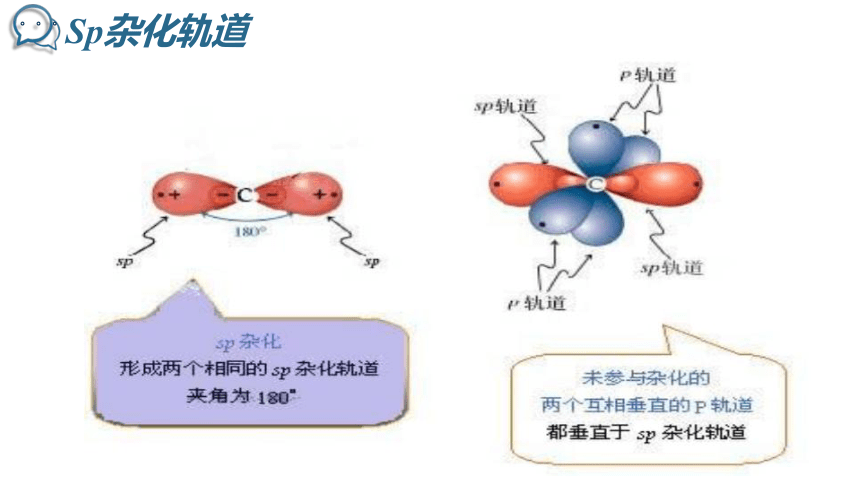
sp杂化
3个
2个
Sp杂化轨道
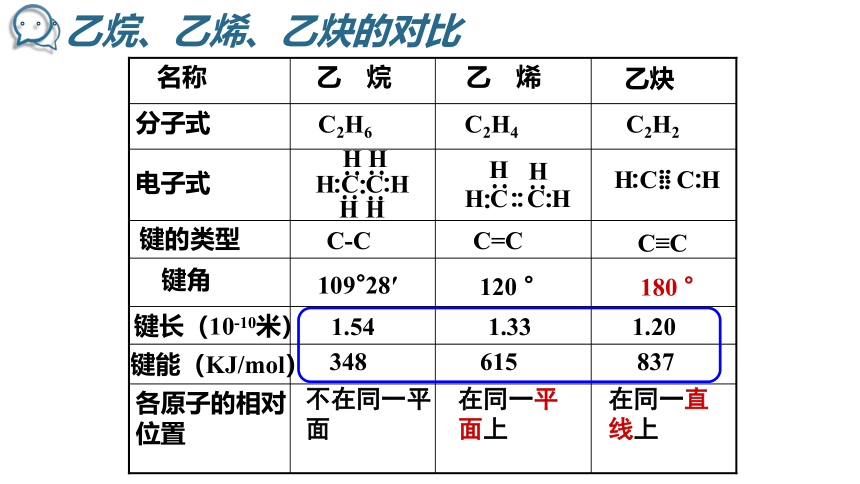
C-C
C=C
109°28′
120 °
不在同一平面
在同一平面上
各原子的相对位置
键的类型
电子式
分子式
乙 烯
乙 烷
名称
键长(10-10米)
键角
乙炔
C2H6
C2H4
C2H2
C≡C
180 °
在同一直线上
:
H C C H
:
:
:
:
:
:
H
H
H
H
:
H C C H
:
:
:
:
H
H
:
H C C H
:
:
:
:
:
:
乙烷、乙烯、乙炔的对比
1.54 1.33 1.20
键能(KJ/mol)
348 615 837
1、乙炔
(2)物理性质:
纯净的乙炔是无色无味的气体,微溶于水而易溶于有机溶剂,密度比相同条件下的空气略小(1.16g/L)。
收集乙炔应采用什么方法?
思考:根据乙烷、乙烯、乙炔的分子结构特点,请同学们预测乙炔可能具有哪些化学性质?
1、乙炔
(2)物理性质:
纯净的乙炔是无色无味的气体,微溶于水而易溶于有机溶剂,密度比相同条件下的空气略小(1.16g/L)。
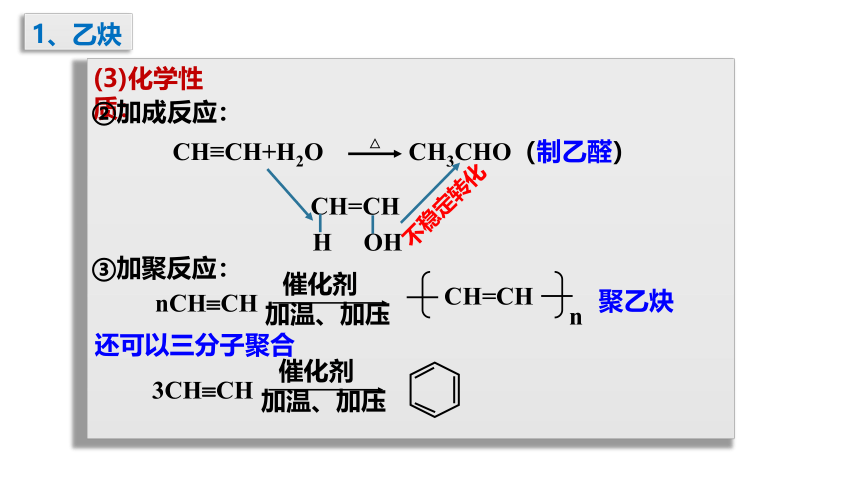
(3)化学性质:
①氧化反应:
2C2H2 + 5O2 ? 4CO2 + 2H2O
点燃
火焰明亮,伴有浓烟。
甲烷乙烯乙炔的燃烧
1、乙炔
(2)物理性质:
纯净的乙炔是无色无味的气体,微溶于水而易溶于有机溶剂,密度比相同条件下的空气略小(1.16g/L)。
(3)化学性质:
①氧化反应:
2C2H2 + 5O2 ? 4CO2 + 2H2O
点燃
火焰明亮,伴有黑烟。
②加成反应:
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
乙炔能使酸性KMnO4溶液褪色。
(同烯烃一样能与H2、Br2、HX、H2O等加成)
+ H2
CH2= CH2
CH CH
催化剂
CH2= CH2
CH3 -CH3
催化剂
+ H2
1、乙炔
(3)化学性质:
②加成反应:
1,2-二溴乙烯
1,1,2,2-四溴乙烷
+ Br2 →
H-C= C-H
Br
Br
CH CH
+ Br2 →
H-C= C-H
Br
Br
H-C - C-H
Br
Br
Br
Br
+ HCl
CH2= CHCl
CH CH
催化剂
n CH2=CH —CH2-CH — n
催化剂
Cl
Cl
[ ]
聚氯乙烯
1、乙炔
(3)化学性质:
②加成反应:
△
CH≡CH+H2O CH3CHO(制乙醛)
CH=CH
H OH
不稳定转化
③加聚反应:
nCH?CH
CH=CH
n
加温、加压
催化剂
还可以三分子聚合
3CH?CH
加温、加压
催化剂
聚乙炔
1、乙炔
(4)乙炔的用途
①加成反应:制塑料,合成纤维。
②乙炔水化法制乙醛。
③氧炔焰:切割或焊接金属。
乙炔的用途
2、乙炔的实验室制法
(1)药品
电石CaC2、水(饱和食盐水)。
工业上:
2CH4 CH ≡ CH + 3H2
?
高温
实验室制法:
(2)反应原理:
Ca(OH)2
CH CH +
Ca
C
C
H OH
H OH
+
CaC2﹢2H2O→
+ Ca(OH)2
CH CH↑
俗称:电石气
+2
-1
C2H2
CaC2是离子化合物,仅作理解用
用饱和食盐水是为了减缓反应速率,得到平稳的乙炔气流。
1.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的产物:
A.ZnC2水解生成 ( )
B.Al4C3水解生成 ( )
C.Mg2C3水解生成 ( )
D.Li2C2水解生成 ( )
C2H2
课堂练习
CH4
C3H4
C2H2
2、乙炔的实验室制法
(3)反应装置:
固+液 → 气体
固体加热
不用启普发生器的原因:
电石与水反应剧烈,难于控制
放出大量的热,易使启普发生器炸裂;
反应产生糊状的Ca(OH)2易堵塞启普发生器。
不加热
制取时在导管口塞棉花防止泡沫堵塞导气管口
常见 固+液→气 装置
2、乙炔的实验室制法
(4)净化装置:
将气体通过装有CuSO4或NaOH溶液的洗气瓶。
(5)气体收集:
排水法
纯净的乙炔气体是无色无味的气体。用电石和水反应制取的乙炔,常闻到有恶臭气味,是因为在电石中含有少量硫化钙、砷化钙、磷化钙等杂质,跟水作用时生成H2S、ASH3、PH3等气体有特殊的气味所致。
补充:电石的制备
CaCO3 CaO + CO2↑
高温
CaO+3C CaC2+CO↑
电炉
观察学习
3、炔烃
(2)通式:
CnH2n-2 (n≥2)
?
(3)结构特点:
二烯烃的通式 。
CnH2n-2 (n≥4)
?
同碳原子数的单炔烃和二烯烃是同分异构体
含有碳碳三键,炔烃中含有????键和 键,碳原子的杂化方式为 。碳原子数不同的单炔烃之间关系是 。
?
sp3和sp
同系物
????
?
(3)化学性质:
①氧化反应:
②加成反应:
炔烃能使酸性KMnO4溶液褪色。
(能与H2、Br2、HX、H2O等加成)
CnH2n-2+ ????????????????? O2 → nCO2+(n-1)H2O
?
点燃
③加聚反应:
(1)物理性质:同烷烃和烯烃。
2.描述CH3-CH=CH-C≡C-CH3分子结构的下列叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
课堂练习
BC
3.含一叁键的炔烃,氢化后的产物结构简式为
此炔烃可能有的结构有( )
A.1种 B.2种 C.3种 D.4种
B
课堂练习
4、某气态烃0.5mol能与1mol HCl氯化氢完全加成,加成产物分子上的氢原子又可被3mol Cl2取代,则气态烃可能是( )
A、CH ≡CH B、CH2=CH2
C、CH≡C—CH3 D、CH2=C(CH3)CH3
C
课堂练习
比较乙烷、乙烯、乙炔
乙烷
乙烯
乙炔
氧化反应
KMnO4不褪色
KMnO4褪色
KMnO4褪色
燃烧
火焰不明亮
火焰明亮、带黑烟
火焰明亮、带浓烟
鉴别
溴水不褪色
溴水褪色
溴水褪色
阅读思考
阅读教材34-35页,并思考下列问题:
(1)石油的成分是什么?石油炼制的方法?
(2)石油分馏的基本原理、主要设备,产物是什么?
(3)石油裂化的意义是什么?原理是什么?裂化和裂解有哪些区别?
四.脂肪烃的来源及其应用
1、脂肪烃的来源
脂肪烃的来源有石油、天然气和煤等。
2、石油的应用
(1)石油的成分:烷烃、环烷烃、芳香烃的混合物 。
(2)石油的炼制:分馏、裂化、裂解等。
原油分馏及裂化产品和用途
原油脱盐脱水石油 常压分馏
石油气(C1~C4)
汽油(C5~C11)
煤油(C10~C16)
柴油(C15~C18)
重油
石油的分馏
石油的炼制
过程
原理
原料
产品及用途
脱水
脱盐
分馏
裂化
裂解
除去原油中的盐和水,减少对设备的腐蚀。
利用加热和冷凝,把石油分成不同沸点范围的产物。
石油气,汽油,煤油,柴油,石蜡油、润滑油、重油。
轻质液体燃料(裂化汽油)
在一定条件下加热,把相对分子质量大、沸点高的烃断裂为相对分子质量较小、沸点较低的烃。
采用比裂化更高的温度,使其中的长链烃断裂成乙烯、丙烯等小分子
乙烯、丙烯、丁二烯等(有机化工的原料)
原油
原油
重油
直链烷烃
石油气
3.石油催化重整的目的有两个:提高汽油的辛烷值和制取芳香烃。
2.石油催解是深度的裂化,使短链的烷烃进一步分解生成乙烷、丙烷、丁烯等重要石油化工原料。
1.石油的催化裂化是将重油成分(如石油)在催化剂存在下,在460~520℃及100kPa~ 200kPa的压强下,长链烷烃断裂成短链烷烃和烯烃,从而大大提高汽油的产量。
观察学习
四.脂肪烃的来源及其应用
3、煤的应用
(1)煤的组成:
(2)煤的炼制:
无机物
有机物
C 、H元素—大量
N、S、O等元素—少量
Si 、Al、 Ca、 Fe
污染环境
COx NOx SO2 烟尘
煤的组成
观察学习
将煤隔绝空气加强热使其分解的过程,叫做煤的干馏
煤干馏的产物有哪些?
炉煤气、煤焦油、焦炭
煤的气化
在一定条件下把煤及其干馏物转化为煤气(CO、H2)。
煤的液化
在一定条件下将煤转化为液体燃料——又称人造石油,可继续精制成汽油,柴油,液化石油气,甲醇。在石油资源日益减少的情况下,煤的液化具有十分诱人的前景。
煤的干馏
蒸馏
分馏
干馏
操作过程
原理
目的
加热和冷凝
加热和冷凝
隔绝空气加强热
物理变化
物理变化
复杂的物理变化和化学变化
分离
精炼
加工煤
比较分馏、蒸馏、干馏
谢谢欣赏
烃和卤代烃
2021.03: W
学习
目标
第一节
脂肪烃
1.以乙炔为例,了解炔烃的组成、结构、性质及其递变规律。
2.了解脂肪烃的来源及其应用。
3.能根据有机反应原理,初步学习实验方案的设计、评价、优选并完成实验。
计算:某烃含C 92.3%, 在相同条件下,对H2的相对密度为13,用最简式法求其分子式.
课前练习
解:
N(C) : N(H) =
92.3%12 :7.7%1
?
= 7.7 : 7.7
= 1 : 1
该物质的最简式为:CH
该物质的相对分子质量为:13×2 =26
?
(CH)n = 26
13n = 26
n = 2
该物质的分子式为:C2H2
三.乙炔和炔烃
1、乙炔
(1)组成和结构:
分子式 电子式 结构式 结构简式
C2H2
C
● ×
H
●●●
●●●
C
● ×
H
H—C≡C—H
CH≡CH
乙炔的空间结构是 ,键角为 ,乙炔中含有 ????键_______?????键,碳原子的杂化方式是 。
?
直线型
180°
?
sp杂化
3个
2个
Sp杂化轨道
C-C
C=C
109°28′
120 °
不在同一平面
在同一平面上
各原子的相对位置
键的类型
电子式
分子式
乙 烯
乙 烷
名称
键长(10-10米)
键角
乙炔
C2H6
C2H4
C2H2
C≡C
180 °
在同一直线上
:
H C C H
:
:
:
:
:
:
H
H
H
H
:
H C C H
:
:
:
:
H
H
:
H C C H
:
:
:
:
:
:
乙烷、乙烯、乙炔的对比
1.54 1.33 1.20
键能(KJ/mol)
348 615 837
1、乙炔
(2)物理性质:
纯净的乙炔是无色无味的气体,微溶于水而易溶于有机溶剂,密度比相同条件下的空气略小(1.16g/L)。
收集乙炔应采用什么方法?
思考:根据乙烷、乙烯、乙炔的分子结构特点,请同学们预测乙炔可能具有哪些化学性质?
1、乙炔
(2)物理性质:
纯净的乙炔是无色无味的气体,微溶于水而易溶于有机溶剂,密度比相同条件下的空气略小(1.16g/L)。
(3)化学性质:
①氧化反应:
2C2H2 + 5O2 ? 4CO2 + 2H2O
点燃
火焰明亮,伴有浓烟。
甲烷乙烯乙炔的燃烧
1、乙炔
(2)物理性质:
纯净的乙炔是无色无味的气体,微溶于水而易溶于有机溶剂,密度比相同条件下的空气略小(1.16g/L)。
(3)化学性质:
①氧化反应:
2C2H2 + 5O2 ? 4CO2 + 2H2O
点燃
火焰明亮,伴有黑烟。
②加成反应:
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
乙炔能使酸性KMnO4溶液褪色。
(同烯烃一样能与H2、Br2、HX、H2O等加成)
+ H2
CH2= CH2
CH CH
催化剂
CH2= CH2
CH3 -CH3
催化剂
+ H2
1、乙炔
(3)化学性质:
②加成反应:
1,2-二溴乙烯
1,1,2,2-四溴乙烷
+ Br2 →
H-C= C-H
Br
Br
CH CH
+ Br2 →
H-C= C-H
Br
Br
H-C - C-H
Br
Br
Br
Br
+ HCl
CH2= CHCl
CH CH
催化剂
n CH2=CH —CH2-CH — n
催化剂
Cl
Cl
[ ]
聚氯乙烯
1、乙炔
(3)化学性质:
②加成反应:
△
CH≡CH+H2O CH3CHO(制乙醛)
CH=CH
H OH
不稳定转化
③加聚反应:
nCH?CH
CH=CH
n
加温、加压
催化剂
还可以三分子聚合
3CH?CH
加温、加压
催化剂
聚乙炔
1、乙炔
(4)乙炔的用途
①加成反应:制塑料,合成纤维。
②乙炔水化法制乙醛。
③氧炔焰:切割或焊接金属。
乙炔的用途
2、乙炔的实验室制法
(1)药品
电石CaC2、水(饱和食盐水)。
工业上:
2CH4 CH ≡ CH + 3H2
?
高温
实验室制法:
(2)反应原理:
Ca(OH)2
CH CH +
Ca
C
C
H OH
H OH
+
CaC2﹢2H2O→
+ Ca(OH)2
CH CH↑
俗称:电石气
+2
-1
C2H2
CaC2是离子化合物,仅作理解用
用饱和食盐水是为了减缓反应速率,得到平稳的乙炔气流。
1.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的产物:
A.ZnC2水解生成 ( )
B.Al4C3水解生成 ( )
C.Mg2C3水解生成 ( )
D.Li2C2水解生成 ( )
C2H2
课堂练习
CH4
C3H4
C2H2
2、乙炔的实验室制法
(3)反应装置:
固+液 → 气体
固体加热
不用启普发生器的原因:
电石与水反应剧烈,难于控制
放出大量的热,易使启普发生器炸裂;
反应产生糊状的Ca(OH)2易堵塞启普发生器。
不加热
制取时在导管口塞棉花防止泡沫堵塞导气管口
常见 固+液→气 装置
2、乙炔的实验室制法
(4)净化装置:
将气体通过装有CuSO4或NaOH溶液的洗气瓶。
(5)气体收集:
排水法
纯净的乙炔气体是无色无味的气体。用电石和水反应制取的乙炔,常闻到有恶臭气味,是因为在电石中含有少量硫化钙、砷化钙、磷化钙等杂质,跟水作用时生成H2S、ASH3、PH3等气体有特殊的气味所致。
补充:电石的制备
CaCO3 CaO + CO2↑
高温
CaO+3C CaC2+CO↑
电炉
观察学习
3、炔烃
(2)通式:
CnH2n-2 (n≥2)
?
(3)结构特点:
二烯烃的通式 。
CnH2n-2 (n≥4)
?
同碳原子数的单炔烃和二烯烃是同分异构体
含有碳碳三键,炔烃中含有????键和 键,碳原子的杂化方式为 。碳原子数不同的单炔烃之间关系是 。
?
sp3和sp
同系物
????
?
(3)化学性质:
①氧化反应:
②加成反应:
炔烃能使酸性KMnO4溶液褪色。
(能与H2、Br2、HX、H2O等加成)
CnH2n-2+ ????????????????? O2 → nCO2+(n-1)H2O
?
点燃
③加聚反应:
(1)物理性质:同烷烃和烯烃。
2.描述CH3-CH=CH-C≡C-CH3分子结构的下列叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
课堂练习
BC
3.含一叁键的炔烃,氢化后的产物结构简式为
此炔烃可能有的结构有( )
A.1种 B.2种 C.3种 D.4种
B
课堂练习
4、某气态烃0.5mol能与1mol HCl氯化氢完全加成,加成产物分子上的氢原子又可被3mol Cl2取代,则气态烃可能是( )
A、CH ≡CH B、CH2=CH2
C、CH≡C—CH3 D、CH2=C(CH3)CH3
C
课堂练习
比较乙烷、乙烯、乙炔
乙烷
乙烯
乙炔
氧化反应
KMnO4不褪色
KMnO4褪色
KMnO4褪色
燃烧
火焰不明亮
火焰明亮、带黑烟
火焰明亮、带浓烟
鉴别
溴水不褪色
溴水褪色
溴水褪色
阅读思考
阅读教材34-35页,并思考下列问题:
(1)石油的成分是什么?石油炼制的方法?
(2)石油分馏的基本原理、主要设备,产物是什么?
(3)石油裂化的意义是什么?原理是什么?裂化和裂解有哪些区别?
四.脂肪烃的来源及其应用
1、脂肪烃的来源
脂肪烃的来源有石油、天然气和煤等。
2、石油的应用
(1)石油的成分:烷烃、环烷烃、芳香烃的混合物 。
(2)石油的炼制:分馏、裂化、裂解等。
原油分馏及裂化产品和用途
原油脱盐脱水石油 常压分馏
石油气(C1~C4)
汽油(C5~C11)
煤油(C10~C16)
柴油(C15~C18)
重油
石油的分馏
石油的炼制
过程
原理
原料
产品及用途
脱水
脱盐
分馏
裂化
裂解
除去原油中的盐和水,减少对设备的腐蚀。
利用加热和冷凝,把石油分成不同沸点范围的产物。
石油气,汽油,煤油,柴油,石蜡油、润滑油、重油。
轻质液体燃料(裂化汽油)
在一定条件下加热,把相对分子质量大、沸点高的烃断裂为相对分子质量较小、沸点较低的烃。
采用比裂化更高的温度,使其中的长链烃断裂成乙烯、丙烯等小分子
乙烯、丙烯、丁二烯等(有机化工的原料)
原油
原油
重油
直链烷烃
石油气
3.石油催化重整的目的有两个:提高汽油的辛烷值和制取芳香烃。
2.石油催解是深度的裂化,使短链的烷烃进一步分解生成乙烷、丙烷、丁烯等重要石油化工原料。
1.石油的催化裂化是将重油成分(如石油)在催化剂存在下,在460~520℃及100kPa~ 200kPa的压强下,长链烷烃断裂成短链烷烃和烯烃,从而大大提高汽油的产量。
观察学习
四.脂肪烃的来源及其应用
3、煤的应用
(1)煤的组成:
(2)煤的炼制:
无机物
有机物
C 、H元素—大量
N、S、O等元素—少量
Si 、Al、 Ca、 Fe
污染环境
COx NOx SO2 烟尘
煤的组成
观察学习
将煤隔绝空气加强热使其分解的过程,叫做煤的干馏
煤干馏的产物有哪些?
炉煤气、煤焦油、焦炭
煤的气化
在一定条件下把煤及其干馏物转化为煤气(CO、H2)。
煤的液化
在一定条件下将煤转化为液体燃料——又称人造石油,可继续精制成汽油,柴油,液化石油气,甲醇。在石油资源日益减少的情况下,煤的液化具有十分诱人的前景。
煤的干馏
蒸馏
分馏
干馏
操作过程
原理
目的
加热和冷凝
加热和冷凝
隔绝空气加强热
物理变化
物理变化
复杂的物理变化和化学变化
分离
精炼
加工煤
比较分馏、蒸馏、干馏
谢谢欣赏
