2020-2021学年人教版高二化学选修3第二章2-2(3)配合物理论 课件(23张ppt)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3第二章2-2(3)配合物理论 课件(23张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 22:01:16 | ||
图片预览








文档简介
分子结构与性质
第二章
第二节 分子的立体构型
2021-03-W
学习目标
配合物理论简介
01
1.配位键、配位化合物的概念
2.配位键配位化合物的表示方法
重难点
重点:配位键、配位化合物的概念
难点:配位键、配位化合物的概念
思考1:教材实验2-1,将下表中的少量固体溶于足量的水,观察实验现象。
思考与交流
上述实验中呈天蓝色是因为溶液中含有水合铜离子:
固体
CuSO4
CuCl2·2H2O
CuBr2
NaCl
K2SO4
KBr
固体颜色
白色
绿色
深褐色
白色
白色
白色
溶液颜色
实验说明
天蓝色
天蓝色
无色
无色
无色
天蓝色
[Cu(H2O)4]2+
[Cu(H2O)4]2+
SO42 –
Na+
Cl-
K +
Br -
K +
无色离子:
什么离子呈天蓝色:
思考2:请写出H3O+和NH4+的电子式,并分析H2O与H+是怎样结合呈H3O+的,NH3和H+是怎么结合成NH4+的?
思考与交流
四、配合物理论简介
1.配位键
(1)配位键的定义:
“电子对给予—接受键”被称为配位键。一方提供孤对电子;一方有空轨道,接受孤对电子。
如: H3O+、NH4+、[Cu(H20)42+] 中存在配位键。
(2)成键粒子:
(3)成键性质:
(4)成键条件:
(5)配位键的表示方法:
原子
共用电子对对两原子的电性作用
一方是能够提供孤对电子,另一方能够提供空轨道。
A→B(表明共用电子对由A原子提供给B)
配位键除了电子由一方单方面提供,其它性质与别的共价键没有区别。
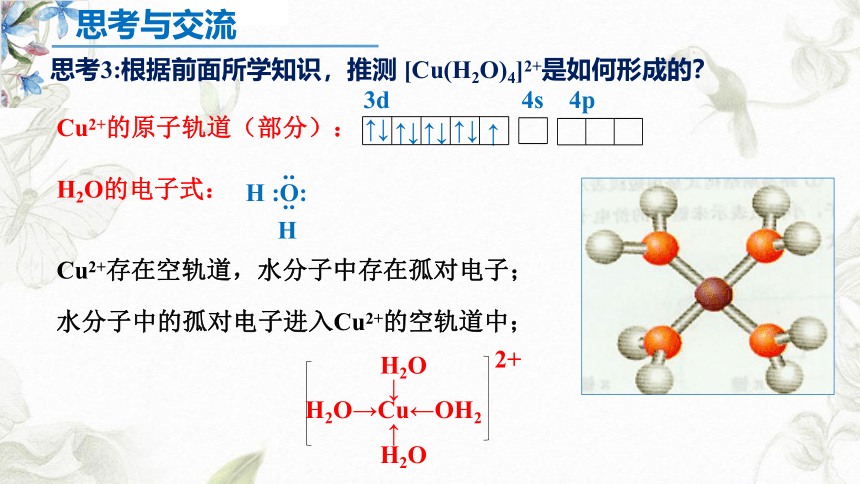
思考3:根据前面所学知识,推测 [Cu(H2O)4]2+是如何形成的?
Cu2+的原子轨道(部分):
H2O的电子式:
↑
↑↓
3d 4s 4p
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
↑↓
↑↓
↑↓
H :O:
..
..
H
Cu2+存在空轨道,水分子中存在孤对电子;
水分子中的孤对电子进入Cu2+的空轨道中;
H2O
↓
H2O→Cu←OH2
↑
H2O
2+
思考与交流
四、配合物理论简介
2.配合物
(1)配合物的定义:
通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物。
(2)配合物的组成:
一般中心原子(或离子)的配位数为2、4、6。
Cu(H2O)4
SO4
内界
外界
(配离子)
中心离子
配体
配位数
四、配合物理论简介
2.配合物
(2)配合物的组成:
Cu(H2O)4
SO4
内界
外界
(配离子)
中心离子
配体
配位数
中心原子:配合物的中心原子一般都是带正电的阳离子,过渡金属离子最常见。
配体:配体可以是阴离子,如X-(卤素离子)、OH-、SCN-、CN-等;也可以是中性分子,如H2O、NH3、CO等。
配位原子:是指配位体中直接同中心离子配合的原子,如NH3中的N原子,H2O分子中的O原子。
配位数:直接同中心离子(或原子)配位的原子的数目叫中心离子(或原子)的配位数,如[Cu(NH3)4]2+的配位数为4。
四、配合物理论简介
2.配合物
(3)配合物形成的条件:
①配体有孤电子对;
②中心原子有空轨道。
思考4:实验探究[2—2] (取实验[2-1]所得硫酸铜溶液1/3实验)根据现象分析溶液成分的变化并说明你的推断依据,写出相关的离子方程式
天蓝色溶液
蓝色沉淀
深蓝色溶液
Cu(OH)2
深蓝色晶体
[Cu(NH3) 4 ]SO4?H2O
+乙醇
静置
H2O
↓
H2O→Cu←OH2
↑
H2O
2+
NH3
↓
H3N→Cu←NH3
↑
NH3
2+
思考与交流
四、配合物理论简介
2.配合物
(4)配合物的应用:
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
[Cu(NH3)4]2+深蓝色
思考5:如何检验Fe3+?
实验操作
实验现象
有关离子方程式
溶液颜色变成 色
红
Fe3++3SCN-=[Fe(SCN)n]3-n
血红色溶液是由于存在[Fe(SCN)n]3-n,n 可以为1-6
Fe3++3SCN-===Fe(SCN)3
① [Cu(NH3) 4 ]SO4?H2O的制取
② Fe3+的检验
③ 银氨溶液的制备
AgNO3 + NH3.H2O == AgOH↓ + NH4NO3
AgOH + 2NH3.H2O == Ag(NH3)2OH + 2H2O
银氨溶液可用于检验醛基
四、配合物理论简介
2.配合物
(5)配合物的性质:
①配合物溶于水后难电离(因为配离子难电离),外界可以电离。
配位键广泛存在于分子或离子中,如NH4+、H3O+、Ag(NH3)2OH(银氨溶液)、Na3AlF6(六氟合铝酸钠、冰晶石)、K3[Fe(CN)6](铁氰化钾、赤血盐)、H2SO4等。
②配位键越强,配合物越稳定。
已知的配合物种类繁多,新的配合物由于纷繁复杂的有机物配体而层出不穷,使得无机化合物的品种迅速增长。叶绿素、血红素和维生素B12都是配合物,它们的配体大同小异,是一种称为卟啉的大环有机物,而中心离子分别是镁离子、亚铁离子和钴离子。图2—25是叶绿素的结构示意图:
实践活动:
用计算机软件Chemsketch制作分子立体模型。
科学视野
1、配位键
定义
配位键的形成条件
一方提供孤电子对
一方提供空轨道
“电子对给予—接受键”
2、配合物
配合物的组成
定义
配合物对性质的影响
配合物的命名
知识小结
1.下列各种说法中错误的是 ( )
A.形成配位键的条件是一方有空轨道,一方有孤电子对
B.配位键是一种特殊的共价键
C.配位化合物中的配体可以是分子也可以是阴离子
D.共价键的形成条件是成键原子必须有未成对电子
D
2.下列不能形成配位键的组合是( )
A.Ag+ NH3 B.H2O H+
C.Co3+ CO D.Ag+ H+
D
课堂练习
4.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加入氨水至沉淀消失
C.向FeCl3溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加入氨水至沉淀消失
A
课堂练习
3.下列微粒中含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.全部
C
5.向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是 ( )
A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2
解析:配合物的内界与外界由离子键结合,只要外界存在Cl-,加入AgNO3溶液即有AgCl沉淀产生。对于B项配合物分子的化学式为[Co(NH3)3Cl3],Co3+、NH3、Cl-全处于内界,不能电离,不存在Cl-,所以不能生成AgCl沉淀。
B
课堂练习
6.具有6个配体的Co3+的配合物CoClm·nNH3,若1 mol配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是( )
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=4,n=5
B
[Co(NH3)4Cl2]Cl
B
课堂练习
【答案】
8.气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键关系如图所示。请将图中你认为是配位键的斜线加上箭头。
课堂练习
课堂练习
配位键
N
3CaF2+Al3+ = 3Ca2+ +AlF63-
O
1s22s22p63s23p63d54s1
S?????????????
?
sp3
4
1:2
sp2
小于
课堂练习
课堂练习
1s22s22p63s23p63d5(或[Ar]3d5)
平面三角形
C≡O
sp3
2×6.02×1023(或2NA)
感谢聆听
2021-03-W
第二章
第二节 分子的立体构型
2021-03-W
学习目标
配合物理论简介
01
1.配位键、配位化合物的概念
2.配位键配位化合物的表示方法
重难点
重点:配位键、配位化合物的概念
难点:配位键、配位化合物的概念
思考1:教材实验2-1,将下表中的少量固体溶于足量的水,观察实验现象。
思考与交流
上述实验中呈天蓝色是因为溶液中含有水合铜离子:
固体
CuSO4
CuCl2·2H2O
CuBr2
NaCl
K2SO4
KBr
固体颜色
白色
绿色
深褐色
白色
白色
白色
溶液颜色
实验说明
天蓝色
天蓝色
无色
无色
无色
天蓝色
[Cu(H2O)4]2+
[Cu(H2O)4]2+
SO42 –
Na+
Cl-
K +
Br -
K +
无色离子:
什么离子呈天蓝色:
思考2:请写出H3O+和NH4+的电子式,并分析H2O与H+是怎样结合呈H3O+的,NH3和H+是怎么结合成NH4+的?
思考与交流
四、配合物理论简介
1.配位键
(1)配位键的定义:
“电子对给予—接受键”被称为配位键。一方提供孤对电子;一方有空轨道,接受孤对电子。
如: H3O+、NH4+、[Cu(H20)42+] 中存在配位键。
(2)成键粒子:
(3)成键性质:
(4)成键条件:
(5)配位键的表示方法:
原子
共用电子对对两原子的电性作用
一方是能够提供孤对电子,另一方能够提供空轨道。
A→B(表明共用电子对由A原子提供给B)
配位键除了电子由一方单方面提供,其它性质与别的共价键没有区别。
思考3:根据前面所学知识,推测 [Cu(H2O)4]2+是如何形成的?
Cu2+的原子轨道(部分):
H2O的电子式:
↑
↑↓
3d 4s 4p
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
↑↓
↑↓
↑↓
H :O:
..
..
H
Cu2+存在空轨道,水分子中存在孤对电子;
水分子中的孤对电子进入Cu2+的空轨道中;
H2O
↓
H2O→Cu←OH2
↑
H2O
2+
思考与交流
四、配合物理论简介
2.配合物
(1)配合物的定义:
通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物。
(2)配合物的组成:
一般中心原子(或离子)的配位数为2、4、6。
Cu(H2O)4
SO4
内界
外界
(配离子)
中心离子
配体
配位数
四、配合物理论简介
2.配合物
(2)配合物的组成:
Cu(H2O)4
SO4
内界
外界
(配离子)
中心离子
配体
配位数
中心原子:配合物的中心原子一般都是带正电的阳离子,过渡金属离子最常见。
配体:配体可以是阴离子,如X-(卤素离子)、OH-、SCN-、CN-等;也可以是中性分子,如H2O、NH3、CO等。
配位原子:是指配位体中直接同中心离子配合的原子,如NH3中的N原子,H2O分子中的O原子。
配位数:直接同中心离子(或原子)配位的原子的数目叫中心离子(或原子)的配位数,如[Cu(NH3)4]2+的配位数为4。
四、配合物理论简介
2.配合物
(3)配合物形成的条件:
①配体有孤电子对;
②中心原子有空轨道。
思考4:实验探究[2—2] (取实验[2-1]所得硫酸铜溶液1/3实验)根据现象分析溶液成分的变化并说明你的推断依据,写出相关的离子方程式
天蓝色溶液
蓝色沉淀
深蓝色溶液
Cu(OH)2
深蓝色晶体
[Cu(NH3) 4 ]SO4?H2O
+乙醇
静置
H2O
↓
H2O→Cu←OH2
↑
H2O
2+
NH3
↓
H3N→Cu←NH3
↑
NH3
2+
思考与交流
四、配合物理论简介
2.配合物
(4)配合物的应用:
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
[Cu(NH3)4]2+深蓝色
思考5:如何检验Fe3+?
实验操作
实验现象
有关离子方程式
溶液颜色变成 色
红
Fe3++3SCN-=[Fe(SCN)n]3-n
血红色溶液是由于存在[Fe(SCN)n]3-n,n 可以为1-6
Fe3++3SCN-===Fe(SCN)3
① [Cu(NH3) 4 ]SO4?H2O的制取
② Fe3+的检验
③ 银氨溶液的制备
AgNO3 + NH3.H2O == AgOH↓ + NH4NO3
AgOH + 2NH3.H2O == Ag(NH3)2OH + 2H2O
银氨溶液可用于检验醛基
四、配合物理论简介
2.配合物
(5)配合物的性质:
①配合物溶于水后难电离(因为配离子难电离),外界可以电离。
配位键广泛存在于分子或离子中,如NH4+、H3O+、Ag(NH3)2OH(银氨溶液)、Na3AlF6(六氟合铝酸钠、冰晶石)、K3[Fe(CN)6](铁氰化钾、赤血盐)、H2SO4等。
②配位键越强,配合物越稳定。
已知的配合物种类繁多,新的配合物由于纷繁复杂的有机物配体而层出不穷,使得无机化合物的品种迅速增长。叶绿素、血红素和维生素B12都是配合物,它们的配体大同小异,是一种称为卟啉的大环有机物,而中心离子分别是镁离子、亚铁离子和钴离子。图2—25是叶绿素的结构示意图:
实践活动:
用计算机软件Chemsketch制作分子立体模型。
科学视野
1、配位键
定义
配位键的形成条件
一方提供孤电子对
一方提供空轨道
“电子对给予—接受键”
2、配合物
配合物的组成
定义
配合物对性质的影响
配合物的命名
知识小结
1.下列各种说法中错误的是 ( )
A.形成配位键的条件是一方有空轨道,一方有孤电子对
B.配位键是一种特殊的共价键
C.配位化合物中的配体可以是分子也可以是阴离子
D.共价键的形成条件是成键原子必须有未成对电子
D
2.下列不能形成配位键的组合是( )
A.Ag+ NH3 B.H2O H+
C.Co3+ CO D.Ag+ H+
D
课堂练习
4.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加入氨水至沉淀消失
C.向FeCl3溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加入氨水至沉淀消失
A
课堂练习
3.下列微粒中含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.全部
C
5.向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是 ( )
A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2
解析:配合物的内界与外界由离子键结合,只要外界存在Cl-,加入AgNO3溶液即有AgCl沉淀产生。对于B项配合物分子的化学式为[Co(NH3)3Cl3],Co3+、NH3、Cl-全处于内界,不能电离,不存在Cl-,所以不能生成AgCl沉淀。
B
课堂练习
6.具有6个配体的Co3+的配合物CoClm·nNH3,若1 mol配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是( )
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=4,n=5
B
[Co(NH3)4Cl2]Cl
B
课堂练习
【答案】
8.气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键关系如图所示。请将图中你认为是配位键的斜线加上箭头。
课堂练习
课堂练习
配位键
N
3CaF2+Al3+ = 3Ca2+ +AlF63-
O
1s22s22p63s23p63d54s1
S?????????????
?
sp3
4
1:2
sp2
小于
课堂练习
课堂练习
1s22s22p63s23p63d5(或[Ar]3d5)
平面三角形
C≡O
sp3
2×6.02×1023(或2NA)
感谢聆听
2021-03-W
