2020-2021学年人教版高二化学选修3第二章2-3(1)键与分子极性 课件(24张ppt)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3第二章2-3(1)键与分子极性 课件(24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 22:02:16 | ||
图片预览







文档简介
分子结构与性质
第二章
第三节 分子的性质
2021-03-W
学习目标
键的极性和分子的极性
01
1.了解极性共价键和非极性共价键
2.结合常见物质分子立体结构,判断极性分子和非极性分子
重难点
重点:极性分子和非极性分子的判断
难点:极性分子和非极性分子的判断
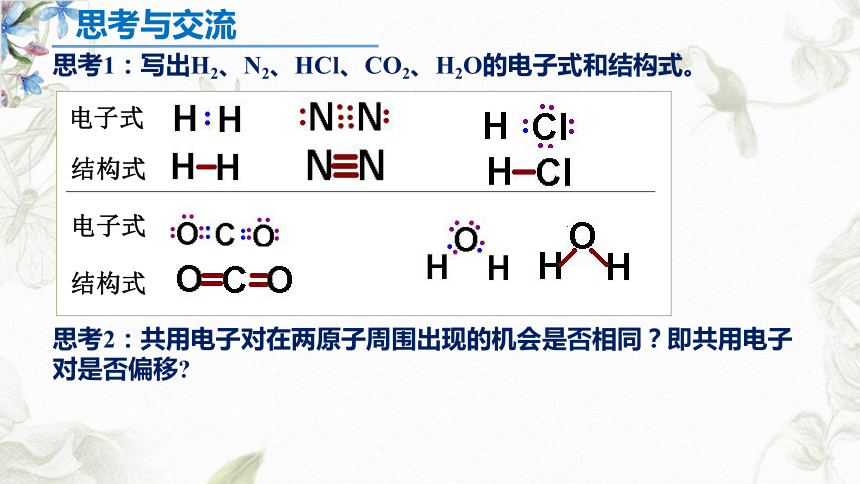
思考1:写出H2、N2、HCl、CO2、H2O的电子式和结构式。
思考2:共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?
电子式
结构式
电子式
结构式
思考与交流
一、键的极性和分子的极性
1.键的极性
极性共价键 非极性共价键
HCl
Cl2
电负性
电负性
一、键的极性和分子的极性
1.键的极性
H—I H—Br H—Cl H—F
弱极性
强极性
成键元素电负性值差异越大,共价键的极性越强。
NaF
H—H
练习1:指出下列物质中化学键的类型
HF NaOH N2 Na2O2 H2O2 CH3COOH NH4Cl
MgCl2
思考3:共价键有极性和非极性之分,那么由共价键形成的分子是否有极性和非极性呢?
那么,我们该怎样来判定分子是极性分子还是非极性分子呢?
思考与交流
一、键的极性和分子的极性
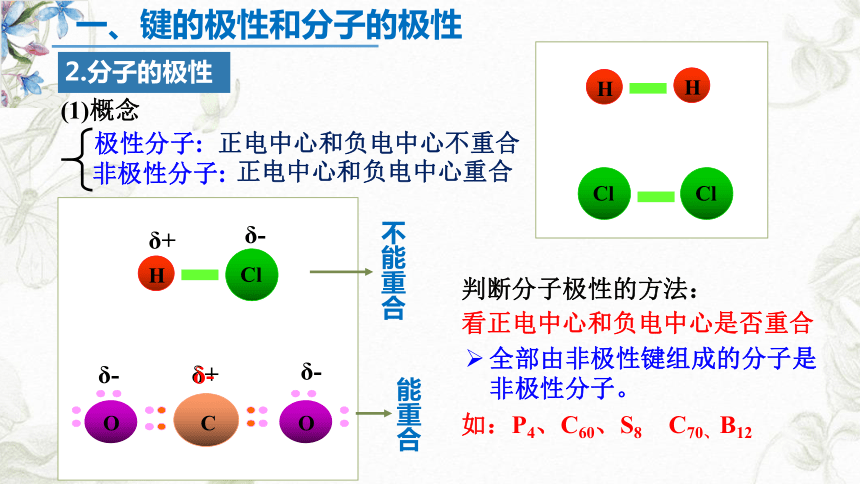
2.分子的极性
极性分子:
非极性分子:
(1)概念
正电中心和负电中心不重合
正电中心和负电中心重合
H
Cl
δ+
δ-
H
Cl
δ+
δ-
H
Cl
O
O
C
δ-
不能重合
能重合
δ-
看正电中心和负电中心是否重合
判断分子极性的方法:
全部由非极性键组成的分子是非极性分子。
如:P4、C60、S8 C70、B12
一、键的极性和分子的极性
2.分子的极性
(2)含极性键的分子是否有极性的判别方法
思考4:含有极性键的分子一定是极性分子吗?
对于ABn型分子极性判别方法
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)
C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子
180?
F1
F2
F合=0
O
O
C
CO2
H
O
H
105?
F1
F2
F合≠0
O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
H2O
H
H
H
N
BF3
120?
107?
三角锥型, 不对称,键的极性不能抵消,是极性分子
F1
F2
F3
F’
平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子
NH3
109?28'
正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子
C
H
H
H
H
F合
CH4
多原子分子(ABn),当中心原子的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。
练习2:完成教材45页的思考与交流。
知识小结
常见分子
键的极性
键角
分子构型
分子的极性
双原子分子
H2、Cl2
HCl
三原子分子
CO2
H2O
四原子分子
NH3
BF3
五原子
CH4
常见分子的构型及分子的极性
无 无 直线型 非极性
有 无 直线型 极性
有 105? 折线型 极性
有 180? 直线型 非极性
有 107 ° 三角锥型 极性
有 120? 平面三角形 非极性
有 109?28 ' 正四面体型 非极性
知识小结
{5940675A-B579-460E-94D1-54222C63F5DA}类型
实例
键角
键的极性
分子的极性
空间构型
X2
H2、N2
?
非极性键
非极性分子
直线形
XY
HCl、NO
?
极性键
极性分子
直线形
XY2
(X2Y)
CO2、CS2
180°
极性键
非极性分子
直线形
SO2
120°
极性键
极性分子
V形
H2O、H2S
104°30′
极性键
极性分子
V形
XY3
BF3
120°
极性键
非极性分子
平面三锥形
NH3
107°18′
极性键
极性分子
三角锥形
XY4
CH4、CCl4
109°30′
极性键
非极性分子
正四面体
空间构型、键的极性和分子极性的关系
一、键的极性和分子的极性
3.极性分子和非极性分子的判断
(1)直线形的对称分子为非极性分子,否则为极性分子。
(2)正三角形分子一定为非极性分子。
(3)正四面体分子一定为非极性分子。
分子的极性与空间构型的关系
判断ABn型分子极性的经验规律(学案28页)
(1)若中心原子A的化合价的绝对值等于该元素所在的主族序数(即最外层电子数),则为非极性分子;若不等,则为极性分子。
(2)若中心原子A无孤电子对,则为非极性分子;若有孤电子对,则为极性分子。(如BF3,CO2等为非极性分子; NH3 ,SO2等为极性分子)
思考5:根据前面所学知识分析下列事实:
(1)下表中N2、CO的熔沸点和溶解度大小。
(2)卤素单质在CCl4和水中的溶解度大小比较。
表2-3 CO和N2的某些性质
分子
熔点/℃
水中溶解度
(室温)
分子解离能
(kJ/mol)
分子的价电子总数
CO
-205.05
2.3 mL
10
N2
沸点/℃
-210.00
-190.49
-195.81
1.6 mL
1075
946
10
CO是极性分子,分子间的作用力强一些,熔沸点较大。
结论:分子的极性对物质的熔沸点和溶解性有影响。
思考与交流
分子的极性
分子的空间结构
键长键角
决定
键的极性
决定
小结:
课堂小结
科学视野—表面活性剂和细胞膜
(1)什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?
(2)什么是单分子膜?双分子膜?举例说明。
(3)为什么双分子膜以头向外而尾向内的方式排列?
思考6:
科学视野
科学视野—表面活性剂
亲水基团
疏水基团
在水的表面中形成单分子层,使水的表面张力降低。
油渍(zì)被包在胶束内
科学视野
1、带静电的有机玻璃棒靠近下列液体的细流,细流会发生偏转的是 ( )
A.苯 B.二硫化碳 C. 溴水 D.四氯化碳
2.现已知03分子为V字形结构,据理推断O3应为 (极性或非极性)分子,03在水中的溶解度比O2要 (大或小)得多,其主要原因是 .
结论:由同种元素组成的非金属单质分子不一定是非极性分子。
C
大
极性
极性分子
完全由非极性键结合而成的分子为非极性分子(O3除外)
课堂练习
3.下列有关分子的结构与性质的叙述中正确的是( )
A.CS2、H2O、C2H2都是直线型
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.CH2=CH2和CH≡CH分子含有的π键个数相等
D.CH4、CCl4、SiH4都是含有极性键的非极性分子
D
4.下列有关分子的叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D. 非极性分子中一定含有非极性共价键
A
课堂练习
H2O、Ne、CH4、NH3
CH4、CO2
NH3、H2O
CH4
正四面体形
配位键
N2
不相同
课堂练习
感谢聆听
2021-03-W
第二章
第三节 分子的性质
2021-03-W
学习目标
键的极性和分子的极性
01
1.了解极性共价键和非极性共价键
2.结合常见物质分子立体结构,判断极性分子和非极性分子
重难点
重点:极性分子和非极性分子的判断
难点:极性分子和非极性分子的判断
思考1:写出H2、N2、HCl、CO2、H2O的电子式和结构式。
思考2:共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?
电子式
结构式
电子式
结构式
思考与交流
一、键的极性和分子的极性
1.键的极性
极性共价键 非极性共价键
HCl
Cl2
电负性
电负性
一、键的极性和分子的极性
1.键的极性
H—I H—Br H—Cl H—F
弱极性
强极性
成键元素电负性值差异越大,共价键的极性越强。
NaF
H—H
练习1:指出下列物质中化学键的类型
HF NaOH N2 Na2O2 H2O2 CH3COOH NH4Cl
MgCl2
思考3:共价键有极性和非极性之分,那么由共价键形成的分子是否有极性和非极性呢?
那么,我们该怎样来判定分子是极性分子还是非极性分子呢?
思考与交流
一、键的极性和分子的极性
2.分子的极性
极性分子:
非极性分子:
(1)概念
正电中心和负电中心不重合
正电中心和负电中心重合
H
Cl
δ+
δ-
H
Cl
δ+
δ-
H
Cl
O
O
C
δ-
不能重合
能重合
δ-
看正电中心和负电中心是否重合
判断分子极性的方法:
全部由非极性键组成的分子是非极性分子。
如:P4、C60、S8 C70、B12
一、键的极性和分子的极性
2.分子的极性
(2)含极性键的分子是否有极性的判别方法
思考4:含有极性键的分子一定是极性分子吗?
对于ABn型分子极性判别方法
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)
C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子
180?
F1
F2
F合=0
O
O
C
CO2
H
O
H
105?
F1
F2
F合≠0
O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
H2O
H
H
H
N
BF3
120?
107?
三角锥型, 不对称,键的极性不能抵消,是极性分子
F1
F2
F3
F’
平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子
NH3
109?28'
正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子
C
H
H
H
H
F合
CH4
多原子分子(ABn),当中心原子的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。
练习2:完成教材45页的思考与交流。
知识小结
常见分子
键的极性
键角
分子构型
分子的极性
双原子分子
H2、Cl2
HCl
三原子分子
CO2
H2O
四原子分子
NH3
BF3
五原子
CH4
常见分子的构型及分子的极性
无 无 直线型 非极性
有 无 直线型 极性
有 105? 折线型 极性
有 180? 直线型 非极性
有 107 ° 三角锥型 极性
有 120? 平面三角形 非极性
有 109?28 ' 正四面体型 非极性
知识小结
{5940675A-B579-460E-94D1-54222C63F5DA}类型
实例
键角
键的极性
分子的极性
空间构型
X2
H2、N2
?
非极性键
非极性分子
直线形
XY
HCl、NO
?
极性键
极性分子
直线形
XY2
(X2Y)
CO2、CS2
180°
极性键
非极性分子
直线形
SO2
120°
极性键
极性分子
V形
H2O、H2S
104°30′
极性键
极性分子
V形
XY3
BF3
120°
极性键
非极性分子
平面三锥形
NH3
107°18′
极性键
极性分子
三角锥形
XY4
CH4、CCl4
109°30′
极性键
非极性分子
正四面体
空间构型、键的极性和分子极性的关系
一、键的极性和分子的极性
3.极性分子和非极性分子的判断
(1)直线形的对称分子为非极性分子,否则为极性分子。
(2)正三角形分子一定为非极性分子。
(3)正四面体分子一定为非极性分子。
分子的极性与空间构型的关系
判断ABn型分子极性的经验规律(学案28页)
(1)若中心原子A的化合价的绝对值等于该元素所在的主族序数(即最外层电子数),则为非极性分子;若不等,则为极性分子。
(2)若中心原子A无孤电子对,则为非极性分子;若有孤电子对,则为极性分子。(如BF3,CO2等为非极性分子; NH3 ,SO2等为极性分子)
思考5:根据前面所学知识分析下列事实:
(1)下表中N2、CO的熔沸点和溶解度大小。
(2)卤素单质在CCl4和水中的溶解度大小比较。
表2-3 CO和N2的某些性质
分子
熔点/℃
水中溶解度
(室温)
分子解离能
(kJ/mol)
分子的价电子总数
CO
-205.05
2.3 mL
10
N2
沸点/℃
-210.00
-190.49
-195.81
1.6 mL
1075
946
10
CO是极性分子,分子间的作用力强一些,熔沸点较大。
结论:分子的极性对物质的熔沸点和溶解性有影响。
思考与交流
分子的极性
分子的空间结构
键长键角
决定
键的极性
决定
小结:
课堂小结
科学视野—表面活性剂和细胞膜
(1)什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?
(2)什么是单分子膜?双分子膜?举例说明。
(3)为什么双分子膜以头向外而尾向内的方式排列?
思考6:
科学视野
科学视野—表面活性剂
亲水基团
疏水基团
在水的表面中形成单分子层,使水的表面张力降低。
油渍(zì)被包在胶束内
科学视野
1、带静电的有机玻璃棒靠近下列液体的细流,细流会发生偏转的是 ( )
A.苯 B.二硫化碳 C. 溴水 D.四氯化碳
2.现已知03分子为V字形结构,据理推断O3应为 (极性或非极性)分子,03在水中的溶解度比O2要 (大或小)得多,其主要原因是 .
结论:由同种元素组成的非金属单质分子不一定是非极性分子。
C
大
极性
极性分子
完全由非极性键结合而成的分子为非极性分子(O3除外)
课堂练习
3.下列有关分子的结构与性质的叙述中正确的是( )
A.CS2、H2O、C2H2都是直线型
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.CH2=CH2和CH≡CH分子含有的π键个数相等
D.CH4、CCl4、SiH4都是含有极性键的非极性分子
D
4.下列有关分子的叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D. 非极性分子中一定含有非极性共价键
A
课堂练习
H2O、Ne、CH4、NH3
CH4、CO2
NH3、H2O
CH4
正四面体形
配位键
N2
不相同
课堂练习
感谢聆听
2021-03-W
