高中必修1第四章复习——非金属及其化合物
文档属性
| 名称 | 高中必修1第四章复习——非金属及其化合物 |
|
|
| 格式 | rar | ||
| 文件大小 | 435.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-08 00:00:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第四章 非金属及其化合物
知识梳理
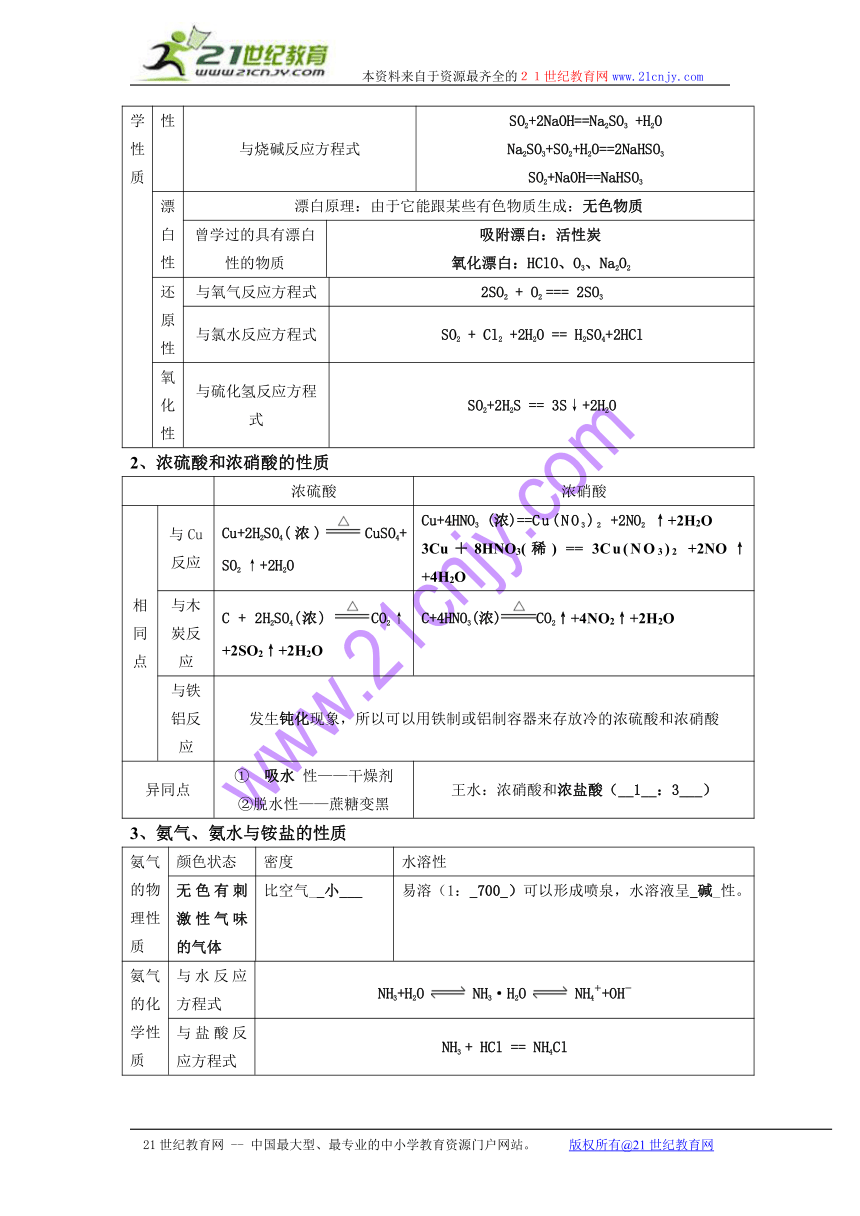
一、本章知识结构框架
二、本章知识结构梳理
(一) 硅及其化合物
1、二氧化硅和二氧化碳比较
二氧化硅 二氧化碳
类别 酸性氧化物 _酸性氧化物
晶体结构 原子晶体 分子晶体
熔沸点 高 低
与水反应方程式 不反应 CO2+H2O H2CO3
与酸反应方程式 SiO2 + 4HF==SiF4↑+2H2O 不反应
与烧碱反应方程式 SiO2+2NaOH == Na2SiO3+H2O 少:2NaOH+CO2==Na2CO3+H2O 过:NaOH+CO2==NaHCO3
与CaO反应方程式 SiO2+CaOCaSiO3 CaO+CO2==CaCO3
存在状态 水晶、玛瑙、石英、硅石、沙子 人和动物排放
2、硅以及硅的化合物的用途
物质 用途
硅单质 半导体材料、光电池(计算器、人造卫星、登月车、探测器)
SiO2 饰物、仪器、光导纤维、玻璃
硅酸钠 矿物胶
SiC 砂纸、砂轮的磨料
(二) 氯
1、液氯、新制的氯水和久置的氯水比较
液氯 新制氯水 久置氯水
分类 纯净物 混合物 混合物
颜色 黄绿色 黄绿色 无色
成分 Cl2 Cl2、H2O、HClO、H+、Cl―、ClO―、极少量的为OH― H+、Cl―、H2O、极少量的OH―稀盐酸
性质 氧化性 氧化性、酸性、漂白性 酸性
2、氯气的性质
与金属钠反应方程式 2Na+Cl2 2NaCl
与金属铁反应方程式 2Fe+3Cl2 2FeCl3
与金属铜反应方程式 Cu+Cl2 CuCl2
与氢气反应方程式 H2+Cl2 2HCl;H2+Cl2 2HCl
与水反应方程式 H2O +Cl2 ==HCl+HClO
制漂白液反应方程式 Cl2+2NaOH==NaCl+NaClO+H2O
制漂白粉反应方程式 2Cl2 +2Ca(OH)2==CaCl2 +Ca(ClO)2 +2H2O
实验室制法 MnO2+4HCl(浓)MnCl2 +Cl2 ↑+2H2O
氯离子的检验试剂以及反应方程式 AgNO3溶液Ag++Cl―==AgCl
(三) 硫、氮
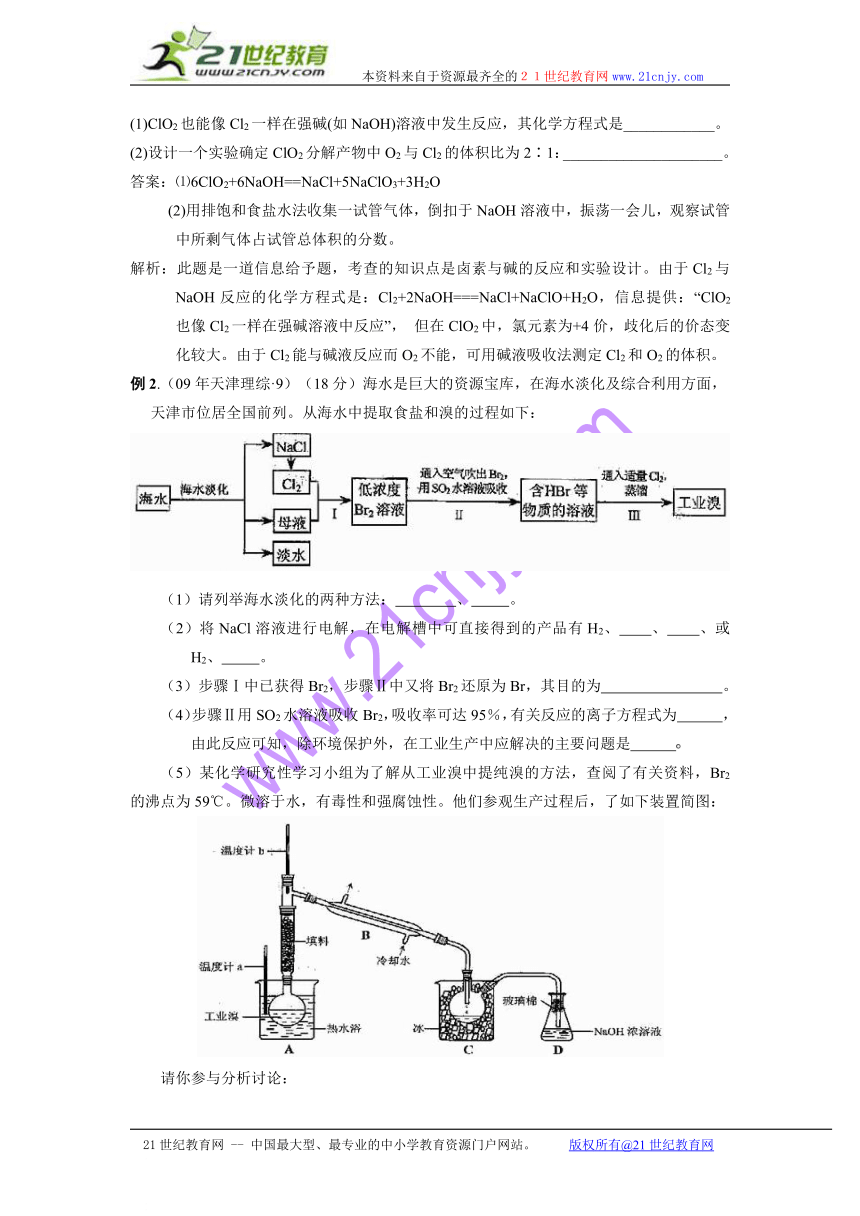
1、二氧化硫的性质
物理性质 颜色状态 密度 毒性
黄绿色 比空气___大___ 有毒
化学性质 酸性 与水反应方程式 SO2+H2O H2SO3
与烧碱反应方程式 SO2+2NaOH==Na2SO3 +H2O Na2SO3+SO2+H2O==2NaHSO3 SO2+NaOH==NaHSO3
漂白性 漂白原理:由于它能跟某些有色物质生成:无色物质
曾学过的具有漂白性的物质 吸附漂白:活性炭氧化漂白:HClO、O3、Na2O2
还原性 与氧气反应方程式 2SO2 + O2 === 2SO3
与氯水反应方程式 SO2 + Cl2 +2H2O == H2SO4+2HCl
氧化性 与硫化氢反应方程式 SO2+2H2S == 3S↓+2H2O
2、浓硫酸和浓硝酸的性质
浓硫酸 浓硝酸
相同点 与Cu反应 Cu+2H2SO4(浓)CuSO4+ SO2 ↑+2H2O Cu+4HNO3 (浓)==Cu(NO3)2 +2NO2 ↑+2H2O 3Cu+8HNO3(稀) == 3Cu(NO3)2 +2NO↑+4H2O
与木炭反应 C + 2H2SO4(浓) CO2↑+2SO2↑+2H2O C+4HNO3(浓)CO2↑+4NO2↑+2H2O
与铁铝反应 发生钝化现象,所以可以用铁制或铝制容器来存放冷的浓硫酸和浓硝酸
异同点 ① 吸水 性——干燥剂②脱水性——蔗糖变黑 王水:浓硝酸和浓盐酸(__1__:3___)
3、氨气、氨水与铵盐的性质
氨气的物理性质 颜色状态 密度 水溶性
无色有刺激性气味的气体 比空气__小___ 易溶(1:_700_)可以形成喷泉,水溶液呈_碱_性。
氨气的化学性质 与水反应方程式 NH3+H2O NH3·H2O NH4++OH―
与盐酸反应方程式 NH3 + HCl == NH4Cl
实验室制法 Ca(OH)2+2NH4ClCaCl2 +2NH3 ↑+2H2O
氨水成分 NNH3 、NH3·H2O 、H2O 、NH4+、OH―、极少量的H+
铵盐 物理性质:铵盐都是_无色_色晶体,____能_____溶于水
化学性质 氯化铵分解反应方程式 NH4ClNH3 + HCl
碳酸氢铵分解反应方程式 NH4HCO3 NH3 ↑+ H2O +CO2 ↑
知识点精析
知识点一:氯及化合物
【例1】:(1)现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后,溶液颜色变浅,产生上述现象的原因是 (请用相关的反应方程式和简要文字说明)。
(2)在氯水中存在多种分子和离子,也可以通过实验的方法加以确定。下列说法错误的是()
A.加入含有NaOH的酚酞试液,红色褪去,说明有H+离子存在
B.加入有色布条后,有色布条褪色,说明有HClO分子存在
C.氯水呈浅黄绿色,且有刺激性气味,说明有C12分子存在
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl—离子存在
解析与评价:根据氯水中存在的7种微粒、溶解平衡和化学平衡的角度去分析。要注意到Cl2无漂白性,氯水有漂白性的原因是氯水中存在HClO分子。 (1)氯气溶于水时发生反应Cl2+H2OHCl+HClO,光照时2HClO2HCl+O2↑,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗Cl2,使溶液颜色变浅。(2)在氯水中加入NaOH溶液,红色褪去的原因是由于HClO的强氧化性而漂白,可以用下列实验加以验证,在褪色后的溶液中再加入NaOH溶液,发现溶液仍为无色。
答案:(1)氯气溶于水时发生反应Cl2+H2O ( http: / / www. / )HCl+HClO,光照时2HClO2HCl+O2↑,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗Cl2,使溶液颜色变浅
(2)、A
【变式训练1】浓H2SO4和KClO3反应生成具有爆炸性的黄绿色气体ClO2,反应的方程式如下:
KClO3+H2SO4==KHSO4+HClO3,
3HClO3==HClO4+H2O+2ClO2,2ClO2==Cl2+2O2
(1)ClO2也能像Cl2一样在强碱(如NaOH)溶液中发生反应,其化学方程式是____________。
(2)设计一个实验确定ClO2分解产物中O2与Cl2的体积比为2∶1:_____________________。
答案:⑴6ClO2+6NaOH==NaCl+5NaClO3+3H2O
(2)用排饱和食盐水法收集一试管气体,倒扣于NaOH溶液中,振荡一会儿,观察试管中所剩气体占试管总体积的分数。
解析:此题是一道信息给予题,考查的知识点是卤素与碱的反应和实验设计。由于Cl2与NaOH反应的化学方程式是:Cl2+2NaOH===NaCl+NaClO+H2O,信息提供:“ClO2也像Cl2一样在强碱溶液中反应”, 但在ClO2中,氯元素为+4价,歧化后的价态变化较大。由于Cl2能与碱液反应而O2不能,可用碱液吸收法测定Cl2和O2的体积。
例2.(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H+++2 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色 分液(或蒸馏)
知识点二:氯的化合物(HCl、HClO)
例3.(08年上海化学·13)已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
【变式训练2】氯胺(NH2Cl)在中性或酸性条件下是一种有效的强力消毒剂,据此判断,氯胺在水溶液中因水解产生的物质是 ( )
A.HClO和HCl B.NH4C1和HCl C.NH4Cl和HClO D.NH4Cl和HClO3
知识点三:硫及化合物
例4:不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号 甲 乙 丙
① CO2 SO2 石灰水
② HCl CO2 石灰水
③ CO2 SO2 Ba(NO3)2
④ NO2 SO2 BaCl2
⑤ CO2 NH3 CaCl2
A.②③④ B.②③④⑤
C.①②④ D.①②③④
解析与评价:SO2是酸性氧化性,能和碱反应生成盐和水,SO2有较强的还原性,遇氧化性试剂易被氧化生成。本题若忽略了在酸性条件下离子的氧化性会漏选③,若未注意题干中“一定”两字会多选⑤。对于①,由于石灰水过量,因此必有CaCO3和CaSO3沉淀,对于②,同样由于石灰水过量,因此必有CaCO3沉淀生成,对于③,CO2气体与Ba(NO3)2不反应,SO2气体通入Ba(NO3)2溶液后,由于溶液酸性增强,SO2将被离子氧化生成,因此有BaSO4沉淀生成,对于④,NO2和SO2混合后,SO2将被NO2氧化成SO3,通入BaCl2溶液后有BaSO4沉淀生成,对于⑤,当NH3过量时溶液中有CaCO3沉淀生成,发生反应的化学方程式为:2NH3+CO2+CaCl2+H2O=CaCO3↓+2NH4Cl,当NH3不足时,最终无沉淀生成,发生反应的化学方程式为:2NH3+2CO2+CaCl2+2H2O=Ca(HCO3)2+2NH4Cl
答案:D
【变式训练3】在①H2S ②SO2 ③CO ④Cl2 ⑤HI ⑥CO2六种气体中,属于酸酐的是_______;能使品红溶液褪色的是_______;通入石蕊试液先变红后褪色的是_______,只变红不褪色的是_______;能使碘化钾淀粉试纸变蓝的是_______;能与溴水反应的是_______。(填序号)
答案:②⑥ ②④ ④ ①②⑤⑥ ④ ①②⑤
解析:SO2、CO2分别是H2SO3和H2CO3的酸酐。SO2能使品红溶液褪色,而Cl2与水反应产生的HClO既能使品红褪色,又能使石蕊试液先变红色后褪色,能使石蕊试液变红的气体还有H2S、SO2、HI、CO2等酸性气体 与KI作用产生I2的气体是氯气,具有氧化性。能与溴水反应的气体是H2S、SO2、HI等
例5.(09年北京理综·28)(15分)
以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)将燃烧黄铁矿的化学方程式补充完整
4 +11O2 ( http: / / www. / ) 2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是
。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2 和铵盐。
① SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为l5.00 g,浓硫酸增加的质量为 。(计算结果保留两位小数)
解析与答案:(15分)(1)FeS2 (2)2SO2+O22SO3
(3)abd(4)SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ·mol-1
(5)①SO2+Br2+2H2O=4H++2Br-+SO42- ②14.56 2.31g
变式训练4、(09年全国理综卷I·27)(15分)浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+CCO2↑+2H2O+2SO2↑
请从下图中选用所需仪器(可重复使用)组成一套进行该感应并检验出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他、固液试剂自选(连接和固体仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用仪器(填字母) 加入试剂 作用
答案:
CBAAA 浓硫硫和木炭无水硫酸铜品红酸性KMnO4澄清石灰水 产生反应物检验是否有水检验SO2 除去SO2 检验CO2的存在
知识点四:氮及其化合物
例6. 试回答制取氨气并完成喷泉实验(图中夹持装置均已略去)
图1 图2
⑴收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
⑵用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
⑶如果只提供如图2的装置,请说明引发喷泉的方法 。
解析与评价:本题以氨气的物理性质中极易溶于水为考察背景是常考容易题。(1)由于氨气极易溶于水,收集时通常采用向下排气方法,干燥氨气宜选用碱石灰;(2)喷泉实验主要原理是容器的内外产生压强差,1中是通过氨气溶于水使烧瓶内压强减小而出现喷泉;(3)中要想产生喷泉,可以将烧瓶内的氨气压入烧杯中,先增大烧瓶内压强使氨气与水接触,进而使烧瓶内压强减少而出现喷泉。
答案:(1)向下排气方,碱石灰;
(2)将胶头滴管内的水挤入烧瓶内;
(3)用热毛巾覆于烧瓶顶部。
【变式训练5】下列气体与对应的液体不能进行喷泉实验的是 ( )
A.NH3和水 B.HCl和水 C.Cl2和水 D.CO2和NaOH溶液
【变式训练6】有关氨的说法不正确的是 ( )
A. NH3是4核10电子极性分子,三角锥型,具有还原性
B. NH3极易溶于水,可做喷泉实验,氨气易液化,液氨可用作制冷剂
C. 氨气是非电解质,氨水是电解质
D. 蘸有浓盐酸玻璃棒遇氨气可产生白烟
例7.(09年全国理综Ⅱ·28)(15分)
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是 ,
发生反应的化学方程式是 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(4)实验时在D中观察到得现象是 ,D中收集到的物质是 ,检验该物质的方法和现象是 。
解析与评价:本题以氨气的制备,氨气的性质为考察要点,属于中档题。(1)、制备氨气的药品NH4Cl和Ca(OH)2,(2)干燥氨气用碱石灰(或CaO),(3)主要描述固体粉末的颜色变化,方程式见答案。(4)、描述D中的现象重点强调出现无色液体,氨气检验方法。
答 案:(1)固体NH4Cl和Ca(OH)2 2NH4Cl+Ca(OH)2 ( http: / / www. / )CaCl2+2NH3↑+2H2O
(2)碱石灰(或CaO) 除去NH3气流中的水汽
(3)黑色粉末部分逐渐变为红色 2NH3+3CuON2+3H2O+3Cu
(4)出现无色液体 氨水 用无水硫酸铜检验、无水硫酸铜变蓝
例9.(1)标况下,盛有NO2和N2以1:1混合气体的试管倒扣在水中,充分反应后余气体积占原体积的多少。
(2)将10mLNO和NO2混合气体缓慢通入倒立于水槽中的盛满水的试管中,充分反应后,有5mL剩余气体,求原混合气体NO和NO2的体积比。
解析与评价:(1)、假设试管体积为V,VNO2=0.5V,VN2=0.5V,由于3NO2+H2O=2HNO3+NO,剩余气体总体积为:V剩余=0.5V+1/6V=2/3V。
(2)、剩余气体应为NO,设10ml气体中NO体积为V1, NO2体积为V2,则有V1+V2=10,V1+1/3V2=5,求解得V1=2.5,V2=7.5,V1:V2=1:3.
答 案:(1)2/3V,(2)、V1:V2=1:3.
【变式训练9】(1)一定条件下,16mlNO和O2混合充满试管倒扣水中余气为2ml求NO占原气体的多少
(2)将12mlNO2和O2的混合气体通入足量的水中,充分反应后余气2ml(气体均在相同状态下测定)求原各气体的体积
答案:(1)分为两种情况讨论:当2ml为NO时,NO占原气体的5/8, 当2ml为O2时,NO占原气体的1/2.
(2)分为两种情况讨论:当2ml为NO时,VNO2=10.8 VO2=1.2
当2ml为O2时, VNO2=8 VO2=4
③氮的氧化物对空气的污染与防治
同步训练
1.下图是年世界环境日主题宣传画《啊!地球出汗了》,这幅宣传画所揭示的全球主要环境问题是
A.酸雨 B.臭氧层空洞 C.温室效应 D.光化学烟雾
2.为了探索月球上是否存在生命的痕迹,首先要分析月球岩中是否包藏有碳氢化合物。科学家用氘盐酸即DCl的D2O溶液处理岩石样品,收集放出的气体加以分析,结果只发现有一些气态碳氘化合物。试推断该碳氘化合物是
A.岩石中的碳酸盐与氘盐酸反应的产物
B.岩石中的碳酸氢盐与氘盐酸反应的产物
C.岩石中的碳化物与氘盐酸反应的产物 高考资源网
D.岩石中的碳氢化合物与氘盐酸反应的产物
3.下面对氯气的叙述正确的是
A.氯气可使湿的红布条褪色,所以氯气具有漂白性
B.氯气没有漂白性,但通入品红溶液中,品红褪色
C.过量的铁在氯气中燃烧可生成氯化亚铁
D.闻其气味时要小心,将集气瓶放在鼻孔下直接闻
4.烧瓶中放入铜片和稀硝酸,用酒精灯加热来制取较纯净的一氧化氮,反应开始后发现烧瓶中充满棕红色气体,这时的操作应是
A.立即接上收集容器,用向上排空气法收集
B.待烧瓶中红棕色消失后,用向上排空气法收集
C.立即用排水法收集
D.待烧瓶中红棕色气体消失后,用排水法收集
5.下列说法中不正确的是
A.普通玻璃呈淡绿色是由于含Fe2+
B.坩埚、蒸发皿都属于陶瓷制品
C.唐“三彩”是一种玻璃制品
D.高温下硅酸钙比碳酸钙稳定
6.含FeS2A%的黄铁矿W吨,在用接触法硫酸的过程中,损失硫C%,可制得浓度为B%的硫酸为
A.吨 B.吨
C.吨 D.吨
7.下列对溴化钠的描述中,正确的是
A.是一种可溶于水的晶体,熔点较高
B.跟AgNO3溶液反应将生成白色沉淀
C.跟浓硫酸反应是制取溴化氢气体的常用方法
D.其工业制法之一是将金属钠跟单质溴反应
8.下列各组物质中,每一种物质都能使溴水褪色的是
A.AgNO3溶液、CCl4、碘水
B.Na2SO3溶液、FeCl3溶液、H2S溶液
C.FeCl2溶液、KOH溶液、镁粉
D.NaOH溶液、CO气体、氯水
9.O2-由于离子半径较小,且带2个负电荷,在水中会强烈地吸引并结合水中的H+而生成OH-,下列反应中不包含此步变化的是
A.Na2O+H2O=2NaOH
B.2Na2O2+2H2O=4NaOH+O2↑
C.12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
D.Ag2O+4NH3·H2O=2[Ag(NH3)2]++2OH-+3H2O
10.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A.NaCl Na2SO4 B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
11.次氯酸盐最大的用途是漂白和消毒。这类漂白剂氧化能力是以“有效氯”的含量来标志。“有效氯”的含量定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。请问纯LiClO的“有效氯”为
A.121% B.100% C.89% D.21%
12.用浓硫酸吸收SO3可以得到H2SO4 SO3。用mg98%的H2SO4充分吸收SO3后再进行稀释,可得到98%的硫酸的质量为
A.2.42mg B.2.22mg C.2.02mg D.1.98mg
13.下列离子方程式不正确的是
A.银氨溶液中加入足量盐酸产生沉淀:
[Ag(NH3)2]+++3H++=AgCl↓+2+H2O
B.在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解:
3BaSO3+2H++2=3BaSO4↓+2NO↑+H2O
C.碳酸钠溶液中通入少量SO2:
2+SO2+H2O=2+
D.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
14.NH3和O2混合气体100mL通过红热的铂丝,充分反应后的混合气体再通过足量水最终收集到10mL残留气体,则原混合气体中O2体积不可能是(气体体积在相同条件下测定)
A.12.5mL B.21.5mL C.64.2mL D.70.0mL
15.(1)少量的Mn2+可以催化分解H2O2,其反应的机理可简单解释为:
试写出上述2步反应的离子方程式_________________
(2)对于CO中毒、心肌梗塞、冠心病或小儿肺炎等危重患者都要采用吸氧治疗。普通医务室中没有氧气瓶,但一般都有消毒用的30%的H2O2溶液。同时还有可选用的试剂为:KMnO4、HCl、H2SO4、MnO2、Mg、CuSO4、NaCl、葡萄糖。请写出一种使H2O2中氧完全释放出来的理想反应方程式______________________________。
16.氰(CN)2 的结构式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2 和水反应可生成HCN和HCNO;(CN)2 的氧化性比Br2弱,比I2强。
(1)下列有关反应的化学方程式不正确的是
(填选项标号)
A.(CN)2 和NaOH溶液反应:(CN)2 +2NaOH==NaCN+NaCNO+H2O
B.MnO2和HCN反应:MnO2+4HCNMn(CN)2+(CN)2 ↑+2H2O
C.向KCN溶液中加入碘水:I2+2KCN==2KI+(CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2NaBr==2NaCl+Br2
(2)HCN的电子式为 ,按电子云重叠方式分类分子内化学键类型为_________________,碳原子的杂化类型为____________。
(3)处理含 (其中C为+2价)的工业废水常用氧化,生成的(其中C 为+4价)元素,反应的离子方程式如下:
a+b+c=dCNO-+eN2↑+f+b+cH2O
上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1, 则b= 。
17.试依据下列事实,作出有关的结论。
(1)硅的非金属性特征大于金属特征,而锗的金属特征大于非金属特征,_____。(2)金刚石是电的绝缘体,石墨可以导电,而C60可作为制超导体材料,____________。
(3)在常温下硅的化学性质不活泼,但自然界中却没有单质硅存在,__。
(4)硅酸钠溶液中通入CO2气体时,可生成难溶于水的酸—硅酸,_ ___。
(3)碳单质的三种同素异形体:骨架型的金刚石、层型的石墨及球形的球碳分子,试确定那一种物质易在火山喷发口附近发现,_________________________________。
18.已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去
(1)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 。根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物形式均可)。试描述气体C的物理性质_____________。
(2)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。通过上述描述可知:A的化学式为 ,E的化学式为 。当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目)和一种无色无味的液体H,写出F分解生成的G+H的化学方程式 。
19.某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:
在实验或改进实验中,可能发生的化学反应如下:
PbO+CPb+CO↑,2 PbO+C2Pb+CO2↑,
Ca(OH)2+CO2=CaCO3↓+H2O
[Cu(NH3)2]Ac+CO+2NH3 [Cu(NH3)4]Ac·CO △H<0。请回答以下问题:
(1)在装置A中不断鼓入氮气的作用是 ,能否用空气代替氮气? ,其理由是 。
(2)在实验过程中,未见B装置中有白色沉淀生成,说明在装置A中发生反应的化学方程式是 ,证明氧化铅里含有氧元素的实验事实是 。
(3)若使实验更具有说服力,通过增添设备和药品,设计一个更加严密的改进实验方案是 。
(4)若没有木炭粉和氮气,改用氢气行吗? ,实验的装置和药品又将做怎样的调整?____________。
20.将23.9 g表面已锈蚀成铜绿〔Cu2(OH)2CO3〕的铜片投入120 mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO,反应后溶液中H+为0.160 mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4 g蓝色固体。求:(1)铜片中单质铜的质量分数;(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)
参考答案
1.C 2.C 3.C 4.D 5.C 6.A 7.A 8.C
9.B 10.AB 11.A 12.B 13.D 14.B
15.(1)H2O2 + Mn2+ = MnO2 + 2H+ H2O2 +MnO2 + 2H+ = H2O + Mn2+ +O2↑
(2)5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑
16.(1)CD (2) sp 2个σ键和2个π键 (3)①B ②6
17.(1)表明同主族元素性质是递变的。(2)表明C60与石墨具有某种类似的结构。(3)说明在自然条件下,硅不如其化合物稳定。(4)表明硅酸的酸性比碳酸弱。(5)三种物质中金刚石在火山口易被发现,因为该处温度高、压力大,有利于破坏石墨中的化学键,有条件形成金刚石。
18.(1)SO3 A和B H 2S2O7或H2SO4·SO3或2SO3·H2O SO2是无色有刺激性气味的气体,密度比空气大,易溶于水,有毒 (2)NH3 HNO3 NH4NO3N2O↑+2H2O。
19.(1)N2可将实验装置内的空气排净,并作为动力源将PbO与C反应生成的气体,赶入B、C两个实验装置处。不可用空气体代替N2,空气中的O2可与灼热的炭反应,且空气中还含有CO2、H2O等含氧化合物,均可导致实验失败。 (2) PbO+CPb+CO↑,在装置C处可见一氧化碳燃烧产生的淡蓝色火焰。(3)可在装置B后串联一个内盛[Cu(NH3)2]Ac溶液的洗气装置,吸收一氧化碳,反应完毕,取出吸收液加热解吸,用排水取气法收集放出的气体,通过进一步实验证明该气体是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2Pb+H2O,用无水CuSO4吸收生成的水,证明氧化铅中含有氧元素。装置B应改用内盛CuSO4白色粉末的干燥管。
20.(1)53.6% (2)6.33 mol·L-1
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第四章 非金属及其化合物
知识梳理
一、本章知识结构框架
二、本章知识结构梳理
(一) 硅及其化合物
1、二氧化硅和二氧化碳比较
二氧化硅 二氧化碳
类别 酸性氧化物 _酸性氧化物
晶体结构 原子晶体 分子晶体
熔沸点 高 低
与水反应方程式 不反应 CO2+H2O H2CO3
与酸反应方程式 SiO2 + 4HF==SiF4↑+2H2O 不反应
与烧碱反应方程式 SiO2+2NaOH == Na2SiO3+H2O 少:2NaOH+CO2==Na2CO3+H2O 过:NaOH+CO2==NaHCO3
与CaO反应方程式 SiO2+CaOCaSiO3 CaO+CO2==CaCO3
存在状态 水晶、玛瑙、石英、硅石、沙子 人和动物排放
2、硅以及硅的化合物的用途
物质 用途
硅单质 半导体材料、光电池(计算器、人造卫星、登月车、探测器)
SiO2 饰物、仪器、光导纤维、玻璃
硅酸钠 矿物胶
SiC 砂纸、砂轮的磨料
(二) 氯
1、液氯、新制的氯水和久置的氯水比较
液氯 新制氯水 久置氯水
分类 纯净物 混合物 混合物
颜色 黄绿色 黄绿色 无色
成分 Cl2 Cl2、H2O、HClO、H+、Cl―、ClO―、极少量的为OH― H+、Cl―、H2O、极少量的OH―稀盐酸
性质 氧化性 氧化性、酸性、漂白性 酸性
2、氯气的性质
与金属钠反应方程式 2Na+Cl2 2NaCl
与金属铁反应方程式 2Fe+3Cl2 2FeCl3
与金属铜反应方程式 Cu+Cl2 CuCl2
与氢气反应方程式 H2+Cl2 2HCl;H2+Cl2 2HCl
与水反应方程式 H2O +Cl2 ==HCl+HClO
制漂白液反应方程式 Cl2+2NaOH==NaCl+NaClO+H2O
制漂白粉反应方程式 2Cl2 +2Ca(OH)2==CaCl2 +Ca(ClO)2 +2H2O
实验室制法 MnO2+4HCl(浓)MnCl2 +Cl2 ↑+2H2O
氯离子的检验试剂以及反应方程式 AgNO3溶液Ag++Cl―==AgCl
(三) 硫、氮
1、二氧化硫的性质
物理性质 颜色状态 密度 毒性
黄绿色 比空气___大___ 有毒
化学性质 酸性 与水反应方程式 SO2+H2O H2SO3
与烧碱反应方程式 SO2+2NaOH==Na2SO3 +H2O Na2SO3+SO2+H2O==2NaHSO3 SO2+NaOH==NaHSO3
漂白性 漂白原理:由于它能跟某些有色物质生成:无色物质
曾学过的具有漂白性的物质 吸附漂白:活性炭氧化漂白:HClO、O3、Na2O2
还原性 与氧气反应方程式 2SO2 + O2 === 2SO3
与氯水反应方程式 SO2 + Cl2 +2H2O == H2SO4+2HCl
氧化性 与硫化氢反应方程式 SO2+2H2S == 3S↓+2H2O
2、浓硫酸和浓硝酸的性质
浓硫酸 浓硝酸
相同点 与Cu反应 Cu+2H2SO4(浓)CuSO4+ SO2 ↑+2H2O Cu+4HNO3 (浓)==Cu(NO3)2 +2NO2 ↑+2H2O 3Cu+8HNO3(稀) == 3Cu(NO3)2 +2NO↑+4H2O
与木炭反应 C + 2H2SO4(浓) CO2↑+2SO2↑+2H2O C+4HNO3(浓)CO2↑+4NO2↑+2H2O
与铁铝反应 发生钝化现象,所以可以用铁制或铝制容器来存放冷的浓硫酸和浓硝酸
异同点 ① 吸水 性——干燥剂②脱水性——蔗糖变黑 王水:浓硝酸和浓盐酸(__1__:3___)
3、氨气、氨水与铵盐的性质
氨气的物理性质 颜色状态 密度 水溶性
无色有刺激性气味的气体 比空气__小___ 易溶(1:_700_)可以形成喷泉,水溶液呈_碱_性。
氨气的化学性质 与水反应方程式 NH3+H2O NH3·H2O NH4++OH―
与盐酸反应方程式 NH3 + HCl == NH4Cl
实验室制法 Ca(OH)2+2NH4ClCaCl2 +2NH3 ↑+2H2O
氨水成分 NNH3 、NH3·H2O 、H2O 、NH4+、OH―、极少量的H+
铵盐 物理性质:铵盐都是_无色_色晶体,____能_____溶于水
化学性质 氯化铵分解反应方程式 NH4ClNH3 + HCl
碳酸氢铵分解反应方程式 NH4HCO3 NH3 ↑+ H2O +CO2 ↑
知识点精析
知识点一:氯及化合物
【例1】:(1)现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后,溶液颜色变浅,产生上述现象的原因是 (请用相关的反应方程式和简要文字说明)。
(2)在氯水中存在多种分子和离子,也可以通过实验的方法加以确定。下列说法错误的是()
A.加入含有NaOH的酚酞试液,红色褪去,说明有H+离子存在
B.加入有色布条后,有色布条褪色,说明有HClO分子存在
C.氯水呈浅黄绿色,且有刺激性气味,说明有C12分子存在
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl—离子存在
解析与评价:根据氯水中存在的7种微粒、溶解平衡和化学平衡的角度去分析。要注意到Cl2无漂白性,氯水有漂白性的原因是氯水中存在HClO分子。 (1)氯气溶于水时发生反应Cl2+H2OHCl+HClO,光照时2HClO2HCl+O2↑,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗Cl2,使溶液颜色变浅。(2)在氯水中加入NaOH溶液,红色褪去的原因是由于HClO的强氧化性而漂白,可以用下列实验加以验证,在褪色后的溶液中再加入NaOH溶液,发现溶液仍为无色。
答案:(1)氯气溶于水时发生反应Cl2+H2O ( http: / / www. / )HCl+HClO,光照时2HClO2HCl+O2↑,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗Cl2,使溶液颜色变浅
(2)、A
【变式训练1】浓H2SO4和KClO3反应生成具有爆炸性的黄绿色气体ClO2,反应的方程式如下:
KClO3+H2SO4==KHSO4+HClO3,
3HClO3==HClO4+H2O+2ClO2,2ClO2==Cl2+2O2
(1)ClO2也能像Cl2一样在强碱(如NaOH)溶液中发生反应,其化学方程式是____________。
(2)设计一个实验确定ClO2分解产物中O2与Cl2的体积比为2∶1:_____________________。
答案:⑴6ClO2+6NaOH==NaCl+5NaClO3+3H2O
(2)用排饱和食盐水法收集一试管气体,倒扣于NaOH溶液中,振荡一会儿,观察试管中所剩气体占试管总体积的分数。
解析:此题是一道信息给予题,考查的知识点是卤素与碱的反应和实验设计。由于Cl2与NaOH反应的化学方程式是:Cl2+2NaOH===NaCl+NaClO+H2O,信息提供:“ClO2也像Cl2一样在强碱溶液中反应”, 但在ClO2中,氯元素为+4价,歧化后的价态变化较大。由于Cl2能与碱液反应而O2不能,可用碱液吸收法测定Cl2和O2的体积。
例2.(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H+++2 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色 分液(或蒸馏)
知识点二:氯的化合物(HCl、HClO)
例3.(08年上海化学·13)已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
【变式训练2】氯胺(NH2Cl)在中性或酸性条件下是一种有效的强力消毒剂,据此判断,氯胺在水溶液中因水解产生的物质是 ( )
A.HClO和HCl B.NH4C1和HCl C.NH4Cl和HClO D.NH4Cl和HClO3
知识点三:硫及化合物
例4:不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号 甲 乙 丙
① CO2 SO2 石灰水
② HCl CO2 石灰水
③ CO2 SO2 Ba(NO3)2
④ NO2 SO2 BaCl2
⑤ CO2 NH3 CaCl2
A.②③④ B.②③④⑤
C.①②④ D.①②③④
解析与评价:SO2是酸性氧化性,能和碱反应生成盐和水,SO2有较强的还原性,遇氧化性试剂易被氧化生成。本题若忽略了在酸性条件下离子的氧化性会漏选③,若未注意题干中“一定”两字会多选⑤。对于①,由于石灰水过量,因此必有CaCO3和CaSO3沉淀,对于②,同样由于石灰水过量,因此必有CaCO3沉淀生成,对于③,CO2气体与Ba(NO3)2不反应,SO2气体通入Ba(NO3)2溶液后,由于溶液酸性增强,SO2将被离子氧化生成,因此有BaSO4沉淀生成,对于④,NO2和SO2混合后,SO2将被NO2氧化成SO3,通入BaCl2溶液后有BaSO4沉淀生成,对于⑤,当NH3过量时溶液中有CaCO3沉淀生成,发生反应的化学方程式为:2NH3+CO2+CaCl2+H2O=CaCO3↓+2NH4Cl,当NH3不足时,最终无沉淀生成,发生反应的化学方程式为:2NH3+2CO2+CaCl2+2H2O=Ca(HCO3)2+2NH4Cl
答案:D
【变式训练3】在①H2S ②SO2 ③CO ④Cl2 ⑤HI ⑥CO2六种气体中,属于酸酐的是_______;能使品红溶液褪色的是_______;通入石蕊试液先变红后褪色的是_______,只变红不褪色的是_______;能使碘化钾淀粉试纸变蓝的是_______;能与溴水反应的是_______。(填序号)
答案:②⑥ ②④ ④ ①②⑤⑥ ④ ①②⑤
解析:SO2、CO2分别是H2SO3和H2CO3的酸酐。SO2能使品红溶液褪色,而Cl2与水反应产生的HClO既能使品红褪色,又能使石蕊试液先变红色后褪色,能使石蕊试液变红的气体还有H2S、SO2、HI、CO2等酸性气体 与KI作用产生I2的气体是氯气,具有氧化性。能与溴水反应的气体是H2S、SO2、HI等
例5.(09年北京理综·28)(15分)
以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)将燃烧黄铁矿的化学方程式补充完整
4 +11O2 ( http: / / www. / ) 2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是
。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2 和铵盐。
① SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为l5.00 g,浓硫酸增加的质量为 。(计算结果保留两位小数)
解析与答案:(15分)(1)FeS2 (2)2SO2+O22SO3
(3)abd(4)SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ·mol-1
(5)①SO2+Br2+2H2O=4H++2Br-+SO42- ②14.56 2.31g
变式训练4、(09年全国理综卷I·27)(15分)浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+CCO2↑+2H2O+2SO2↑
请从下图中选用所需仪器(可重复使用)组成一套进行该感应并检验出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他、固液试剂自选(连接和固体仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用仪器(填字母) 加入试剂 作用
答案:
CBAAA 浓硫硫和木炭无水硫酸铜品红酸性KMnO4澄清石灰水 产生反应物检验是否有水检验SO2 除去SO2 检验CO2的存在
知识点四:氮及其化合物
例6. 试回答制取氨气并完成喷泉实验(图中夹持装置均已略去)
图1 图2
⑴收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
⑵用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
⑶如果只提供如图2的装置,请说明引发喷泉的方法 。
解析与评价:本题以氨气的物理性质中极易溶于水为考察背景是常考容易题。(1)由于氨气极易溶于水,收集时通常采用向下排气方法,干燥氨气宜选用碱石灰;(2)喷泉实验主要原理是容器的内外产生压强差,1中是通过氨气溶于水使烧瓶内压强减小而出现喷泉;(3)中要想产生喷泉,可以将烧瓶内的氨气压入烧杯中,先增大烧瓶内压强使氨气与水接触,进而使烧瓶内压强减少而出现喷泉。
答案:(1)向下排气方,碱石灰;
(2)将胶头滴管内的水挤入烧瓶内;
(3)用热毛巾覆于烧瓶顶部。
【变式训练5】下列气体与对应的液体不能进行喷泉实验的是 ( )
A.NH3和水 B.HCl和水 C.Cl2和水 D.CO2和NaOH溶液
【变式训练6】有关氨的说法不正确的是 ( )
A. NH3是4核10电子极性分子,三角锥型,具有还原性
B. NH3极易溶于水,可做喷泉实验,氨气易液化,液氨可用作制冷剂
C. 氨气是非电解质,氨水是电解质
D. 蘸有浓盐酸玻璃棒遇氨气可产生白烟
例7.(09年全国理综Ⅱ·28)(15分)
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是 ,
发生反应的化学方程式是 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(4)实验时在D中观察到得现象是 ,D中收集到的物质是 ,检验该物质的方法和现象是 。
解析与评价:本题以氨气的制备,氨气的性质为考察要点,属于中档题。(1)、制备氨气的药品NH4Cl和Ca(OH)2,(2)干燥氨气用碱石灰(或CaO),(3)主要描述固体粉末的颜色变化,方程式见答案。(4)、描述D中的现象重点强调出现无色液体,氨气检验方法。
答 案:(1)固体NH4Cl和Ca(OH)2 2NH4Cl+Ca(OH)2 ( http: / / www. / )CaCl2+2NH3↑+2H2O
(2)碱石灰(或CaO) 除去NH3气流中的水汽
(3)黑色粉末部分逐渐变为红色 2NH3+3CuON2+3H2O+3Cu
(4)出现无色液体 氨水 用无水硫酸铜检验、无水硫酸铜变蓝
例9.(1)标况下,盛有NO2和N2以1:1混合气体的试管倒扣在水中,充分反应后余气体积占原体积的多少。
(2)将10mLNO和NO2混合气体缓慢通入倒立于水槽中的盛满水的试管中,充分反应后,有5mL剩余气体,求原混合气体NO和NO2的体积比。
解析与评价:(1)、假设试管体积为V,VNO2=0.5V,VN2=0.5V,由于3NO2+H2O=2HNO3+NO,剩余气体总体积为:V剩余=0.5V+1/6V=2/3V。
(2)、剩余气体应为NO,设10ml气体中NO体积为V1, NO2体积为V2,则有V1+V2=10,V1+1/3V2=5,求解得V1=2.5,V2=7.5,V1:V2=1:3.
答 案:(1)2/3V,(2)、V1:V2=1:3.
【变式训练9】(1)一定条件下,16mlNO和O2混合充满试管倒扣水中余气为2ml求NO占原气体的多少
(2)将12mlNO2和O2的混合气体通入足量的水中,充分反应后余气2ml(气体均在相同状态下测定)求原各气体的体积
答案:(1)分为两种情况讨论:当2ml为NO时,NO占原气体的5/8, 当2ml为O2时,NO占原气体的1/2.
(2)分为两种情况讨论:当2ml为NO时,VNO2=10.8 VO2=1.2
当2ml为O2时, VNO2=8 VO2=4
③氮的氧化物对空气的污染与防治
同步训练
1.下图是年世界环境日主题宣传画《啊!地球出汗了》,这幅宣传画所揭示的全球主要环境问题是
A.酸雨 B.臭氧层空洞 C.温室效应 D.光化学烟雾
2.为了探索月球上是否存在生命的痕迹,首先要分析月球岩中是否包藏有碳氢化合物。科学家用氘盐酸即DCl的D2O溶液处理岩石样品,收集放出的气体加以分析,结果只发现有一些气态碳氘化合物。试推断该碳氘化合物是
A.岩石中的碳酸盐与氘盐酸反应的产物
B.岩石中的碳酸氢盐与氘盐酸反应的产物
C.岩石中的碳化物与氘盐酸反应的产物 高考资源网
D.岩石中的碳氢化合物与氘盐酸反应的产物
3.下面对氯气的叙述正确的是
A.氯气可使湿的红布条褪色,所以氯气具有漂白性
B.氯气没有漂白性,但通入品红溶液中,品红褪色
C.过量的铁在氯气中燃烧可生成氯化亚铁
D.闻其气味时要小心,将集气瓶放在鼻孔下直接闻
4.烧瓶中放入铜片和稀硝酸,用酒精灯加热来制取较纯净的一氧化氮,反应开始后发现烧瓶中充满棕红色气体,这时的操作应是
A.立即接上收集容器,用向上排空气法收集
B.待烧瓶中红棕色消失后,用向上排空气法收集
C.立即用排水法收集
D.待烧瓶中红棕色气体消失后,用排水法收集
5.下列说法中不正确的是
A.普通玻璃呈淡绿色是由于含Fe2+
B.坩埚、蒸发皿都属于陶瓷制品
C.唐“三彩”是一种玻璃制品
D.高温下硅酸钙比碳酸钙稳定
6.含FeS2A%的黄铁矿W吨,在用接触法硫酸的过程中,损失硫C%,可制得浓度为B%的硫酸为
A.吨 B.吨
C.吨 D.吨
7.下列对溴化钠的描述中,正确的是
A.是一种可溶于水的晶体,熔点较高
B.跟AgNO3溶液反应将生成白色沉淀
C.跟浓硫酸反应是制取溴化氢气体的常用方法
D.其工业制法之一是将金属钠跟单质溴反应
8.下列各组物质中,每一种物质都能使溴水褪色的是
A.AgNO3溶液、CCl4、碘水
B.Na2SO3溶液、FeCl3溶液、H2S溶液
C.FeCl2溶液、KOH溶液、镁粉
D.NaOH溶液、CO气体、氯水
9.O2-由于离子半径较小,且带2个负电荷,在水中会强烈地吸引并结合水中的H+而生成OH-,下列反应中不包含此步变化的是
A.Na2O+H2O=2NaOH
B.2Na2O2+2H2O=4NaOH+O2↑
C.12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
D.Ag2O+4NH3·H2O=2[Ag(NH3)2]++2OH-+3H2O
10.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A.NaCl Na2SO4 B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
11.次氯酸盐最大的用途是漂白和消毒。这类漂白剂氧化能力是以“有效氯”的含量来标志。“有效氯”的含量定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。请问纯LiClO的“有效氯”为
A.121% B.100% C.89% D.21%
12.用浓硫酸吸收SO3可以得到H2SO4 SO3。用mg98%的H2SO4充分吸收SO3后再进行稀释,可得到98%的硫酸的质量为
A.2.42mg B.2.22mg C.2.02mg D.1.98mg
13.下列离子方程式不正确的是
A.银氨溶液中加入足量盐酸产生沉淀:
[Ag(NH3)2]+++3H++=AgCl↓+2+H2O
B.在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解:
3BaSO3+2H++2=3BaSO4↓+2NO↑+H2O
C.碳酸钠溶液中通入少量SO2:
2+SO2+H2O=2+
D.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
14.NH3和O2混合气体100mL通过红热的铂丝,充分反应后的混合气体再通过足量水最终收集到10mL残留气体,则原混合气体中O2体积不可能是(气体体积在相同条件下测定)
A.12.5mL B.21.5mL C.64.2mL D.70.0mL
15.(1)少量的Mn2+可以催化分解H2O2,其反应的机理可简单解释为:
试写出上述2步反应的离子方程式_________________
(2)对于CO中毒、心肌梗塞、冠心病或小儿肺炎等危重患者都要采用吸氧治疗。普通医务室中没有氧气瓶,但一般都有消毒用的30%的H2O2溶液。同时还有可选用的试剂为:KMnO4、HCl、H2SO4、MnO2、Mg、CuSO4、NaCl、葡萄糖。请写出一种使H2O2中氧完全释放出来的理想反应方程式______________________________。
16.氰(CN)2 的结构式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2 和水反应可生成HCN和HCNO;(CN)2 的氧化性比Br2弱,比I2强。
(1)下列有关反应的化学方程式不正确的是
(填选项标号)
A.(CN)2 和NaOH溶液反应:(CN)2 +2NaOH==NaCN+NaCNO+H2O
B.MnO2和HCN反应:MnO2+4HCNMn(CN)2+(CN)2 ↑+2H2O
C.向KCN溶液中加入碘水:I2+2KCN==2KI+(CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2NaBr==2NaCl+Br2
(2)HCN的电子式为 ,按电子云重叠方式分类分子内化学键类型为_________________,碳原子的杂化类型为____________。
(3)处理含 (其中C为+2价)的工业废水常用氧化,生成的(其中C 为+4价)元素,反应的离子方程式如下:
a+b+c=dCNO-+eN2↑+f+b+cH2O
上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1, 则b= 。
17.试依据下列事实,作出有关的结论。
(1)硅的非金属性特征大于金属特征,而锗的金属特征大于非金属特征,_____。(2)金刚石是电的绝缘体,石墨可以导电,而C60可作为制超导体材料,____________。
(3)在常温下硅的化学性质不活泼,但自然界中却没有单质硅存在,__。
(4)硅酸钠溶液中通入CO2气体时,可生成难溶于水的酸—硅酸,_ ___。
(3)碳单质的三种同素异形体:骨架型的金刚石、层型的石墨及球形的球碳分子,试确定那一种物质易在火山喷发口附近发现,_________________________________。
18.已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去
(1)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 。根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物形式均可)。试描述气体C的物理性质_____________。
(2)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。通过上述描述可知:A的化学式为 ,E的化学式为 。当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目)和一种无色无味的液体H,写出F分解生成的G+H的化学方程式 。
19.某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:
在实验或改进实验中,可能发生的化学反应如下:
PbO+CPb+CO↑,2 PbO+C2Pb+CO2↑,
Ca(OH)2+CO2=CaCO3↓+H2O
[Cu(NH3)2]Ac+CO+2NH3 [Cu(NH3)4]Ac·CO △H<0。请回答以下问题:
(1)在装置A中不断鼓入氮气的作用是 ,能否用空气代替氮气? ,其理由是 。
(2)在实验过程中,未见B装置中有白色沉淀生成,说明在装置A中发生反应的化学方程式是 ,证明氧化铅里含有氧元素的实验事实是 。
(3)若使实验更具有说服力,通过增添设备和药品,设计一个更加严密的改进实验方案是 。
(4)若没有木炭粉和氮气,改用氢气行吗? ,实验的装置和药品又将做怎样的调整?____________。
20.将23.9 g表面已锈蚀成铜绿〔Cu2(OH)2CO3〕的铜片投入120 mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO,反应后溶液中H+为0.160 mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4 g蓝色固体。求:(1)铜片中单质铜的质量分数;(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)
参考答案
1.C 2.C 3.C 4.D 5.C 6.A 7.A 8.C
9.B 10.AB 11.A 12.B 13.D 14.B
15.(1)H2O2 + Mn2+ = MnO2 + 2H+ H2O2 +MnO2 + 2H+ = H2O + Mn2+ +O2↑
(2)5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑
16.(1)CD (2) sp 2个σ键和2个π键 (3)①B ②6
17.(1)表明同主族元素性质是递变的。(2)表明C60与石墨具有某种类似的结构。(3)说明在自然条件下,硅不如其化合物稳定。(4)表明硅酸的酸性比碳酸弱。(5)三种物质中金刚石在火山口易被发现,因为该处温度高、压力大,有利于破坏石墨中的化学键,有条件形成金刚石。
18.(1)SO3 A和B H 2S2O7或H2SO4·SO3或2SO3·H2O SO2是无色有刺激性气味的气体,密度比空气大,易溶于水,有毒 (2)NH3 HNO3 NH4NO3N2O↑+2H2O。
19.(1)N2可将实验装置内的空气排净,并作为动力源将PbO与C反应生成的气体,赶入B、C两个实验装置处。不可用空气体代替N2,空气中的O2可与灼热的炭反应,且空气中还含有CO2、H2O等含氧化合物,均可导致实验失败。 (2) PbO+CPb+CO↑,在装置C处可见一氧化碳燃烧产生的淡蓝色火焰。(3)可在装置B后串联一个内盛[Cu(NH3)2]Ac溶液的洗气装置,吸收一氧化碳,反应完毕,取出吸收液加热解吸,用排水取气法收集放出的气体,通过进一步实验证明该气体是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2Pb+H2O,用无水CuSO4吸收生成的水,证明氧化铅中含有氧元素。装置B应改用内盛CuSO4白色粉末的干燥管。
20.(1)53.6% (2)6.33 mol·L-1
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
