4.1无机非金属材料的主角-硅(第一课时)
文档属性
| 名称 | 4.1无机非金属材料的主角-硅(第一课时) |

|
|
| 格式 | rar | ||
| 文件大小 | 956.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-08 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
无机非金属材料的主角——Si
陕师大2009级在读研究生 王鹏飞
形形色色的材料
硅材料
建筑材料——水泥
建筑装饰
材料—玻璃
无机非金属材料用作电子器件
荧光材料
特殊新型 复合材料
一、硅单质
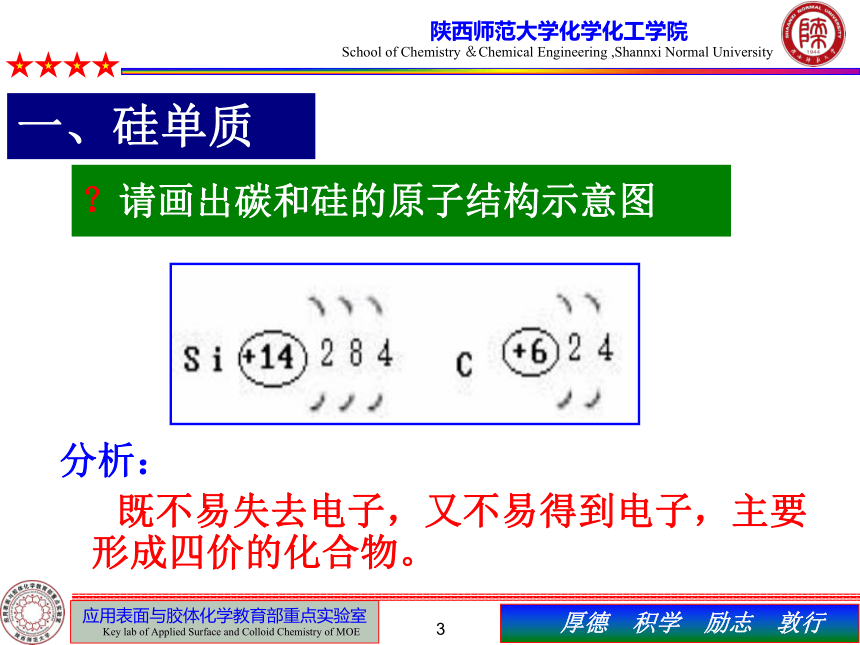
?请画出碳和硅的原子结构示意图
分析:
既不易失去电子,又不易得到电子,主要形成四价的化合物。
1、Si的存在及物理性质
硅元素以什么样的形态存在于自然界?
硅在地壳中含量仅次于氧,居第2位,硅在自然界的存在形态:没有游离态,只有化合态-----二氧化硅、硅酸盐。
硅单质:灰黑色、有金属光泽、硬而脆的固体,是很好的半导体材料!晶体硅和无定形硅---同素异形体
硅
2、Si 化学性质
与单质的反应:
Si + O2 === SiO2
Si + 2F2 === SiF4
与酸的反应
Si + 4HF === SiF4↑ + 2H2 ↑
Note:与硝酸、硫酸不反应
与碱的反应
Si + 2NaOH + H2O === Na2SiO3 + 2H2 ↑
硅的化学性质不活波,但在常温下可以和氟气(F2)、氢氟酸(HF)和强碱反应
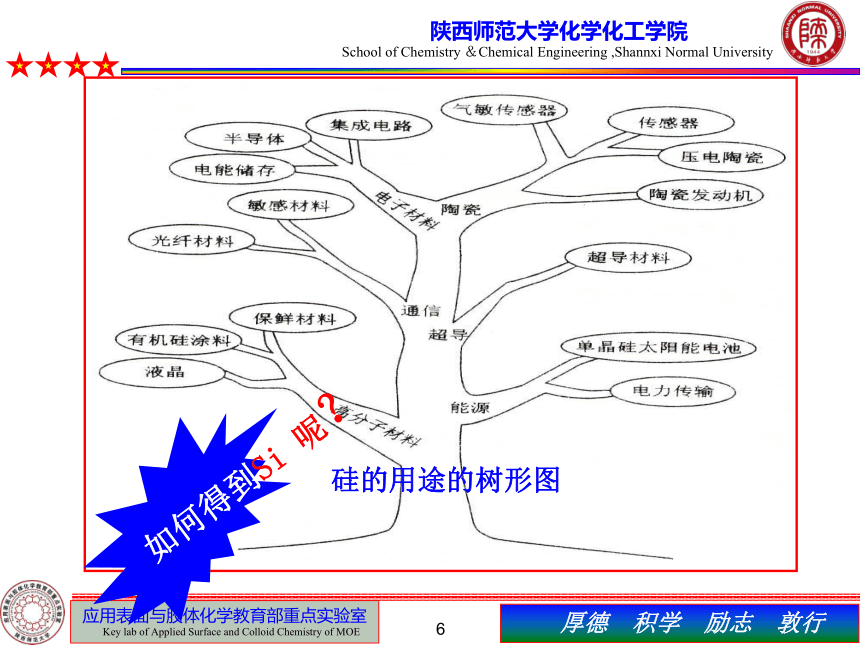
硅的用途的树形图
如何得到Si 呢?
3、单质Si的制备
在高温下让粗硅(Si)与氯气(Cl2)反应,其产物在高温下被氢气(H2)还原而得到较纯的硅
SiCl4+2H2===Si+4HCl
高温
(高纯硅 99.9999999%)
提纯硅
Si + 2Cl2=== SiCl4
高温
粗硅
SiO2 +2C == Si + 2CO↑
高温
粗硅
制粗硅
二、二氧化硅(SiO2)
玛瑙
石英
石英
光导纤维
水晶
石英、沙子、玛瑙和硅藻土等。
天然的二氧化硅分为晶体和无定形两类。
1、SiO2的存在
在SiO2的晶体中,每个硅原子与 个氧原子结合,每个氧
原子与 个硅原子结合,即SiO2晶体是由Si和O按 的
比例所组成的 空间网状结构的晶体。
2、 SiO2的结构
4
2
1∶2
正四面体
将晶体硅结构中的每一个“硅-硅”共价键打开,并在其间夹入一个氧原子,就形成了二氧化硅的晶体。这样,每个硅原子和四个氧原子以共价键结合,形成以该硅原子为中心的正四面体型结构,这种正四面体型结构向空间伸展,就形成了具有空间网状结构的原子晶体。由于每个氧原子同时和两个硅原子成键,所以二氧化硅晶体中,硅氧原子数之比为1:2,SiO2只表示一种比例关系,并不表示晶体中存在SiO2的小分子。
3、SiO2的物理性质
二氧化硅是 、 等的主要成分,具有硬度 、熔点 、 导电、不溶于水等性质。
沙子
土壤
大
高
不
玻璃瓶塞被粘住在一个盛放NaOH试剂瓶,不能打开,瓶塞被粘住的原因是什么?怎样才能打开?
玻璃镜面上字(图片),字是怎样弄上去的?请讨论!
①酸性氧化物的通性
SiO2+CaO
SiO2+ NaOH===
②与碳的反应:SiO2+ C
③与氢氟酸的反应:SiO2+4HF ===
4、SiO2的化学性质及用途
CaSiO3
2
Si+2CO↑
SiF4↑+2H2O
2
Na2SiO3+H2O
用途:SiO2可用于制造 、石英坩埚、饰物等。
光导纤维
在高温下与碳酸盐的反应(应用于玻璃生产)
SiO2 + Na2CO3 === CO2↑ + Na2SiO3
SiO2 + CaCO3 === CO2↑ + CaSiO3
高温
高温
思考:
C与Si同属第IVA元素,原子最外层电子数目相同,其相应的氧化物CO2与SiO2性质有哪些异同点?
提示:CO2与SiO2比较
二氧化碳 二氧化硅
存 在
物理性质
化学性质 与水
与酸
与NaOH溶液
与CaO
与盐
用 途
SiO2与CO2
SiO2与CO2那个说分子式那个说化学式?为什么
硅元素
单质硅
Si + F2
Si + HF
Si + NaOH
加热能与某
些非金属单
质反应(O2、Cl2)
O2
二氧化硅是光导纤维
的主要原料,光导纤
维可用作通讯材料和
制造医用内窥镜等
硅可制造集成路、
太阳能电池等;硅
合金可用来制造变
压器铁芯、耐酸设
备等。
C 高温
HF
无游离态
常温不活泼
只有化合态
SiO2
硅酸盐
Na2SiO3、
CaSiO3
碱
碱性氧化物
三、硅酸(H2SiO3)
思考:硅酸(H2SiO3)能通过二氧化硅与水反应制得吗?
为什么?
1、不溶于水,酸性比碳酸弱。
硅酸是一种弱酸,它不溶于水,不能使指示剂变色,是一种白色粉末状的固体。硅酸凝胶经干燥脱水后得到多孔的硅酸干凝胶,称为“硅胶”。
实验4-1:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸
现 象
结 论
方程式
滴入酚酞溶液呈红色
Na2SiO3呈碱性
Na2SiO3+2HCl = H2SiO3 +2NaCl
实验探究:
滴入盐酸有硅酸凝胶产生
硅酸难溶于水
2、制备:较强酸与可溶硅酸盐溶液
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3+H2O+CO2==H2SiO3↓+Na2CO3
硅酸是一种白色胶状物质,不溶于水,受热干燥失水。
生成的H4SiO4叫原硅酸,是一种白色胶状物质,不溶于水,在干燥的空气中易失水变成硅酸。
H4SiO4====H2SiO3+H2O
3、用途:
硅酸在水中易聚合形成胶体。浓度较小时—— ;浓度较大时—— 。硅酸凝胶干燥脱水→硅酸干凝胶,又称硅胶,吸附水的能力强,常用作 ,也用作催化剂的载体。
无色透明液体
凝胶
干燥剂
小结
作业布置
【例1】 下列说法正确的是( )
A.二氧化硅是酸性氧化物,它可以跟碱反应,但不能与任何酸反应
B.根据反应SiO2+CaCO3 ==== CaSiO3+CO2↑可推知硅酸酸性比碳酸强
C.二氧化碳通入硅酸钠溶液中可以制得硅酸
D.晶体硅常被用来制造光导纤维
高温
C
【练习】下列物质的变化,不能通过一步化学反应完成的是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3 C.Na2O2→Na2CO3 D.SiO2→H2SiO3
D
【例2】 1 mol SiO2晶体中含有Si—O共价键的物质的量是( )
A.1 mol B.2 mol C.3 mol D.4 mol
D
【例3】硅单质和碳单质及相应氧化物、氢化物、盐在性质上有很多相似的地方。如它们的最高价氧化物都是酸性氧化物,都能与碱反应生成盐和水,都能和碱性氧 化物(如CaO)反应生成盐等;它们的氢化物都能燃烧生成对应的氧化物和水。把河沙(主要成分是SiO2)跟镁粉按一定质量比(稍大于15∶24)混合均匀,装入试管中加热大约1分钟后发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下反应的化学方程式:____________________,该 反应是________反应(填“放热”或“吸热”)。
(2)生成的混合物放入稀硫酸中,产生的气体是(填化学式)________。
(3)写出产生“爆炸声”的化学方程式:
_________________________________________________。
1)SiO2+4Mg == == Mg2Si+2MgO 放热
(2)SiH4
(3)SiH4+2O2 === SiO2+2H2O
【例4】.工业上,用焦炭在高温下还原石英砂可制得粗硅SiO2+2C=Si(粗)+2CO↑ ① ,又能跟氯气反应经提纯得到 SiCl4后再用氢气还原制得纯硅:Si(粗)+2Cl2=SiCl4 ② ,SiCl4+2H2=Si(纯)+4HCl③。根据以上反应回答下列问题:
(1)反应①中焦炭做( )
A.还原剂 B.氧化剂 C.二者都不是
(2)反应②属于( ),反应③属于( )
A.化合反应 B.分解反应 C.氧化还原反应
D.非氧化还原反应 E.置换反应
A
A C
C E
无机非金属材料的主角——Si
陕师大2009级在读研究生 王鹏飞
形形色色的材料
硅材料
建筑材料——水泥
建筑装饰
材料—玻璃
无机非金属材料用作电子器件
荧光材料
特殊新型 复合材料
一、硅单质
?请画出碳和硅的原子结构示意图
分析:
既不易失去电子,又不易得到电子,主要形成四价的化合物。
1、Si的存在及物理性质
硅元素以什么样的形态存在于自然界?
硅在地壳中含量仅次于氧,居第2位,硅在自然界的存在形态:没有游离态,只有化合态-----二氧化硅、硅酸盐。
硅单质:灰黑色、有金属光泽、硬而脆的固体,是很好的半导体材料!晶体硅和无定形硅---同素异形体
硅
2、Si 化学性质
与单质的反应:
Si + O2 === SiO2
Si + 2F2 === SiF4
与酸的反应
Si + 4HF === SiF4↑ + 2H2 ↑
Note:与硝酸、硫酸不反应
与碱的反应
Si + 2NaOH + H2O === Na2SiO3 + 2H2 ↑
硅的化学性质不活波,但在常温下可以和氟气(F2)、氢氟酸(HF)和强碱反应
硅的用途的树形图
如何得到Si 呢?
3、单质Si的制备
在高温下让粗硅(Si)与氯气(Cl2)反应,其产物在高温下被氢气(H2)还原而得到较纯的硅
SiCl4+2H2===Si+4HCl
高温
(高纯硅 99.9999999%)
提纯硅
Si + 2Cl2=== SiCl4
高温
粗硅
SiO2 +2C == Si + 2CO↑
高温
粗硅
制粗硅
二、二氧化硅(SiO2)
玛瑙
石英
石英
光导纤维
水晶
石英、沙子、玛瑙和硅藻土等。
天然的二氧化硅分为晶体和无定形两类。
1、SiO2的存在
在SiO2的晶体中,每个硅原子与 个氧原子结合,每个氧
原子与 个硅原子结合,即SiO2晶体是由Si和O按 的
比例所组成的 空间网状结构的晶体。
2、 SiO2的结构
4
2
1∶2
正四面体
将晶体硅结构中的每一个“硅-硅”共价键打开,并在其间夹入一个氧原子,就形成了二氧化硅的晶体。这样,每个硅原子和四个氧原子以共价键结合,形成以该硅原子为中心的正四面体型结构,这种正四面体型结构向空间伸展,就形成了具有空间网状结构的原子晶体。由于每个氧原子同时和两个硅原子成键,所以二氧化硅晶体中,硅氧原子数之比为1:2,SiO2只表示一种比例关系,并不表示晶体中存在SiO2的小分子。
3、SiO2的物理性质
二氧化硅是 、 等的主要成分,具有硬度 、熔点 、 导电、不溶于水等性质。
沙子
土壤
大
高
不
玻璃瓶塞被粘住在一个盛放NaOH试剂瓶,不能打开,瓶塞被粘住的原因是什么?怎样才能打开?
玻璃镜面上字(图片),字是怎样弄上去的?请讨论!
①酸性氧化物的通性
SiO2+CaO
SiO2+ NaOH===
②与碳的反应:SiO2+ C
③与氢氟酸的反应:SiO2+4HF ===
4、SiO2的化学性质及用途
CaSiO3
2
Si+2CO↑
SiF4↑+2H2O
2
Na2SiO3+H2O
用途:SiO2可用于制造 、石英坩埚、饰物等。
光导纤维
在高温下与碳酸盐的反应(应用于玻璃生产)
SiO2 + Na2CO3 === CO2↑ + Na2SiO3
SiO2 + CaCO3 === CO2↑ + CaSiO3
高温
高温
思考:
C与Si同属第IVA元素,原子最外层电子数目相同,其相应的氧化物CO2与SiO2性质有哪些异同点?
提示:CO2与SiO2比较
二氧化碳 二氧化硅
存 在
物理性质
化学性质 与水
与酸
与NaOH溶液
与CaO
与盐
用 途
SiO2与CO2
SiO2与CO2那个说分子式那个说化学式?为什么
硅元素
单质硅
Si + F2
Si + HF
Si + NaOH
加热能与某
些非金属单
质反应(O2、Cl2)
O2
二氧化硅是光导纤维
的主要原料,光导纤
维可用作通讯材料和
制造医用内窥镜等
硅可制造集成路、
太阳能电池等;硅
合金可用来制造变
压器铁芯、耐酸设
备等。
C 高温
HF
无游离态
常温不活泼
只有化合态
SiO2
硅酸盐
Na2SiO3、
CaSiO3
碱
碱性氧化物
三、硅酸(H2SiO3)
思考:硅酸(H2SiO3)能通过二氧化硅与水反应制得吗?
为什么?
1、不溶于水,酸性比碳酸弱。
硅酸是一种弱酸,它不溶于水,不能使指示剂变色,是一种白色粉末状的固体。硅酸凝胶经干燥脱水后得到多孔的硅酸干凝胶,称为“硅胶”。
实验4-1:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸
现 象
结 论
方程式
滴入酚酞溶液呈红色
Na2SiO3呈碱性
Na2SiO3+2HCl = H2SiO3 +2NaCl
实验探究:
滴入盐酸有硅酸凝胶产生
硅酸难溶于水
2、制备:较强酸与可溶硅酸盐溶液
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3+H2O+CO2==H2SiO3↓+Na2CO3
硅酸是一种白色胶状物质,不溶于水,受热干燥失水。
生成的H4SiO4叫原硅酸,是一种白色胶状物质,不溶于水,在干燥的空气中易失水变成硅酸。
H4SiO4====H2SiO3+H2O
3、用途:
硅酸在水中易聚合形成胶体。浓度较小时—— ;浓度较大时—— 。硅酸凝胶干燥脱水→硅酸干凝胶,又称硅胶,吸附水的能力强,常用作 ,也用作催化剂的载体。
无色透明液体
凝胶
干燥剂
小结
作业布置
【例1】 下列说法正确的是( )
A.二氧化硅是酸性氧化物,它可以跟碱反应,但不能与任何酸反应
B.根据反应SiO2+CaCO3 ==== CaSiO3+CO2↑可推知硅酸酸性比碳酸强
C.二氧化碳通入硅酸钠溶液中可以制得硅酸
D.晶体硅常被用来制造光导纤维
高温
C
【练习】下列物质的变化,不能通过一步化学反应完成的是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3 C.Na2O2→Na2CO3 D.SiO2→H2SiO3
D
【例2】 1 mol SiO2晶体中含有Si—O共价键的物质的量是( )
A.1 mol B.2 mol C.3 mol D.4 mol
D
【例3】硅单质和碳单质及相应氧化物、氢化物、盐在性质上有很多相似的地方。如它们的最高价氧化物都是酸性氧化物,都能与碱反应生成盐和水,都能和碱性氧 化物(如CaO)反应生成盐等;它们的氢化物都能燃烧生成对应的氧化物和水。把河沙(主要成分是SiO2)跟镁粉按一定质量比(稍大于15∶24)混合均匀,装入试管中加热大约1分钟后发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下反应的化学方程式:____________________,该 反应是________反应(填“放热”或“吸热”)。
(2)生成的混合物放入稀硫酸中,产生的气体是(填化学式)________。
(3)写出产生“爆炸声”的化学方程式:
_________________________________________________。
1)SiO2+4Mg == == Mg2Si+2MgO 放热
(2)SiH4
(3)SiH4+2O2 === SiO2+2H2O
【例4】.工业上,用焦炭在高温下还原石英砂可制得粗硅SiO2+2C=Si(粗)+2CO↑ ① ,又能跟氯气反应经提纯得到 SiCl4后再用氢气还原制得纯硅:Si(粗)+2Cl2=SiCl4 ② ,SiCl4+2H2=Si(纯)+4HCl③。根据以上反应回答下列问题:
(1)反应①中焦炭做( )
A.还原剂 B.氧化剂 C.二者都不是
(2)反应②属于( ),反应③属于( )
A.化合反应 B.分解反应 C.氧化还原反应
D.非氧化还原反应 E.置换反应
A
A C
C E
