1.3水是良好的溶剂(2)饱和溶液、不饱和溶液、溶解度概念—华东师大版七年级科学下册课件(共18张PPT)
文档属性
| 名称 | 1.3水是良好的溶剂(2)饱和溶液、不饱和溶液、溶解度概念—华东师大版七年级科学下册课件(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-03-10 00:00:00 | ||
图片预览





文档简介
1.3水是良好的溶剂
1、判断下列溶液的溶质、溶剂
(1)消毒酒精
(2)高锰酸钾溶液
(3)汽水 (主要溶有二氧化碳)
2、判断对错
(1)溶液是无色、透明、均一稳定的混合物( )
(2)均一稳定的液体一定是溶液( )
温故知新
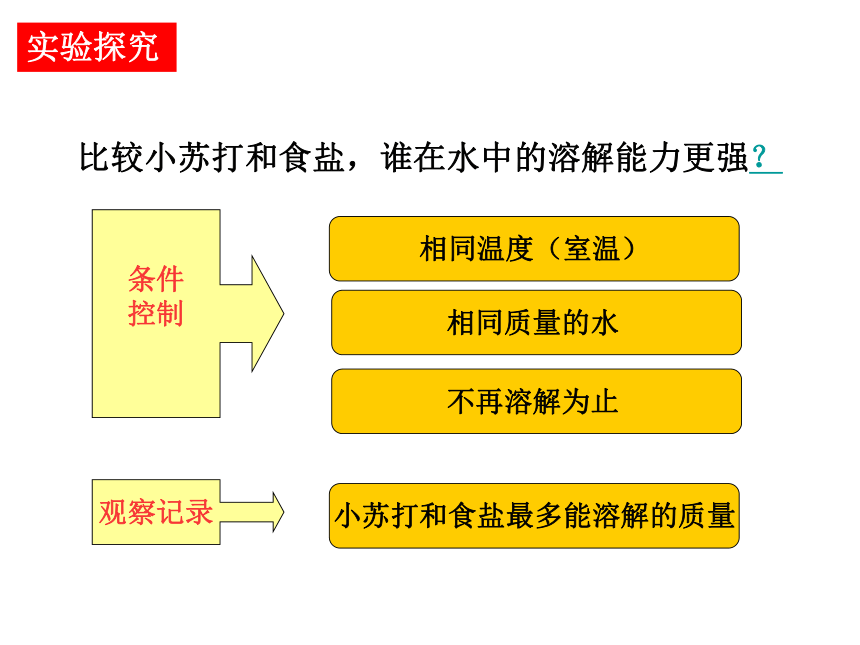
比较小苏打和食盐,谁在水中的溶解能力更强?
条件
控制
相同温度(室温)
相同质量的水
不再溶解为止
观察记录
小苏打和食盐最多能溶解的质量
实验探究
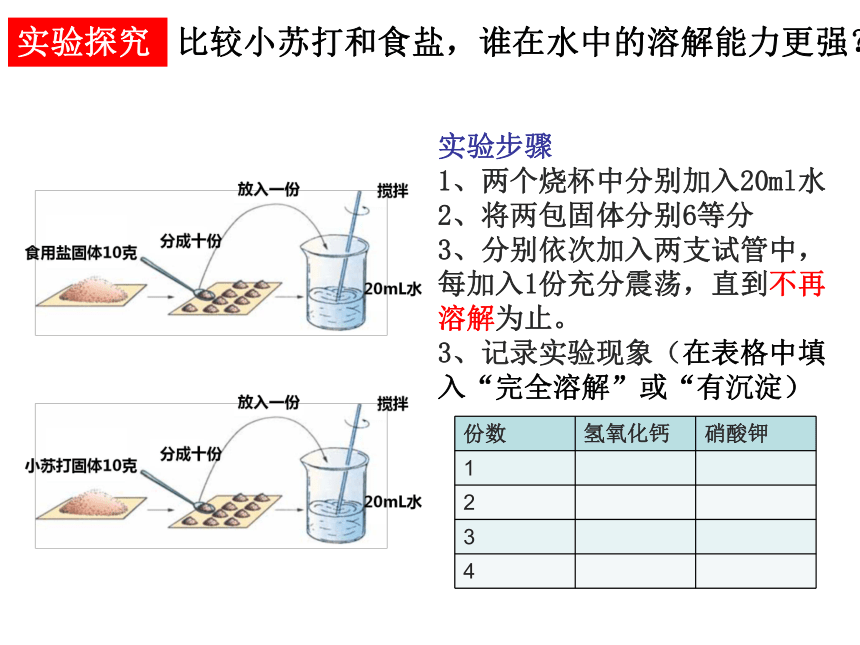
实验探究
实验步骤
1、两个烧杯中分别加入20ml水
2、将两包固体分别6等分
3、分别依次加入两支试管中,每加入1份充分震荡,直到不再溶解为止。
3、记录实验现象(在表格中填入“完全溶解”或“有沉淀)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}份数
氢氧化钙
硝酸钾
1
2
3
4
比较小苏打和食盐,谁在水中的溶解能力更强?
比较小苏打和食盐,谁在水中的溶解能力更强?
实验探究
在一定的条件下,溶质不能无限地溶解在溶剂里;
不同溶质在同一种溶剂里的溶解能力是不同的。
实验现象
实验结论
饱和溶液:
不饱和溶液:
在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液。
在一定温度下,在一定量的溶剂里能继续再溶解某种溶质的溶液。
概念提取
对某溶质是饱和溶液,对另一种溶质可能是不饱和的。
1、饱和的食盐溶液中还能继续溶解糖吗?
概念辨析
实验探究
①哪些因素会影响溶质在溶剂中的溶解能力?
②玻璃棒搅拌会增大物质在水中的溶解能力吗?
知识链接:
溶解能力指的是在一定温度下溶解的多少,而溶解的快慢指的是溶解的速度。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
溶解度
溶解的速度
定义
影响因素
溶解的多少
溶解的快慢
(1)溶质性质
(2)溶剂性质
(3)温度高低
(1)溶剂的温度
(2)溶质颗粒的大小
(3)是否搅拌等
溶解能力(溶解度)指的是在一定温度下溶解的多少,而溶解的快慢指的是溶解的速度。
概念辨析
1、①饱和溶液是否一定是浓溶液?
②不饱和溶液是否一定是稀溶液?
实验思考
加入1份小苏打的不饱和溶液
①
②
加入3份小苏打的饱和溶液
加入3份小苏打加热后的不饱和溶液
加入3份食盐的不饱和溶液
③
④
①②,相同条件下,饱和溶液的浓度高于不饱和溶液。
②③,温度不同时,饱和溶液的浓度可能低于不饱和溶液。
①④,溶质不同时,饱和溶液的浓度可能低于不饱和溶液。
浓溶液和稀溶液与饱和溶液和不饱和溶液的关系
概念比较
不饱和溶液
饱和溶液
浓溶液
稀溶液
2、如何判断一种溶液是否饱和?
(1)液体底部有未溶解的固体物质
上部的澄清溶液是饱和溶液。
(2)液体底部没有未溶解的固体物质
?加少量的溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。
?恒温蒸发掉少量溶剂,有溶质析出是饱和溶液
?将溶液略微降温,有溶质析出是饱和溶液。
实验思考
①怎样将饱和的硫酸铜溶液变成不饱和溶液?
加水,升高温度
②室温下有一杯接近饱和的硫酸铜溶液,怎样把它变成饱和溶液?
加硫酸铜,恒温蒸发水, 降低温度
③给你一杯饱和硫酸铜溶液溶液,怎样得到硫酸铜晶体?
蒸发水, 降低温度
饱和溶液
增加溶剂
升高温度
不饱和溶液
增加溶质
恒温蒸发溶剂
降低温度
实验思考
3、饱和溶液和不饱和溶液间的相互转化?
饱和溶液和不饱和溶液转化的方法:
↓
—
↑
↑
—↑
①蒸发结晶法
②热饱和溶液降温结晶法
结晶的方法:
比较A和B,谁在水中的溶解能力更强?
条件
控制
相同温度
相同质量的溶剂
达到饱和状态
观察记录
溶质的质量
固体物质
溶解度
(S)
在一定温度下
在100g水
(溶剂)中
达到饱和状态
物质
(溶质)
所溶解的质量
(单位g/100g水)
方法总结
溶解度:
在一定温度下,某种固体物质溶解在100g水中达到饱和状态时所溶解的质量,叫做这种物质在水里的溶解度。
概念提取
一定温度
100克溶剂(一般指水)
饱和状态
克/100克水 (g/100g水) 或 克(g)
概括为:
S、剂、质、温、饱、
(死 记 着 温 饱)
条件:
标准:
溶液状态:
单位:
符号:
S
20℃时,几种常见物质的溶解度
0.0013
203.9
0.165
36
32
溶解度(g/100g水)
大理石
石灰石
(碳酸钙)
蔗糖
氢氧化钙
(熟石灰)
氯化钠
(食盐)
硝酸钾
溶质名称
20℃时,硝酸钾的溶解度是32克/100克水,表示的意思是:
① 20℃时,100克水中最多只能溶解32克硝酸钾.
② 20℃时,32克硝酸钾溶解在100克水中恰好达到饱和状态.
小资料
40℃时,11克硝酸铵溶解在水中达到饱和,所以40℃时硝酸铵的溶解度是11g/100g水。
20℃时,20克氯化钠可溶解在100克水中,所以20℃时氯化钠的溶解度是20g/100g水。
31 .6g硝酸钾溶解在100g水中达到饱和,所以硝酸钾的溶解度是31 .6g/100g水。
t ℃时,把10克某物质溶解在100克水里恰好制成饱和溶液,t ℃时,这种物质的溶解度就是10。
20℃时,0.165克氢氧化钙溶解在100g水中达到饱和,所以20℃时氢氧化钙的溶解度是0.165g/100g水。
20℃时,100克水中最多能溶解203.9克蔗糖,所以20℃时蔗糖的溶解度是203.9g。
概念判断
20 ℃时,100克水中放入36克食盐完全溶解,并恰好达到了饱和。
求: 20 ℃时,食盐的溶解度。
40℃时,20克水中放入9克食盐完全溶解,并恰好达到了饱和。
求: 40 ℃时,食盐的溶解度。
算一算
溶解性的划分
{284E427A-3D55-4303-BF80-6455036E1DE7}溶解性
溶解度/g (20 ℃)
易溶
可溶
微溶
难溶
>10 g
>1 g
<1 g
<0.01 g
溶解是绝对的,不溶是相对的,没有绝对不溶的物质
.
0.01g
1g
10g
易溶
可溶
微溶
难溶
20℃的溶解度/g
小资料
1、判断下列溶液的溶质、溶剂
(1)消毒酒精
(2)高锰酸钾溶液
(3)汽水 (主要溶有二氧化碳)
2、判断对错
(1)溶液是无色、透明、均一稳定的混合物( )
(2)均一稳定的液体一定是溶液( )
温故知新
比较小苏打和食盐,谁在水中的溶解能力更强?
条件
控制
相同温度(室温)
相同质量的水
不再溶解为止
观察记录
小苏打和食盐最多能溶解的质量
实验探究
实验探究
实验步骤
1、两个烧杯中分别加入20ml水
2、将两包固体分别6等分
3、分别依次加入两支试管中,每加入1份充分震荡,直到不再溶解为止。
3、记录实验现象(在表格中填入“完全溶解”或“有沉淀)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}份数
氢氧化钙
硝酸钾
1
2
3
4
比较小苏打和食盐,谁在水中的溶解能力更强?
比较小苏打和食盐,谁在水中的溶解能力更强?
实验探究
在一定的条件下,溶质不能无限地溶解在溶剂里;
不同溶质在同一种溶剂里的溶解能力是不同的。
实验现象
实验结论
饱和溶液:
不饱和溶液:
在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液。
在一定温度下,在一定量的溶剂里能继续再溶解某种溶质的溶液。
概念提取
对某溶质是饱和溶液,对另一种溶质可能是不饱和的。
1、饱和的食盐溶液中还能继续溶解糖吗?
概念辨析
实验探究
①哪些因素会影响溶质在溶剂中的溶解能力?
②玻璃棒搅拌会增大物质在水中的溶解能力吗?
知识链接:
溶解能力指的是在一定温度下溶解的多少,而溶解的快慢指的是溶解的速度。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
溶解度
溶解的速度
定义
影响因素
溶解的多少
溶解的快慢
(1)溶质性质
(2)溶剂性质
(3)温度高低
(1)溶剂的温度
(2)溶质颗粒的大小
(3)是否搅拌等
溶解能力(溶解度)指的是在一定温度下溶解的多少,而溶解的快慢指的是溶解的速度。
概念辨析
1、①饱和溶液是否一定是浓溶液?
②不饱和溶液是否一定是稀溶液?
实验思考
加入1份小苏打的不饱和溶液
①
②
加入3份小苏打的饱和溶液
加入3份小苏打加热后的不饱和溶液
加入3份食盐的不饱和溶液
③
④
①②,相同条件下,饱和溶液的浓度高于不饱和溶液。
②③,温度不同时,饱和溶液的浓度可能低于不饱和溶液。
①④,溶质不同时,饱和溶液的浓度可能低于不饱和溶液。
浓溶液和稀溶液与饱和溶液和不饱和溶液的关系
概念比较
不饱和溶液
饱和溶液
浓溶液
稀溶液
2、如何判断一种溶液是否饱和?
(1)液体底部有未溶解的固体物质
上部的澄清溶液是饱和溶液。
(2)液体底部没有未溶解的固体物质
?加少量的溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。
?恒温蒸发掉少量溶剂,有溶质析出是饱和溶液
?将溶液略微降温,有溶质析出是饱和溶液。
实验思考
①怎样将饱和的硫酸铜溶液变成不饱和溶液?
加水,升高温度
②室温下有一杯接近饱和的硫酸铜溶液,怎样把它变成饱和溶液?
加硫酸铜,恒温蒸发水, 降低温度
③给你一杯饱和硫酸铜溶液溶液,怎样得到硫酸铜晶体?
蒸发水, 降低温度
饱和溶液
增加溶剂
升高温度
不饱和溶液
增加溶质
恒温蒸发溶剂
降低温度
实验思考
3、饱和溶液和不饱和溶液间的相互转化?
饱和溶液和不饱和溶液转化的方法:
↓
—
↑
↑
—↑
①蒸发结晶法
②热饱和溶液降温结晶法
结晶的方法:
比较A和B,谁在水中的溶解能力更强?
条件
控制
相同温度
相同质量的溶剂
达到饱和状态
观察记录
溶质的质量
固体物质
溶解度
(S)
在一定温度下
在100g水
(溶剂)中
达到饱和状态
物质
(溶质)
所溶解的质量
(单位g/100g水)
方法总结
溶解度:
在一定温度下,某种固体物质溶解在100g水中达到饱和状态时所溶解的质量,叫做这种物质在水里的溶解度。
概念提取
一定温度
100克溶剂(一般指水)
饱和状态
克/100克水 (g/100g水) 或 克(g)
概括为:
S、剂、质、温、饱、
(死 记 着 温 饱)
条件:
标准:
溶液状态:
单位:
符号:
S
20℃时,几种常见物质的溶解度
0.0013
203.9
0.165
36
32
溶解度(g/100g水)
大理石
石灰石
(碳酸钙)
蔗糖
氢氧化钙
(熟石灰)
氯化钠
(食盐)
硝酸钾
溶质名称
20℃时,硝酸钾的溶解度是32克/100克水,表示的意思是:
① 20℃时,100克水中最多只能溶解32克硝酸钾.
② 20℃时,32克硝酸钾溶解在100克水中恰好达到饱和状态.
小资料
40℃时,11克硝酸铵溶解在水中达到饱和,所以40℃时硝酸铵的溶解度是11g/100g水。
20℃时,20克氯化钠可溶解在100克水中,所以20℃时氯化钠的溶解度是20g/100g水。
31 .6g硝酸钾溶解在100g水中达到饱和,所以硝酸钾的溶解度是31 .6g/100g水。
t ℃时,把10克某物质溶解在100克水里恰好制成饱和溶液,t ℃时,这种物质的溶解度就是10。
20℃时,0.165克氢氧化钙溶解在100g水中达到饱和,所以20℃时氢氧化钙的溶解度是0.165g/100g水。
20℃时,100克水中最多能溶解203.9克蔗糖,所以20℃时蔗糖的溶解度是203.9g。
概念判断
20 ℃时,100克水中放入36克食盐完全溶解,并恰好达到了饱和。
求: 20 ℃时,食盐的溶解度。
40℃时,20克水中放入9克食盐完全溶解,并恰好达到了饱和。
求: 40 ℃时,食盐的溶解度。
算一算
溶解性的划分
{284E427A-3D55-4303-BF80-6455036E1DE7}溶解性
溶解度/g (20 ℃)
易溶
可溶
微溶
难溶
>10 g
>1 g
<1 g
<0.01 g
溶解是绝对的,不溶是相对的,没有绝对不溶的物质
.
0.01g
1g
10g
易溶
可溶
微溶
难溶
20℃的溶解度/g
小资料
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
