2020_2021学年人教版(五四学制)化学九年级全册 第四单元 盐 化肥复习 课件(40张PPT)
文档属性
| 名称 | 2020_2021学年人教版(五四学制)化学九年级全册 第四单元 盐 化肥复习 课件(40张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 544.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-10 11:37:21 | ||
图片预览








文档简介
(共40张PPT)
盐
化肥
常见的盐
常见的盐
及其性质
常见的盐及其用途
粗盐中难溶性杂质的去除
常见盐的化学性质
(“盐四条”)
概念:组成里含有金属离子(或铵根
离子)和酸根离子的化合物
常见的盐及其用途
氯化钠
俗称(或
主要成分)
食盐
性质
有咸味的白色固体,易溶于水,水溶液呈中性
用途
可作
、防腐剂、医用生理盐水、
农业选种等
特殊化学
性质
AgNO3+NaCl
AgCl↓+NaNO3
调味剂
常见的盐及其用途
碳酸钠
俗称(或
主要成分)
_______、苏打
性质
白色固体,易溶于水,水溶液呈碱性
用途
用于生产玻璃、洗涤剂、造纸、纺织等工业
特殊化学
性质
热稳定性强,能使无色酚酞溶液变⑥____
纯碱
红
常见的盐及其用途
碳酸氢钠
俗称(或
主要成分)
_______
性质
白色固体,易溶于水,水溶液呈弱碱性,加热易分解
用途
可作发酵粉,
,治疗胃酸过多症
特殊化学
性质
2NaHCO3
Na2CO3+CO2↑+H2O
△
小苏打
制汽水
常见的盐及其用途
碳酸钙
俗称(或
主要成分)
石灰石、大理石
性质
白色固体,③
溶于水,溶于酸
用途
实验室中用来制取CO2,可用作建筑材料、补钙剂
特殊化学
性质
(此反应用于工业制CO2)
难
CaCO3
CaO+CO2↑
高温
常见盐的
化学性质
(“盐四条”)
(高频)
与某些金属反应
(置换反应)
与酸反应
与碱反应
与某些盐反应
与某些金属反应(置换反应)
规律:金属+盐→新金属+新盐
举例:CuSO4+Fe
________
FeSO4+Cu
与酸反应
规律:盐+酸→新盐+新酸
举例
Na2CO3+2HCl
__________
2NaCl+H2O+CO2↑
CaCO3+2HCl
_______________
CaCl2+H2O+CO2↑
与碱反应
规律:盐+碱
→新盐+新碱
举例
Na2CO3+Ca(OH)2
CuSO4+2NaOH
CaCO3↓+2NaOH
Cu(OH)2↓+Na2SO4
与某些盐反应
规律:盐+盐
→新盐+新盐
举例
MgSO4+BaCl2
CaCl2+Na2CO3
BaSO4↓+MgCl2
CaCO3↓+2NaCl
盐与碱
盐与碱、盐反应的条件:反应物均溶于水,生成物中有沉淀、气体或水
化学方程式梳理
①________________________________________、
________________________________________
;
②_____________________________________、
_____________________________________;
Ca(OH)2+Na2CO3
CaCO3↓+2NaOH
Ba(OH)2+Na2CO3
BaCO3↓+2NaOH
Na2CO3+CaCl2
CaCO3↓+2NaCl
Na2CO3+BaCl2
BaCO3↓+2NaCl
③_______________________________________、
________________________________________
;
④_____________________________________;
⑤______________________________________;
Na2CO3+2HCl
2NaCl+CO2↑+H2O
Na2CO3+H2SO4
Na2SO4+CO2↑+H2O
2NaHCO3
Na2CO3+H2O+CO2↑
△
Na2CO3+CO2+H2O
2NaHCO3
⑥______________________________________、
____________________________________________
;
⑦___________________________________;
⑧__________________________________。
NaHCO3+HCl
NaCl+CO2↑+H2O
2NaHCO3+H2SO4
Na2SO4+2CO2↑+2H2O
NaCl+AgNO3
AgCl↓+NaNO3
Na2SO4+BaCl2
2NaCl+BaSO4↓
化肥
化肥的种类
化肥的鉴别
化肥的施用
种类
概念
常见化肥
作用
氮肥
只含营养元素(氮、磷、钾)中
_______
的化肥
尿素[CO(NH2)2],
_______
(NH3·H2O)、氯化铵(NH4Cl)、硝酸铵(NH4NO3)、碳酸氢铵(NH4HCO3)
促进植物的茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量
磷肥
只含营养元素(氮、磷、钾)中
_______的化肥
__________、钙镁磷肥、过磷酸钙
促进作物生长,增强作物抗寒、抗旱能力
氮元素
氨水
磷元素
磷矿粉
化肥的种类
种类
概念
常见化肥
作用
钾肥
只含营养元素(氮、磷、钾)中
_______
的化肥
硫酸钾(K2SO4)
_______(KCl)
促进植物生长、增强抗病虫害
和抗倒伏能力
等功能
复合肥
含营养元素(氮、磷、钾)中两种或两
种以上元素
的化肥
_______
(KNO3)、磷酸二氢铵(NH4H2PO4)
均匀地供给作物几种养分,充分发挥营养元素间的相互作用,有效成分高
钾元素
氯化钾
硝酸钾
化肥的种类
化肥的鉴别
磷矿粉为灰白色固体,不同于其他种类的化肥,可作为判断磷矿粉的依据
铵态氮肥的检验
铵态氮肥的检验
取样于研钵中,加入熟石灰,研磨,若产生刺激性气味的气体,则样品中含铵盐
固体样品:
取样于试管中,加入碱溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则样品中含铵盐
液体样品:
化肥的施用
过量施用:
污染空气、使水体富营养化、使土壤板结
不合理施用:
铵态氮肥与碱性物质混合使用会产生氨气,降低肥效
实验
粗盐中难溶性杂质的去除
实验突破
1.
实验用品
烧杯、玻璃棒、铁架台(带铁圈)、漏斗、滤纸、蒸发皿、酒精灯、药匙、量筒(10
mL)、托盘天平、砝码、坩埚钳、粗盐、剪刀、火柴。
2.实验装置(如图所示)
3.实验步骤和方法
(1)溶解:①称量粗盐;②加水溶解并___________
________,直到粗盐全部溶解为止。
(2)过滤:①做好过滤器,装配好仪器;②将粗盐水用玻璃棒_______到过滤器;③若滤液浑浊应再次过滤。
用玻璃棒不断搅拌
引流
(3)蒸发:①装配好仪器;②将过滤后的澄清液倒入蒸发皿中,边加热边_______________,当有较多晶体出现时停止加热,利用余热将其蒸干。
(4)计算产率:①把蒸发皿中的晶体移到纸上称量;②将提纯的精盐放到指定容器中;
③产率
=
×100%。
用玻璃棒搅拌
4.
实验步骤中玻璃棒的作用
(1)溶解时,用玻璃棒搅拌,___________;
(2)过滤时,用玻璃棒引流,_______________________;
(3)蒸发时,用玻璃棒搅拌,_______________________
(4)除杂后,用玻璃棒转移固体。
防止局部温度过高造成液体飞溅
加速溶解
防止液体外溅或冲破滤纸
5.
注意事项
(1)溶解时需注意:
①粗盐一次不宜加得太多,以免不能全部溶解;
②溶解搅拌时,玻璃棒尽量不要碰触烧杯壁和烧杯底。
(2)蒸发时需注意:
①蒸发皿应放在铁圈上,停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台;
②当蒸发皿中出现较多固体时,则停止加热,利用余热将滤液蒸干。
6.分析实验可能出现误差的原因
(1)粗盐的两次称量数据不准确。
(2)对粗盐的溶解程度判断不准确。
(3)导致实验结果偏小的原因。
解读:实验操作不当会对实验结果造成一定的影响,其中导致实验结果偏小的原因有:①溶解搅拌时液滴溅出;②蒸发时液滴飞溅;③转移时有部分精盐沾在蒸发皿上。
1.(2014重庆A
13题2分)某矿物质水标签上的部分内容
如图所示,若要检验其中含MgSO4,需要的试剂之一是
(
)
A.稀硫酸
B.AgNO3溶液
C.BaCl2溶液
D.金属镁
命题点1
(必考)
生活中常见的盐
中考真题再现
第1题图
命题点2
粗盐中难溶性杂质的去除
1.
(2013重庆B
22题6分)如图是氯化钠溶液的配制和粗盐中难溶性杂质的去除(需要计算粗盐的产率)实验活动中的部分操作。
第1题图
(1)仪器a的名称是
。
(2)配制6%的氯化钠溶液和粗盐中难溶性杂质的去除都要用到的实验操作是
(填序号)。
(3)A中玻璃棒搅拌的作用是使氯化钠
。如果B中的滤液仍然浑浊,就应该
。D操作中,当观察到蒸发皿中出现
时,停止加热。
漏斗
AC
加速溶解
再过滤一次
较多固体
命题点3
化肥
1.
(2015重庆A
6题2分)农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是
(
)
A.
NH4NO3
B.
Ca(H2PO4)2
C.(NH4)2HPO4
D.
KNO3
2.
(2013重庆
A
2题2分)缺磷小麦生长缓慢,为了促进其生长,应该施用的化肥是
(
)
A.
CO(NH2)2
B.
K2SO4
C.
NH4HCO3
D.
Ca(H2PO4)2
【解析】尿素、碳酸氢铵含氮元素,属于氮肥;硫酸钾含钾元素,属于钾肥;磷酸二氢钙含磷元素,属于磷肥。
D
重难点突破
酸碱盐之间的转化
例(2015河南)A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去)。则化学方程式:
CO2+Ca(OH)2
CaCO3↓+H2O
[或Ca(OH)2+Na2CO3
CaCO3↓+2NaOH等]
①为_________________________________
__________________________________________;
②为_____________________________。A在生产或生活中的一种用途是_________________________
__________。
Fe2O3+6HCl
2FeCl3+3H2O
改良酸性土壤(或作建筑材料等)
如何判断复分解反应能否发生
首先要考虑反应物的溶解性,即“两溶酸不管”,两种参与复分解反应的化合物必须都能溶于水,只有当反应物中有酸时,才可以不考虑另一反应物的可溶性。
其次,要考虑复分解反应发生的条件,生成物中必须有沉淀、气体或水,否则不能发生。
例
:现有一含有多种溶质的无色溶液,关于该溶液中所含溶质有以下几种猜测,其中合理的是
(
)
A.
H2SO4、NaOH、NaCl
B.
KNO3、NaCl、CuSO4
C.
AgNO3、NaCl、HCl
D.
H2SO4、Na2SO4、KNO3
(1)粗盐提纯的顺序是____________(填序号)。
(2)粗盐提纯的步骤中,错误的操作是_____(填序号)。
(3)步骤③中,当蒸发皿中________________时,停止加热。
(4)步骤④中得到的滤液仍然浑浊,可能的原因是___________(写出一条即可)。
①②④③
④
有较多固体析出
滤纸破损
例
下列是有关粗盐提纯的实验,请回答下列问题:
(5)下列物质分离的方法和粗盐提纯的方法相同的是
______(填序号)。
A.
从铁、铜的混合粉末中提纯铁
B.
除去氢氧化钠溶液中的少量碳酸钠
C.
从硝酸钾和碳酸钙的混合粉末中提纯硝酸钾
D.
除去一氧化碳中的二氧化碳
C
(6)操作②、③、④中玻璃棒的作用分别是
______
_________、_________________________________、_______。
(7)若产率偏低,则原因可能是___________;产量
偏高,则原因可能是____________。
搅拌,
加速溶解
搅拌,使加热均匀,防止液滴飞溅
引流
液滴溅出等
滤纸破损等
盐
化肥
常见的盐
常见的盐
及其性质
常见的盐及其用途
粗盐中难溶性杂质的去除
常见盐的化学性质
(“盐四条”)
概念:组成里含有金属离子(或铵根
离子)和酸根离子的化合物
常见的盐及其用途
氯化钠
俗称(或
主要成分)
食盐
性质
有咸味的白色固体,易溶于水,水溶液呈中性
用途
可作
、防腐剂、医用生理盐水、
农业选种等
特殊化学
性质
AgNO3+NaCl
AgCl↓+NaNO3
调味剂
常见的盐及其用途
碳酸钠
俗称(或
主要成分)
_______、苏打
性质
白色固体,易溶于水,水溶液呈碱性
用途
用于生产玻璃、洗涤剂、造纸、纺织等工业
特殊化学
性质
热稳定性强,能使无色酚酞溶液变⑥____
纯碱
红
常见的盐及其用途
碳酸氢钠
俗称(或
主要成分)
_______
性质
白色固体,易溶于水,水溶液呈弱碱性,加热易分解
用途
可作发酵粉,
,治疗胃酸过多症
特殊化学
性质
2NaHCO3
Na2CO3+CO2↑+H2O
△
小苏打
制汽水
常见的盐及其用途
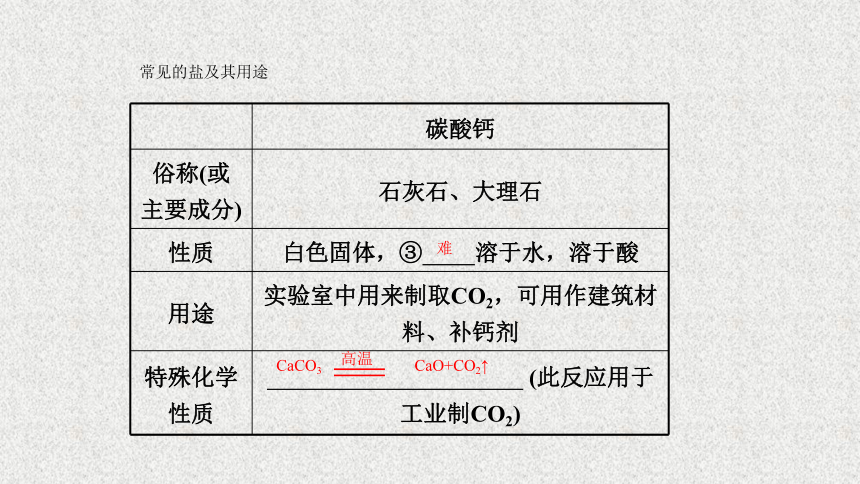
碳酸钙
俗称(或
主要成分)
石灰石、大理石
性质
白色固体,③
溶于水,溶于酸
用途
实验室中用来制取CO2,可用作建筑材料、补钙剂
特殊化学
性质
(此反应用于工业制CO2)
难
CaCO3
CaO+CO2↑
高温
常见盐的
化学性质
(“盐四条”)
(高频)
与某些金属反应
(置换反应)
与酸反应
与碱反应
与某些盐反应
与某些金属反应(置换反应)
规律:金属+盐→新金属+新盐
举例:CuSO4+Fe
________
FeSO4+Cu
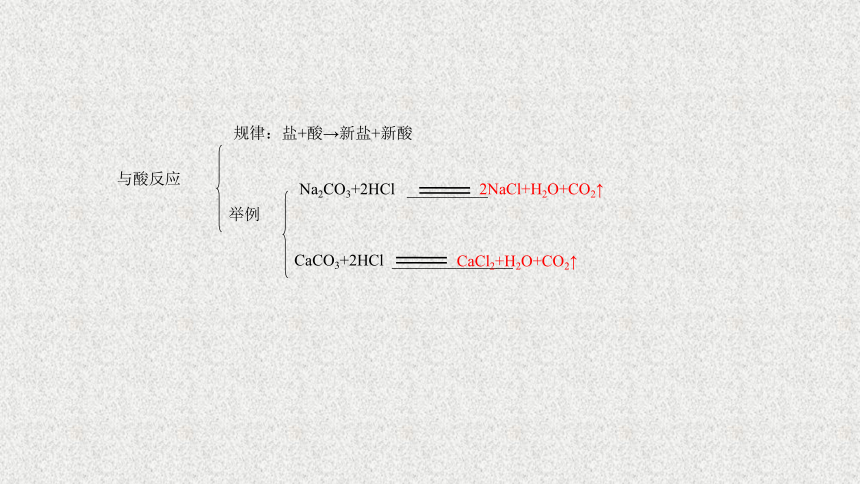
与酸反应
规律:盐+酸→新盐+新酸
举例
Na2CO3+2HCl
__________
2NaCl+H2O+CO2↑
CaCO3+2HCl
_______________
CaCl2+H2O+CO2↑
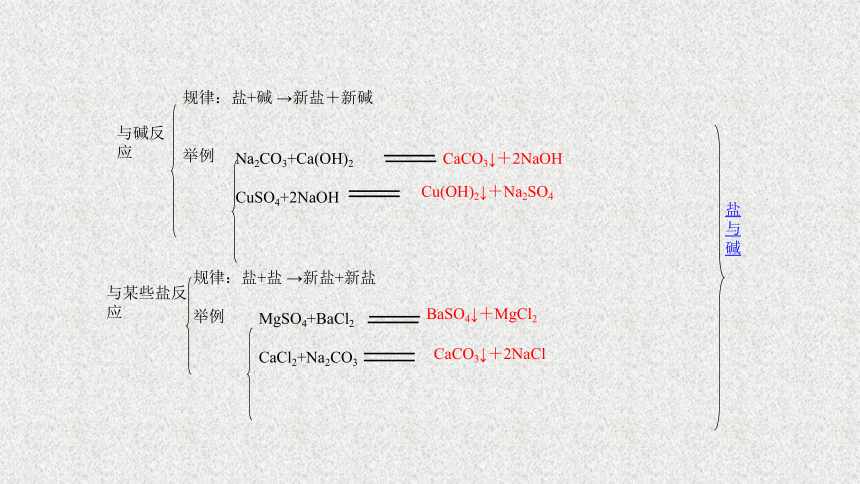
与碱反应
规律:盐+碱
→新盐+新碱
举例
Na2CO3+Ca(OH)2
CuSO4+2NaOH
CaCO3↓+2NaOH
Cu(OH)2↓+Na2SO4
与某些盐反应
规律:盐+盐
→新盐+新盐
举例
MgSO4+BaCl2
CaCl2+Na2CO3
BaSO4↓+MgCl2
CaCO3↓+2NaCl
盐与碱
盐与碱、盐反应的条件:反应物均溶于水,生成物中有沉淀、气体或水
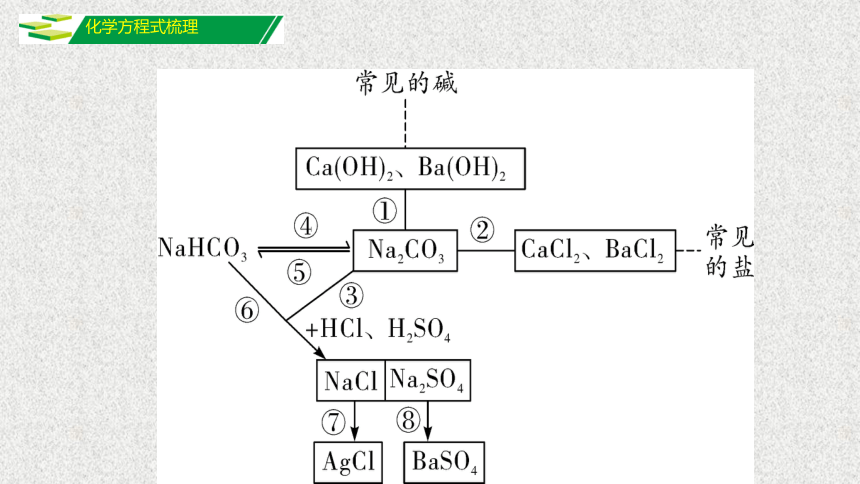
化学方程式梳理
①________________________________________、
________________________________________
;
②_____________________________________、
_____________________________________;
Ca(OH)2+Na2CO3
CaCO3↓+2NaOH
Ba(OH)2+Na2CO3
BaCO3↓+2NaOH
Na2CO3+CaCl2
CaCO3↓+2NaCl
Na2CO3+BaCl2
BaCO3↓+2NaCl
③_______________________________________、
________________________________________
;
④_____________________________________;
⑤______________________________________;
Na2CO3+2HCl
2NaCl+CO2↑+H2O
Na2CO3+H2SO4
Na2SO4+CO2↑+H2O
2NaHCO3
Na2CO3+H2O+CO2↑
△
Na2CO3+CO2+H2O
2NaHCO3
⑥______________________________________、
____________________________________________
;
⑦___________________________________;
⑧__________________________________。
NaHCO3+HCl
NaCl+CO2↑+H2O
2NaHCO3+H2SO4
Na2SO4+2CO2↑+2H2O
NaCl+AgNO3
AgCl↓+NaNO3
Na2SO4+BaCl2
2NaCl+BaSO4↓
化肥
化肥的种类
化肥的鉴别
化肥的施用
种类
概念
常见化肥
作用
氮肥
只含营养元素(氮、磷、钾)中
_______
的化肥
尿素[CO(NH2)2],
_______
(NH3·H2O)、氯化铵(NH4Cl)、硝酸铵(NH4NO3)、碳酸氢铵(NH4HCO3)
促进植物的茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量
磷肥
只含营养元素(氮、磷、钾)中
_______的化肥
__________、钙镁磷肥、过磷酸钙
促进作物生长,增强作物抗寒、抗旱能力
氮元素
氨水
磷元素
磷矿粉
化肥的种类
种类
概念
常见化肥
作用
钾肥
只含营养元素(氮、磷、钾)中
_______
的化肥
硫酸钾(K2SO4)
_______(KCl)
促进植物生长、增强抗病虫害
和抗倒伏能力
等功能
复合肥
含营养元素(氮、磷、钾)中两种或两
种以上元素
的化肥
_______
(KNO3)、磷酸二氢铵(NH4H2PO4)
均匀地供给作物几种养分,充分发挥营养元素间的相互作用,有效成分高
钾元素
氯化钾
硝酸钾
化肥的种类
化肥的鉴别
磷矿粉为灰白色固体,不同于其他种类的化肥,可作为判断磷矿粉的依据
铵态氮肥的检验
铵态氮肥的检验
取样于研钵中,加入熟石灰,研磨,若产生刺激性气味的气体,则样品中含铵盐
固体样品:
取样于试管中,加入碱溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则样品中含铵盐
液体样品:
化肥的施用
过量施用:
污染空气、使水体富营养化、使土壤板结
不合理施用:
铵态氮肥与碱性物质混合使用会产生氨气,降低肥效
实验
粗盐中难溶性杂质的去除
实验突破
1.
实验用品
烧杯、玻璃棒、铁架台(带铁圈)、漏斗、滤纸、蒸发皿、酒精灯、药匙、量筒(10
mL)、托盘天平、砝码、坩埚钳、粗盐、剪刀、火柴。
2.实验装置(如图所示)
3.实验步骤和方法
(1)溶解:①称量粗盐;②加水溶解并___________
________,直到粗盐全部溶解为止。
(2)过滤:①做好过滤器,装配好仪器;②将粗盐水用玻璃棒_______到过滤器;③若滤液浑浊应再次过滤。
用玻璃棒不断搅拌
引流
(3)蒸发:①装配好仪器;②将过滤后的澄清液倒入蒸发皿中,边加热边_______________,当有较多晶体出现时停止加热,利用余热将其蒸干。
(4)计算产率:①把蒸发皿中的晶体移到纸上称量;②将提纯的精盐放到指定容器中;
③产率
=
×100%。
用玻璃棒搅拌
4.
实验步骤中玻璃棒的作用
(1)溶解时,用玻璃棒搅拌,___________;
(2)过滤时,用玻璃棒引流,_______________________;
(3)蒸发时,用玻璃棒搅拌,_______________________
(4)除杂后,用玻璃棒转移固体。
防止局部温度过高造成液体飞溅
加速溶解
防止液体外溅或冲破滤纸
5.
注意事项
(1)溶解时需注意:
①粗盐一次不宜加得太多,以免不能全部溶解;
②溶解搅拌时,玻璃棒尽量不要碰触烧杯壁和烧杯底。
(2)蒸发时需注意:
①蒸发皿应放在铁圈上,停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台;
②当蒸发皿中出现较多固体时,则停止加热,利用余热将滤液蒸干。
6.分析实验可能出现误差的原因
(1)粗盐的两次称量数据不准确。
(2)对粗盐的溶解程度判断不准确。
(3)导致实验结果偏小的原因。
解读:实验操作不当会对实验结果造成一定的影响,其中导致实验结果偏小的原因有:①溶解搅拌时液滴溅出;②蒸发时液滴飞溅;③转移时有部分精盐沾在蒸发皿上。
1.(2014重庆A
13题2分)某矿物质水标签上的部分内容
如图所示,若要检验其中含MgSO4,需要的试剂之一是
(
)
A.稀硫酸
B.AgNO3溶液
C.BaCl2溶液
D.金属镁
命题点1
(必考)
生活中常见的盐
中考真题再现
第1题图
命题点2
粗盐中难溶性杂质的去除
1.
(2013重庆B
22题6分)如图是氯化钠溶液的配制和粗盐中难溶性杂质的去除(需要计算粗盐的产率)实验活动中的部分操作。
第1题图
(1)仪器a的名称是
。
(2)配制6%的氯化钠溶液和粗盐中难溶性杂质的去除都要用到的实验操作是
(填序号)。
(3)A中玻璃棒搅拌的作用是使氯化钠
。如果B中的滤液仍然浑浊,就应该
。D操作中,当观察到蒸发皿中出现
时,停止加热。
漏斗
AC
加速溶解
再过滤一次
较多固体
命题点3
化肥
1.
(2015重庆A
6题2分)农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是
(
)
A.
NH4NO3
B.
Ca(H2PO4)2
C.(NH4)2HPO4
D.
KNO3
2.
(2013重庆
A
2题2分)缺磷小麦生长缓慢,为了促进其生长,应该施用的化肥是
(
)
A.
CO(NH2)2
B.
K2SO4
C.
NH4HCO3
D.
Ca(H2PO4)2
【解析】尿素、碳酸氢铵含氮元素,属于氮肥;硫酸钾含钾元素,属于钾肥;磷酸二氢钙含磷元素,属于磷肥。
D
重难点突破
酸碱盐之间的转化
例(2015河南)A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去)。则化学方程式:
CO2+Ca(OH)2
CaCO3↓+H2O
[或Ca(OH)2+Na2CO3
CaCO3↓+2NaOH等]
①为_________________________________
__________________________________________;
②为_____________________________。A在生产或生活中的一种用途是_________________________
__________。
Fe2O3+6HCl
2FeCl3+3H2O
改良酸性土壤(或作建筑材料等)
如何判断复分解反应能否发生
首先要考虑反应物的溶解性,即“两溶酸不管”,两种参与复分解反应的化合物必须都能溶于水,只有当反应物中有酸时,才可以不考虑另一反应物的可溶性。
其次,要考虑复分解反应发生的条件,生成物中必须有沉淀、气体或水,否则不能发生。
例
:现有一含有多种溶质的无色溶液,关于该溶液中所含溶质有以下几种猜测,其中合理的是
(
)
A.
H2SO4、NaOH、NaCl
B.
KNO3、NaCl、CuSO4
C.
AgNO3、NaCl、HCl
D.
H2SO4、Na2SO4、KNO3
(1)粗盐提纯的顺序是____________(填序号)。
(2)粗盐提纯的步骤中,错误的操作是_____(填序号)。
(3)步骤③中,当蒸发皿中________________时,停止加热。
(4)步骤④中得到的滤液仍然浑浊,可能的原因是___________(写出一条即可)。
①②④③
④
有较多固体析出
滤纸破损
例
下列是有关粗盐提纯的实验,请回答下列问题:
(5)下列物质分离的方法和粗盐提纯的方法相同的是
______(填序号)。
A.
从铁、铜的混合粉末中提纯铁
B.
除去氢氧化钠溶液中的少量碳酸钠
C.
从硝酸钾和碳酸钙的混合粉末中提纯硝酸钾
D.
除去一氧化碳中的二氧化碳
C
(6)操作②、③、④中玻璃棒的作用分别是
______
_________、_________________________________、_______。
(7)若产率偏低,则原因可能是___________;产量
偏高,则原因可能是____________。
搅拌,
加速溶解
搅拌,使加热均匀,防止液滴飞溅
引流
液滴溅出等
滤纸破损等
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
