2020-2021学年高一下学期化学人教版必修二 2.1 化学能与热能 课件(54张ppt)
文档属性
| 名称 | 2020-2021学年高一下学期化学人教版必修二 2.1 化学能与热能 课件(54张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-11 15:21:24 | ||
图片预览








文档简介
(共54张PPT)
第二章化学反应与能量
第一节
化学能与热能
(第一课时)
能源与人类
能源与材料、信息一起被称为现代社会发展的三大支柱。能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。
16.6%
2.1%
5.1%
76.2%
我国化石燃料和水电能源消耗构成图
化石燃料的燃烧产生能量是从哪里来的呢?
课前知识储备
质量守恒定律
能量守恒定律
化学反应中的能量变化,通常主要表现为热量的变化。
物质本身的能量越高,就越不稳定;
物质本身的能量越低,则越稳定。
从物质本身包含能量的角度看:
反应物总能量>生成物总能量
反应放出能量
E反
E生
反应物总能量<生成物总能量
反应吸收能量
E反
E生
1、从总能量的角度(宏观)分析
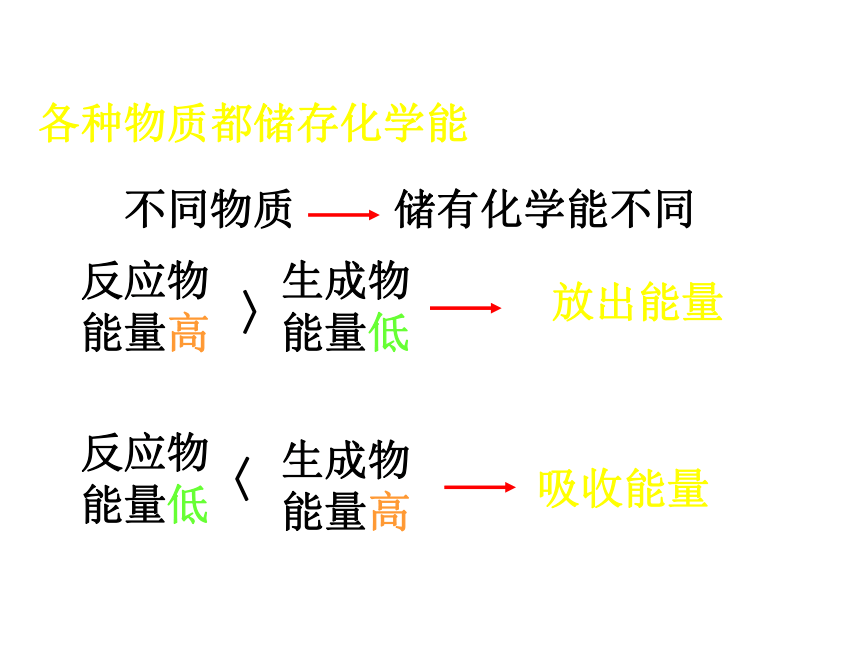
各种物质都储存化学能
不同物质
储有化学能不同
反应物能量高
生成物能量高
生成物能量低
反应物能量低
〉
〈
放出能量
吸收能量
放热反应
吸热反应
能量变化
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
图示
则?H=H2-H2﹥0反应吸热
生成物总能量H2
H
t
则?H=H2-H2<0反应放热
反应物总能量H1
H
t
反应物总能量H1
生成物总能量H2
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放热反应
吸热反应
一个化学反应是吸收能量还是放出热量,决定于反应物的总能量与生成物的总能量的相对大小。
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
小结:
2、从微观的角度理解能量变化
化学反应过程,本质上就是旧化学键的断裂和新化学键的形成过程。(练习册30页)
⑴、化学反应的本质是什么?
2H
·
··
2·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
2、化学键与化学反应中能量变化关系
形成1mol化学键时释放的能量或断开1mol化学键所吸收的能量叫做键能
化学键的断裂和形成是化学反应中能量变化的主要原因
分子或化合物里的原子之间是通过化学键相结合的,而化学键是与能量联系在一起的。
从化学键的观点来分析能量的变化
一个化学反应的的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的热量与所有
形成新键放出的热量的相对大小
断键吸热
成键放热
实验测得,在25℃,101KPa条件下,将1molH2(H-H)变为2molH原子需吸收436kJ能量,而2molH原子变成1molH2(H-H)放出436kJ能量,这个能量就是H-H的键能。
某些化学键的键能
某些键的键能(kJ/mol)
键
键能
键
键能
H-H
436
C-H
415.0
Cl-Cl
243
O-H
462.8
Br-Br
193.7
N-H
390.8
I-I
152.7
H-Cl
431
C-C
347.7
H-I
298.7
键能越大
含该键的分子越稳定
化学键越牢固
H2(g)+
Cl2(g)=
2HCl(g)反应的能量变化示意图
反应中为什么会有能量的变化?
微观:断键,成键作用
宏观:能量守恒作用
一个简单的计算:
在25℃和101kPa的条件下,
即:由1mol的H2和1mol的Cl2,会释放出
2
×
431kJ-436kJ-243kJ=183kJ
H2
+
Cl2
2HCl
kJ
Cl
-
Cl
Cl
+
Cl
吸收243kJ/mo
H-H
H
+
H
吸收436kJ/mol
放出183
H
+
F
H-F
放出431kJ/mol
例如
[小结]
2.
化学键断裂会
,
化学键形成要
。
1.
各种物质储存了
。
4.
化学反应过程是旧化学键
和新
化学键
,并伴随能量变化。
3.
没有既不吸热也不放热的化学反应。
5.
反应是吸热还是放热,取决于
。
化学能
释放能量
吸收能量
断裂
形成
反应物的总能量与生成物的总能量的相对大小。
第二章化学反应与能量
第一节
化学能与热能
(第二课时)
昭苏县高级中学:苏静春
H2(g)+
Cl2(g)=
2HCl(g)
总能量角度(宏观)
键能角度(微观)
H2+Cl2
2HCl
679KJ
862KJ
H
E
想搞清,先看练习册42页第8题前2小题
反应热=H生
-
H反
反应热=E反
-
E生
反应物键能大——生成物键能小——吸多放少
键能与能量之间的相互关系
反应物能量低——生成物能量高——能量守恒
吸热反应
反应物能量高——生成物能量低——能量守恒
反应物键能小——生成物键能大——吸少放多
放热反应
9.已知31g白磷(P4)变为31g红磷(P)时释放能量.请回答下列问题:
(1)上述变化属于
(填“物理”或“化学”)变化.
(2)31g白磷具有的能量
(填“>”或“<”,下同)31g红磷具有的能量.
(3)已知白磷和红磷燃烧均生成P2O5.
31g白磷完全燃烧释放出的能量
31g红磷完全燃烧释放的能量.
练习册41页第9题
14.已知:
该合成氨反应的反应热为( )
A.吸收92
kJ热量
B.放出92
kJ热量
C.不吸热也不放热
D.放出1081kJ热量
判断:
1.化学反应过程都伴随着能量的变化,伴随着能量变化的过程都是化学反应。
2.加热条件下进行的反应都是吸热反应,常温下进行的反应都是放热反应。
第二章化学反应与能量
第一节
化学能与热能
(第三课时)
昭苏县高级中学:苏静春
(1)宏观:化学反应中,化学反应中能量变化主要取决于反应物的总能量和生成物的总能量的相对大小。
(2)微观:化学键的断裂和形成是化学反应中能量变化的主要原因。
断键吸收总能量
<成键放出总能量
断键吸收总能量
>
成键放出总能量
反应物的总能量
>生成物的总能量
反应物的总能量
<生成物的总能量
反应放出能量
反应吸收能量
1、化学反应中能量变化原因
知识回顾
反应物键能大——生成物键能小——吸多放少
键能与能量之间的相互关系
反应物能量低——生成物能量高——能量守恒
吸热反应
反应物能量高——生成物能量低——能量守恒
反应物键能小——生成物键能大——吸少放多
放热反应
清楚几个概念:
1.化学反应过程都伴随着能量的变化,伴随着能量变化的过程不一定是化学反应。
2.反应是放热还是吸热和反应条件和环境没有绝对关系,与反应物和生成物的总能量的相对大小有关。
3.没有既不吸热也不放热的化学反应。
常见的放热反应和吸热反应
放热反应
燃料的燃烧和物质的氧化
酸碱中和反应
金属与酸或与水的反应
大部分化合反应
铝热反应
吸热反应
Ba(OH)2·8H2O+NH4Cl
以C、H2、co为还原剂的反应
大部分分解反应
实例:
①铝与盐酸反应
现象:铝条表面有_____________产生,反应后温度_______。
结论:反应过程中
________热量。
②木炭、硫磺等可燃物的燃烧均放热(化合)
无色气体
升高
放出
放热反应
③
:酸与碱的中和反应
反应物及其用量
酸
HCl
20mL
1mol/L
HNO3
20mL
1mol/L
碱
NaOH
20mL1mol/L
KOH
20mL1mol/L
混合前温度
室温
室温
混合后温度
结
论
归纳与概括
HCl与NaOH发生中和反应时放热。
HNO3与KOH发生中和反应时放热。
强酸和强碱发生反应时放出热量。
放热反应
放热反应
思考与交流
测量中和反应热应该注意哪些问题?
1、保温隔热的效果一定要好。
2、酸碱浓度要准确。
3、温度计要读准,水银球要全浸在
4、实验操作时动作要快,以尽量
溶液中,且要稳定一段时间再读。
减少热量的散失。
放热反应
中和热:
是指酸碱中和反应生成
1mol
H2O(液态)所释放的热量,即放出热量为57.3kJ
放热反应
④、铝热反应
2Al+Fe2O3==高温==2Fe+Al?O?
用途
1、冶炼难熔的金属
2、焊接钢轨等大截面钢材部件
3、军事上可以制作铝热弹等强杀伤性的武器,还可以用作破坏敌军器材
4、传统的烟火剂
放热反应
整个实验中有哪些创新之处?
Ba(OH)2·8H2O与NH4Cl反应现象:
吸热反应
实验记录:
实验步骤
实验现象
得出结论
将晶体混合后立即用玻璃棒快速搅拌混合物
有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝
有NH3气生成
用手触摸烧杯下部
感觉烧杯变凉
反应吸热
用手拿起烧杯
烧杯下面的带有几滴水的玻璃片(或小木板)粘到了烧杯底部
反应吸收热量使体系温度降低,使水结成冰
将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起
玻璃片脱离上面烧杯底部
冰融化
反应完后移走烧杯上的多孔塑料片,观察反应物
混合物成糊状
有水生成
用化学方程式表示上述反应:
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
吸热反应
【小结】化学能与热能相互转化的应用
(1)化学物质中的化学能通过反应转化成热能,是人类生存和发展的动力之源。
(2)热能转化成化学能是人们进行化学科学研究,研制新物质不可缺少的条件和途径。
(3)不能根据反应条件来判断一个反应是放热还是吸热。
(4)物质溶解稀释过程不是放热或吸热反应,为物理过程,非化学反应。
科学视野:生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧
本质相同,都是放热反应。只是二者条件
不同,且前者更加合理有效。
人体内发生的氧化还原反应与体外的燃烧有何相同点和不同点?
阅读教材:
【科学视野】
人类利用能源的三个阶段
1、柴草时期:以树枝杂草为主要能源
2、化石能源时期:以煤、石油、天然气为主要能源
3、多能源结构时期:可再生能源、清洁能源
煤、石油和天然气等是世界上最重要的三种化石燃料。
煤,也叫煤炭,是世界上最古老的化石燃料之一,被称为“工业的粮食”。
石油被人们誉为“工业的血液”。石油不仅是重要的化石燃料,还是宝贵的工业原料。
天然气一般是指在底下形成的可燃性气体。天然气主要成分是甲烷。
核能
英国的原子能发电站
太阳能
太阳能电池实质上是一种半导体器件,它的典型特征是可以把光能直接转换成电能。其工作原理是,当太阳光照射到硅电池板后,产生光生电子--空穴对,在电池内建静电场的作用下,由于电子、空穴分带不同的电荷而被分离在两边形成“光生电压”,即“光电效应”。
太阳能
太阳能发电装置
太阳能
太阳能汽车
太阳能
太阳能发电站
风能
其他新能源
其他新能源
阿里地区地热田
其他新能源
羊八井地热电站
其他新能源
江厦潮汐试验电站
谢谢聆听!
第二章化学反应与能量
第一节
化学能与热能
(第一课时)
能源与人类
能源与材料、信息一起被称为现代社会发展的三大支柱。能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。
16.6%
2.1%
5.1%
76.2%
我国化石燃料和水电能源消耗构成图
化石燃料的燃烧产生能量是从哪里来的呢?
课前知识储备
质量守恒定律
能量守恒定律
化学反应中的能量变化,通常主要表现为热量的变化。
物质本身的能量越高,就越不稳定;
物质本身的能量越低,则越稳定。
从物质本身包含能量的角度看:
反应物总能量>生成物总能量
反应放出能量
E反
E生
反应物总能量<生成物总能量
反应吸收能量
E反
E生
1、从总能量的角度(宏观)分析
各种物质都储存化学能
不同物质
储有化学能不同
反应物能量高
生成物能量高
生成物能量低
反应物能量低
〉
〈
放出能量
吸收能量
放热反应
吸热反应
能量变化
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
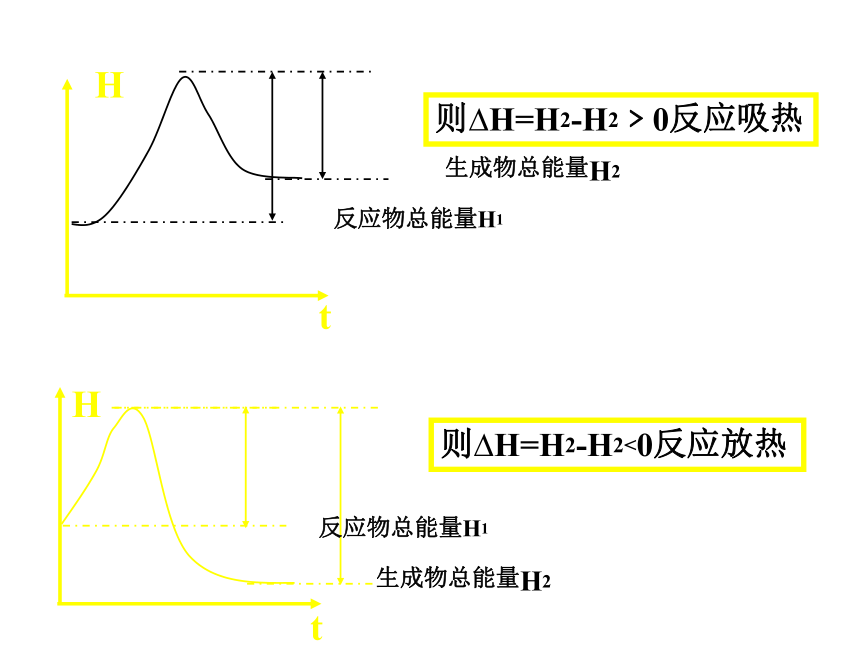
图示
则?H=H2-H2﹥0反应吸热
生成物总能量H2
H
t
则?H=H2-H2<0反应放热
反应物总能量H1
H
t
反应物总能量H1
生成物总能量H2
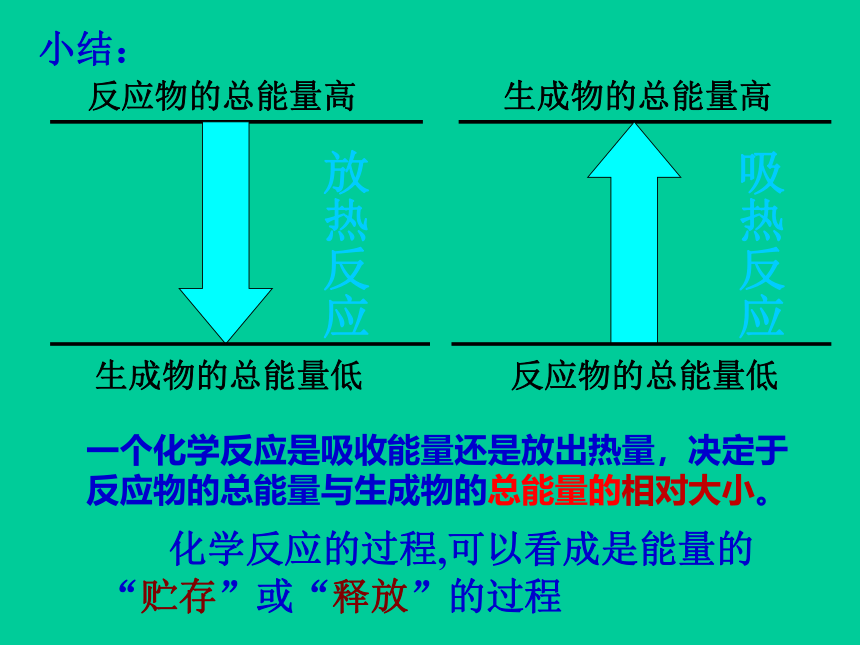
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放热反应
吸热反应
一个化学反应是吸收能量还是放出热量,决定于反应物的总能量与生成物的总能量的相对大小。
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
小结:
2、从微观的角度理解能量变化
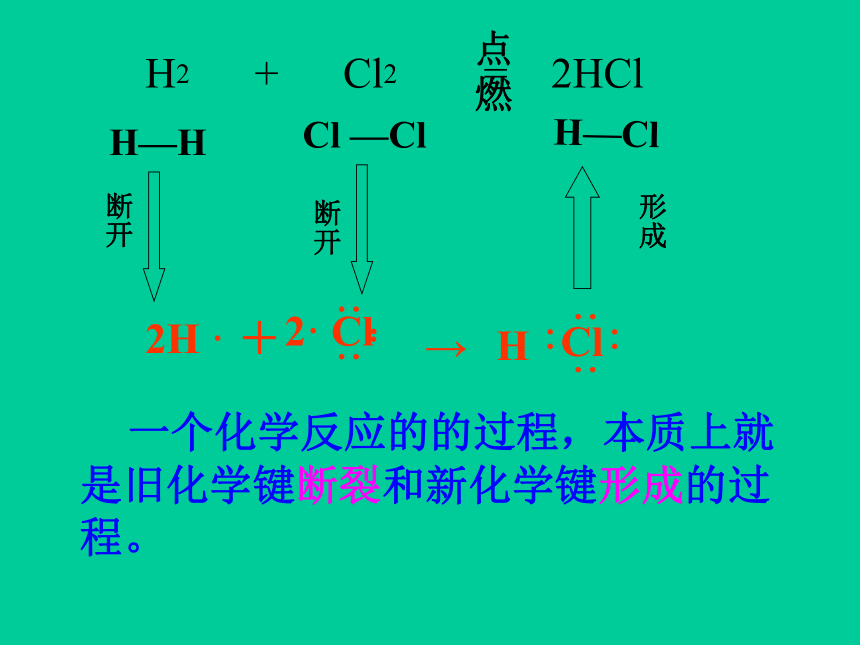
化学反应过程,本质上就是旧化学键的断裂和新化学键的形成过程。(练习册30页)
⑴、化学反应的本质是什么?
2H
·
··
2·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
2、化学键与化学反应中能量变化关系
形成1mol化学键时释放的能量或断开1mol化学键所吸收的能量叫做键能
化学键的断裂和形成是化学反应中能量变化的主要原因
分子或化合物里的原子之间是通过化学键相结合的,而化学键是与能量联系在一起的。
从化学键的观点来分析能量的变化
一个化学反应的的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的热量与所有
形成新键放出的热量的相对大小
断键吸热
成键放热
实验测得,在25℃,101KPa条件下,将1molH2(H-H)变为2molH原子需吸收436kJ能量,而2molH原子变成1molH2(H-H)放出436kJ能量,这个能量就是H-H的键能。
某些化学键的键能
某些键的键能(kJ/mol)
键
键能
键
键能
H-H
436
C-H
415.0
Cl-Cl
243
O-H
462.8
Br-Br
193.7
N-H
390.8
I-I
152.7
H-Cl
431
C-C
347.7
H-I
298.7
键能越大
含该键的分子越稳定
化学键越牢固
H2(g)+
Cl2(g)=
2HCl(g)反应的能量变化示意图
反应中为什么会有能量的变化?
微观:断键,成键作用
宏观:能量守恒作用
一个简单的计算:
在25℃和101kPa的条件下,
即:由1mol的H2和1mol的Cl2,会释放出
2
×
431kJ-436kJ-243kJ=183kJ
H2
+
Cl2
2HCl
kJ
Cl
-
Cl
Cl
+
Cl
吸收243kJ/mo
H-H
H
+
H
吸收436kJ/mol
放出183
H
+
F
H-F
放出431kJ/mol
例如
[小结]
2.
化学键断裂会
,
化学键形成要
。
1.
各种物质储存了
。
4.
化学反应过程是旧化学键
和新
化学键
,并伴随能量变化。
3.
没有既不吸热也不放热的化学反应。
5.
反应是吸热还是放热,取决于
。
化学能
释放能量
吸收能量
断裂
形成
反应物的总能量与生成物的总能量的相对大小。
第二章化学反应与能量
第一节
化学能与热能
(第二课时)
昭苏县高级中学:苏静春
H2(g)+
Cl2(g)=
2HCl(g)
总能量角度(宏观)
键能角度(微观)
H2+Cl2
2HCl
679KJ
862KJ
H
E
想搞清,先看练习册42页第8题前2小题
反应热=H生
-
H反
反应热=E反
-
E生
反应物键能大——生成物键能小——吸多放少
键能与能量之间的相互关系
反应物能量低——生成物能量高——能量守恒
吸热反应
反应物能量高——生成物能量低——能量守恒
反应物键能小——生成物键能大——吸少放多
放热反应
9.已知31g白磷(P4)变为31g红磷(P)时释放能量.请回答下列问题:
(1)上述变化属于
(填“物理”或“化学”)变化.
(2)31g白磷具有的能量
(填“>”或“<”,下同)31g红磷具有的能量.
(3)已知白磷和红磷燃烧均生成P2O5.
31g白磷完全燃烧释放出的能量
31g红磷完全燃烧释放的能量.
练习册41页第9题
14.已知:
该合成氨反应的反应热为( )
A.吸收92
kJ热量
B.放出92
kJ热量
C.不吸热也不放热
D.放出1081kJ热量
判断:
1.化学反应过程都伴随着能量的变化,伴随着能量变化的过程都是化学反应。
2.加热条件下进行的反应都是吸热反应,常温下进行的反应都是放热反应。
第二章化学反应与能量
第一节
化学能与热能
(第三课时)
昭苏县高级中学:苏静春
(1)宏观:化学反应中,化学反应中能量变化主要取决于反应物的总能量和生成物的总能量的相对大小。
(2)微观:化学键的断裂和形成是化学反应中能量变化的主要原因。
断键吸收总能量
<成键放出总能量
断键吸收总能量
>
成键放出总能量
反应物的总能量
>生成物的总能量
反应物的总能量
<生成物的总能量
反应放出能量
反应吸收能量
1、化学反应中能量变化原因
知识回顾
反应物键能大——生成物键能小——吸多放少
键能与能量之间的相互关系
反应物能量低——生成物能量高——能量守恒
吸热反应
反应物能量高——生成物能量低——能量守恒
反应物键能小——生成物键能大——吸少放多
放热反应
清楚几个概念:
1.化学反应过程都伴随着能量的变化,伴随着能量变化的过程不一定是化学反应。
2.反应是放热还是吸热和反应条件和环境没有绝对关系,与反应物和生成物的总能量的相对大小有关。
3.没有既不吸热也不放热的化学反应。
常见的放热反应和吸热反应
放热反应
燃料的燃烧和物质的氧化
酸碱中和反应
金属与酸或与水的反应
大部分化合反应
铝热反应
吸热反应
Ba(OH)2·8H2O+NH4Cl
以C、H2、co为还原剂的反应
大部分分解反应
实例:
①铝与盐酸反应
现象:铝条表面有_____________产生,反应后温度_______。
结论:反应过程中
________热量。
②木炭、硫磺等可燃物的燃烧均放热(化合)
无色气体
升高
放出
放热反应
③
:酸与碱的中和反应
反应物及其用量
酸
HCl
20mL
1mol/L
HNO3
20mL
1mol/L
碱
NaOH
20mL1mol/L
KOH
20mL1mol/L
混合前温度
室温
室温
混合后温度
结
论
归纳与概括
HCl与NaOH发生中和反应时放热。
HNO3与KOH发生中和反应时放热。
强酸和强碱发生反应时放出热量。
放热反应
放热反应
思考与交流
测量中和反应热应该注意哪些问题?
1、保温隔热的效果一定要好。
2、酸碱浓度要准确。
3、温度计要读准,水银球要全浸在
4、实验操作时动作要快,以尽量
溶液中,且要稳定一段时间再读。
减少热量的散失。
放热反应
中和热:
是指酸碱中和反应生成
1mol
H2O(液态)所释放的热量,即放出热量为57.3kJ
放热反应
④、铝热反应
2Al+Fe2O3==高温==2Fe+Al?O?
用途
1、冶炼难熔的金属
2、焊接钢轨等大截面钢材部件
3、军事上可以制作铝热弹等强杀伤性的武器,还可以用作破坏敌军器材
4、传统的烟火剂
放热反应
整个实验中有哪些创新之处?
Ba(OH)2·8H2O与NH4Cl反应现象:
吸热反应
实验记录:
实验步骤
实验现象
得出结论
将晶体混合后立即用玻璃棒快速搅拌混合物
有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝
有NH3气生成
用手触摸烧杯下部
感觉烧杯变凉
反应吸热
用手拿起烧杯
烧杯下面的带有几滴水的玻璃片(或小木板)粘到了烧杯底部
反应吸收热量使体系温度降低,使水结成冰
将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起
玻璃片脱离上面烧杯底部
冰融化
反应完后移走烧杯上的多孔塑料片,观察反应物
混合物成糊状
有水生成
用化学方程式表示上述反应:
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
吸热反应
【小结】化学能与热能相互转化的应用
(1)化学物质中的化学能通过反应转化成热能,是人类生存和发展的动力之源。
(2)热能转化成化学能是人们进行化学科学研究,研制新物质不可缺少的条件和途径。
(3)不能根据反应条件来判断一个反应是放热还是吸热。
(4)物质溶解稀释过程不是放热或吸热反应,为物理过程,非化学反应。
科学视野:生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧
本质相同,都是放热反应。只是二者条件
不同,且前者更加合理有效。
人体内发生的氧化还原反应与体外的燃烧有何相同点和不同点?
阅读教材:
【科学视野】
人类利用能源的三个阶段
1、柴草时期:以树枝杂草为主要能源
2、化石能源时期:以煤、石油、天然气为主要能源
3、多能源结构时期:可再生能源、清洁能源
煤、石油和天然气等是世界上最重要的三种化石燃料。
煤,也叫煤炭,是世界上最古老的化石燃料之一,被称为“工业的粮食”。
石油被人们誉为“工业的血液”。石油不仅是重要的化石燃料,还是宝贵的工业原料。
天然气一般是指在底下形成的可燃性气体。天然气主要成分是甲烷。
核能
英国的原子能发电站
太阳能
太阳能电池实质上是一种半导体器件,它的典型特征是可以把光能直接转换成电能。其工作原理是,当太阳光照射到硅电池板后,产生光生电子--空穴对,在电池内建静电场的作用下,由于电子、空穴分带不同的电荷而被分离在两边形成“光生电压”,即“光电效应”。
太阳能
太阳能发电装置
太阳能
太阳能汽车
太阳能
太阳能发电站
风能
其他新能源
其他新能源
阿里地区地热田
其他新能源
羊八井地热电站
其他新能源
江厦潮汐试验电站
谢谢聆听!
