2020-2021学年高中化学人教版必修二课件(76张ppt)-2.1 化学能与热能
文档属性
| 名称 | 2020-2021学年高中化学人教版必修二课件(76张ppt)-2.1 化学能与热能 |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-11 15:26:01 | ||
图片预览










文档简介
(共76张PPT)
化学能与热能
重难点:用盖斯定律进行有关反应热的简单计算。
【考纲要求】
1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化,了解吸热反应、放热反应、反
应热等概念。
3.了解热化学方程式的含义,能用盖斯定律进行有关反应热的简
单计算。
4.了解能源是人类生存和社会发展的重要基础,了解化学在解决
能源危机中的重要作用。
考点一
I
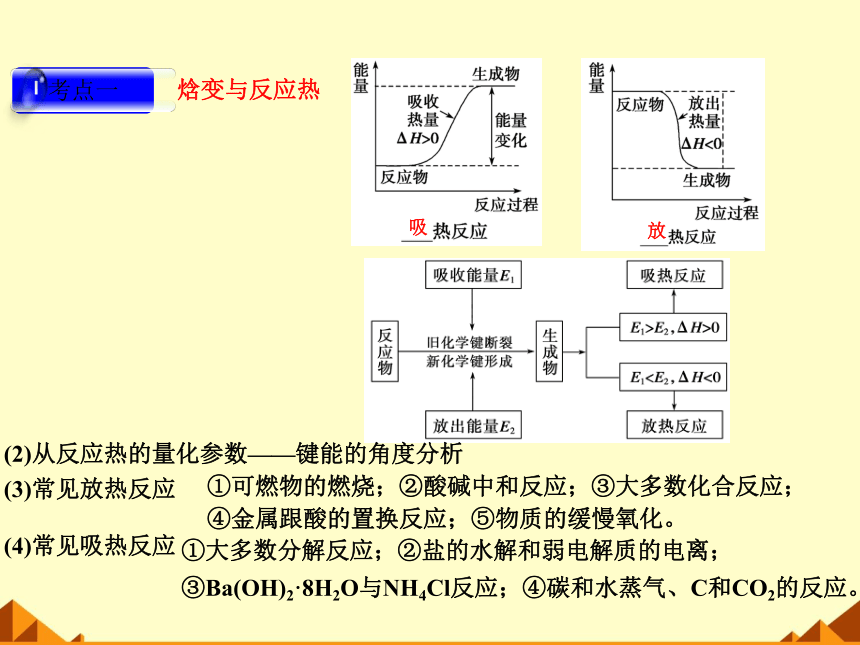
焓变与反应热
(3)化学反应中的能量转化形式:
、光能、电能等。通常主要表现
为
的变化。
1.化学反应中的能量变化
(1)化学反应中的两大变化:
变化和
变化。
(2)化学反应中的两大守恒:
守恒和
守恒。
或
。
2.焓变、反应热
在
条件下进行的反应的
。
。
(1)定义:
(2)符号:
(3)单位:
3.吸热反应和放热反应
物质
能量
质量
能量
热能
热量
恒压
热效应
ΔH
kJ·mol-1
kJ/mol
(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
①大多数分解反应;②盐的水解和弱电解质的电离;
③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应。
(2)从反应热的量化参数——键能的角度分析
(3)常见放热反应
①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;
④金属跟酸的置换反应;⑤物质的缓慢氧化。
(4)常见吸热反应
考点一
I
焓变与反应热
吸
放
1.同质量的硫粉在空气中燃烧和在纯氧中燃烧,哪一个放出的热量多,为什么?
答案 在空气中燃烧放出的热量多,因在纯氧中燃烧火焰明亮,转化成的光能多,故放出的热量少。
2.判断正误,正确的划“√”,错误的划“×”
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应
( )
(2)物质发生化学变化都伴有能量的变化
( )
(3)伴有能量变化的物质变化都是化学变化
( )
(4)吸热反应在任何条件都不能发生
( )
(5)Na转化为Na+时,吸收的能量就是该过程的反应热
( )
(6)水蒸气变为液态水时放出的能量就是该变化的反应热
( )
深度思考
深
度
思
考
×
√
×
×
×
×
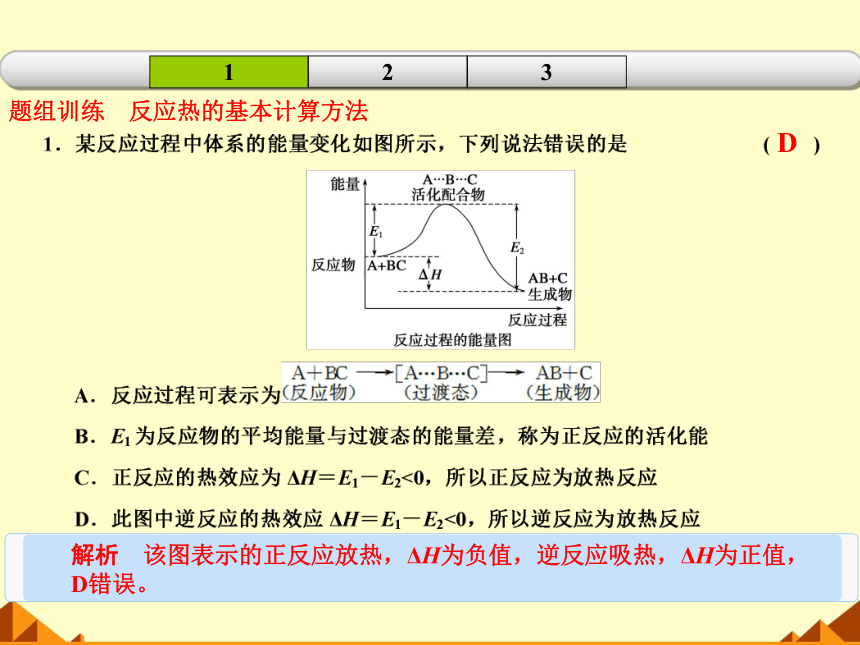
题组训练 反应热的基本计算方法
解析 该图表示的正反应放热,ΔH为负值,逆反应吸热,ΔH为正值,D错误。
D
1
2
3
-1
220
kJ·mol-1
1
2
3
题组训练 反应热的基本计算方法
+236
kJ·mol-1
1
2
3
题组训练 反应热的基本计算方法
1.熟记反应热ΔH的基本计算公式
ΔH=反应物的总键能之和-生成物的总键能之和
2.规避两个易失分点
(1)旧化学键的断裂和新化学键的形成是同时进行的,缺少任一个过程都不是化学变化。
(2)计算物质中键的个数时,不能忽略物质的结构,如1
mol晶体硅中含2
mol
Si—Si键。1
mol
SiO2中含4
mol
Si—O键。
ΔH=生成物的总能量-反应物的总能量
考点二
I
热化学方程式
表示参与化学反应的物质的
和
的关系的化学方程式。
1.概念
表明了化学反应中的
变化和
变化。
如:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6
kJ·mol-1
2.意义
表示:2
mol氢气和1
mol氧气反应生成2
mol液态水时放出571.6
kJ的热量。
(4)注意守恒关系:①原子守恒和得失电子守恒;
②能量守恒。(ΔH与化学计量数相对应)
3.书写
(1)注明反应条件:反应热与测定条件(温度、压强等)有关。绝大多数反应是在25
℃、101
kPa下进行的,可不注明。
(2)注明物质状态:常用
、
、
、
分别表示固体、液体、气体、溶液。
(3)注意符号单位:ΔH应包括“+”或“-”、数字和单位(kJ·mol-1)。
物质的量
反应热
物质
能量
s
l
g
aq
考点二
I
热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。且化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。
(5)区别于普通方程式:一般不注“↑”、“↓”以及“点燃”、“加热”等。
(6)注意热化学方程式的化学计量数
热化学方程式
深度思考
深
度
思
考
1.ΔH的单位“kJ·mol-1”的含义是什么?
2.怎样理解可逆反应中的反应热?
答案 无论化学反应是否可逆,热化学方程式中的反应热ΔH都表示反应进行到底(完全转化)时的能量变化。如2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64
kJ·mol-1,ΔH是指2
mol
SO2(g)和1
mol
O2(g)完全转化为2
mol
SO3(g)时放出的能量。若在相同的温度和压强下,向某容器中加入2
mol
SO2(g)和1
mol
O2(g),反应达到平衡时放出的能量为Q,因反应不能完全转化为SO3(g),故Q<196.64
kJ。
深度思考
深
度
思
考
知识梳理·题型构建
80%
题组一 热化学方程式的书写
N2(g)+2O2(g)===2NO2(g)
ΔH=+67.8
kJ·mol-1
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
ΔH=-1
427.2
kJ·mol-1
N2(g)+3H2(g)===2NH3(g) ΔH=-92
kJ·mol-1
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH=-2Q
kJ·mol-1
题组一
1
2
题组二
3
4
题组一 热化学方程式的书写
题组一
1
2
题组二
3
4
(3)N2
(g)+3H
2
(g)===2NH
3
(g) ΔH=(
946+436×3-391×6)
kJ·
mol-1=-92
kJ·mol-1。
(4)根据C原子守恒有:C2H5OH~2CO2~2CaCO3。生成100
g
CaCO3沉淀,则乙醇为0.5
mol,据此可写出反应的热化学方程式。
题组一 热化学方程式的书写
解析 由图可知,产物总能量低于反应物总能量,该反应是放热反应,ΔH=E1-E2=134
kJ·mol-1-368
kJ·mol-1=-234
kJ·mol-1。
NO2(g)+CO(g)===CO2(g)+NO(g)
ΔH=-234
kJ·mol-1
题组一
1
2
题组二
3
4
题组二 热化学方程式的判断
解析 写热化学方程式时要重点注意其与普通化学方程式不同的几点:(1)产物的稳定状态,H2O为液态,C的稳定化合物为CO2;(2)单位是kJ·mol-1,不是kJ;(3)数值,ΔH的数值要与方程式中计量系数保持一致;(4)符号,吸热用“+”,放热用“-”。仅②④符合要求。
B
题组一
1
2
题组二
3
4
题组二 热化学方程式的判断
B
解析 选项A中根据燃烧热的定义可知产物应是SO2;
题组一
1
2
题组二
3
4
选项C中热化学方程式没有标明各物质的聚集状态;
选项D中ΔH应为正值。
4.下列热化学方程式书写正确的是(ΔH的绝对值均正确)
( )
A.S(s)+O2(g)===SO3(g)
ΔH=-315
kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=-57.3
kJ·mol-1(中和热)
C.C2H5OH+3O2===2CO2+3H2O
ΔH=-1
368.8
kJ·mol-1(反应热)
D.2H2O(g)===2H2(g)+O2(g)
ΔH=-483.6
kJ·mol-1(反应热)
(5)看反应热的数值与化学计量数是否对应。
“五看”法判断热化学方程式的正误
(1)看方程式是否配平;
(2)看各物质的聚集状态是否正确;
(3)看ΔH的“+”、“-”符号是否正确;
(4)看反应热的单位是否为kJ·mol-1;
考点三
I
燃烧热和中和热
燃烧热的限定词有恒压(101
kPa时)、可燃物的物质的量(1
mol)、完全燃烧、
的氧化物等,其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C→
,H→
,S→
等。
1.燃烧热
(1)概念:
所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用
表示。
在101
kPa时,1
mol纯物质完全燃烧生成稳定的氧化物时
例如C的燃烧热为393.5
kJ·mol-1,表示在101
kPa时,1
mol
C完全燃烧放出393.5
kJ的热量。
(2)表示的意义:
kJ·mol-1
稳定
CO2(g)
H2O(l)
SO2(g)
考点三
I
(3)书写热化学方程式:
燃烧热和中和热
(4)燃烧热的计算:
考点三
I
燃烧热和中和热
2.中和热
在稀溶液中,强酸跟强碱发生中和反应生成
时的反应热叫中和热。
(1)概念:
(2)注意几个限定词:
①稀溶液;
②产物是1
mol液态H2O;
③用离子方程式可表示为OH-(aq)+H+(aq)===H2O(l)
ΔH=-57.3
kJ·mol-1。
(3)中和热的测定
①测定原理
②装置如图(在横线上填出仪器的名称)
1mol液态H2O
环形玻璃搅拌棒
温度计
深度思考
深
度
思
考
偏小
题组一 燃烧热、中和热的含义及表达
题组一
题组二
1
2
3
题组一 燃烧热、中和热的含义及表达
题组一
题组二
1
2
3
答案
A
题组一
题组二
1
2
3
题组一 燃烧热、中和热的含义及表达
题组一
题组二
1
2
3
答案
D
题组一 燃烧热、中和热的含义及表达
解析 本题考查热化学方程式的有关知识,关键在于明确有关反应热的各种概念及热化学方程式的书写方法及正误判断。H2SO4和Ba(OH)2反应时还生成BaSO4沉淀,故反应热还应包括BaSO4沉淀的生成热,A错;
(3)由于中和反应和燃烧均是放热反应,表示中和热和燃烧热时可不带“-”号。
反应热答题规范指导
(1)用“焓变(ΔH)”表示反应热时,ΔH>0表示吸热,ΔH<0表示放热,因而,ΔH后所跟数值需要带“+”、“-”符号。
(2)描述反应热时,无论是用“反应热”、“焓变”表示还是用ΔH表示,其后所跟数值需要带“+”、“-”符号。
题组二 中和热测定误差分析和数据处理
确保盐酸被完全中和
C
题组一
题组二
1
2
3
D
ΔH1=ΔH2<ΔH3
-51.8
kJ·mol-1
题组一
题组二
1
2
3
题组二 中和热测定误差分析和数据处理
(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是________________________________________________________。
H2SO4与Ba(OH)2反应生成BaSO4沉淀的生成热会影响反应的反应热
不能
题组一
题组二
1
2
3
题组二 中和热测定误差分析和数据处理
考点四
I
有关反应热的比较、计算
对放热反应,放热越多,ΔH
;对吸热反应,吸热越多,ΔH
。
1.ΔH的比较
比较ΔH的大小时需考虑正负号
(1)根据热化学方程式计算:
2.反应热的有关计算
(2)根据盖斯定律求算
反应热与反应物的物质的量成正比。
应用盖斯定律进行简单计算时,关键在于设计反应过程,同时注意:
①参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
②当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。
越小
越大
考点四
I
有关反应热的比较、计算
Q(放)=n(可燃物)×|ΔH|
③将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
④在设计反应过程中,会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
(3)根据物质燃烧放热的数值计算:
说明 方法(2)常用于判断物质能量的大小关系及稳定性。
深度思考
深
度
思
考
试比较下列三组ΔH的大小
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
ΔH1____ΔH2(填“>”、“<”或“=”,下同)。
解析 因为C(g)===C(l) ΔH3<0
则ΔH3=ΔH2-ΔH1,ΔH2<ΔH1。
(2)同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
则ΔH1____ΔH2。
解析
ΔH2+ΔH3=ΔH1,
则ΔH3=ΔH1-ΔH2,又ΔH3<0,所以ΔH1<ΔH2。
>
<
深度思考
深
度
思
考
<
题组一 反应热大小的比较和计算
题组一
1
2
题组二
3
4
题组一
1
2
题组二
3
4
题组一 反应热大小的比较和计算
答案
C
285.8
-571.6
题组一
1
2
题组二
3
4
题组一 反应热大小的比较和计算
在比较反应热(ΔH)的大小时,带符号比较。对于放热反应,放出的热量越多,ΔH反而越小。
规避反应热大小比较的易失分点:
题组二 盖斯定律的应用
题组一
1
2
题组二
3
4
B
题组一
1
2
题组二
3
4
题组二 盖斯定律的应用
利用盖斯定律书写热化学方程式
考点五
I
能
源
1.概念
能提供
的自然资源。
2.发展阶段
时期→
时期→
时期。
3.分类
(1)化石燃料
①种类:
、
、
。
②特点:蕴藏量有限,且
再生。
(2)新能源
①种类:
、
、
、
、
和
等。
②特点:资源丰富,
再生,没有污染或污染很小。
4.能源问题
(1)我国目前使用的主要能源是
,它们的蕴藏量有限,
而且不能再生,最终将会枯竭。
(2)化石燃料的大量使用带来严重的
问题。
能量
柴草
化石能源
多能源结构
煤
石油
天然气
不能
太阳能
氢能
风能
地热能
海洋能
生物质能
可以
化石燃料
环境污染
考点五
I
能
源
一是保证燃烧时有
,如鼓入空气、增大O2浓度等。
5.解决能源问题的措施
(1)提高能源的使用效率
①改善开采、运输、加工等各个环节。
②科学控制燃烧反应,使燃料充分燃烧。
开发资源丰富、可以再生、没有污染或污染很小的新能源。
二是保证燃料与空气有
,如将固体
,
使液体
等。
(2)开发新的能源
适当过量的空气
足够大的接触面积
粉碎成粉末
喷成雾状
深度思考
深
度
思
考
解析 未经分类的生活垃圾使用填埋法处理的措施不仅污染环境,还造成资源浪费,③不正确。
A
C
探究高考·明确考向
解析 太阳能热水器的使用不属于生物质能的利用。
解析 植物油不属于化石燃料。
解析 无磷洗涤剂与碳的排放不相关。
解析 水的状态错误。
解析 合成氨反应为可逆反应,并不能完全转化。
×
×
×
×
×
1
2
3
4
5
6
7
8
探究高考·明确考向
√
√
1
2
3
4
5
6
7
8
探究高考·明确考向
√
√
1
2
3
4
5
6
7
8
探究高考·明确考向
B
1
2
3
4
5
6
7
8
探究高考·明确考向
解析 根据反应物和生成物能量的高低来分析、解决问题。化学反应都伴随能量变化,当反应物的总能量高于生成物的总能量时,该反应为放热反应;当反应物的总能量低于生成物的总能量时,该反应为吸热反应。反应①的ΔH>0,为吸热反应,故可排除A项和C项。反应②的ΔH<0,为放热反应,B项错误,故选D。
D
1
2
3
4
5
6
7
8
探究高考·明确考向
C
1
2
3
4
5
6
7
8
探究高考·明确考向
强
32
1
2
3
4
5
6
7
8
探究高考·明确考向
1
2
3
4
5
6
7
8
探究高考·明确考向
6.[2011·四川理综,29(1)]已知1
g
FeS2完全燃烧放出7.1
kJ热量,FeS2燃烧反应的热化学方程式为
____________________________________________________________。
4FeS2(s)+11O2(g)===8SO2(g)+2Fe2O3(s) ΔH=-3
408
kJ·mol-1
1
2
3
4
5
6
7
8
探究高考·明确考向
7.[2012·广东理综,31(4)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=____________;碘电极作为该电池的________极。
正
1
2
3
4
5
6
7
8
探究高考·明确考向
8.[2011·山东理综,28(2)]已知:2SO2(g)+O2(g)??2SO3(g)
ΔH=-196.6
kJ·mol-1
2NO(g)+O2(g)
2NO2(g) ΔH=-113.0
kJ·mol-1
则反应NO2(g)+SO2(g)
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
-41.8
1
2
3
4
5
6
7
8
练出高分
B
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
C
1
2
3
4
5
6
7
8
9
10
11
12
13
解析 热化学方程式的系数表示物质的量,故A、D错误;
B的说法不准确,未强调“水蒸气”,且应为吸收热量。
练出高分
C
1
2
3
4
5
6
7
8
9
10
11
12
13
解析 等物质的量的反应物,气态时所具有的能量高于液态时所具有的能量。根据ΔH=生成物的总能量-反应物的总能量,可知选项C的ΔH数值最小。
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
B
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
D
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
C
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
A
解析 根据盖斯定律可知,①-②=③,所以ΔH1-ΔH2=ΔH3。
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
D
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
D
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=
M
<
。
-290
kJ·mol-1
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
98
kJ
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
NO2(g)+CO(g)===NO(g)+CO2(g)
ΔH=-234
kJ·mol-1
134
NO(g)+CO2(g)===NO2(g)+CO(g)
ΔH=+234
kJ·mol-1
368
234
368
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
(a-b)
kJ·mol-1
放热
926
496.4
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
放出能量31.4
kJ
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
(2d-a-e)
kJ·mol-1
75%
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
819
585
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
化学能与热能
重难点:用盖斯定律进行有关反应热的简单计算。
【考纲要求】
1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化,了解吸热反应、放热反应、反
应热等概念。
3.了解热化学方程式的含义,能用盖斯定律进行有关反应热的简
单计算。
4.了解能源是人类生存和社会发展的重要基础,了解化学在解决
能源危机中的重要作用。
考点一
I
焓变与反应热
(3)化学反应中的能量转化形式:
、光能、电能等。通常主要表现
为
的变化。
1.化学反应中的能量变化
(1)化学反应中的两大变化:
变化和
变化。
(2)化学反应中的两大守恒:
守恒和
守恒。
或
。
2.焓变、反应热
在
条件下进行的反应的
。
。
(1)定义:
(2)符号:
(3)单位:
3.吸热反应和放热反应
物质
能量
质量
能量
热能
热量
恒压
热效应
ΔH
kJ·mol-1
kJ/mol
(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
①大多数分解反应;②盐的水解和弱电解质的电离;
③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应。
(2)从反应热的量化参数——键能的角度分析
(3)常见放热反应
①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;
④金属跟酸的置换反应;⑤物质的缓慢氧化。
(4)常见吸热反应
考点一
I
焓变与反应热
吸
放
1.同质量的硫粉在空气中燃烧和在纯氧中燃烧,哪一个放出的热量多,为什么?
答案 在空气中燃烧放出的热量多,因在纯氧中燃烧火焰明亮,转化成的光能多,故放出的热量少。
2.判断正误,正确的划“√”,错误的划“×”
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应
( )
(2)物质发生化学变化都伴有能量的变化
( )
(3)伴有能量变化的物质变化都是化学变化
( )
(4)吸热反应在任何条件都不能发生
( )
(5)Na转化为Na+时,吸收的能量就是该过程的反应热
( )
(6)水蒸气变为液态水时放出的能量就是该变化的反应热
( )
深度思考
深
度
思
考
×
√
×
×
×
×
题组训练 反应热的基本计算方法
解析 该图表示的正反应放热,ΔH为负值,逆反应吸热,ΔH为正值,D错误。
D
1
2
3
-1
220
kJ·mol-1
1
2
3
题组训练 反应热的基本计算方法
+236
kJ·mol-1
1
2
3
题组训练 反应热的基本计算方法
1.熟记反应热ΔH的基本计算公式
ΔH=反应物的总键能之和-生成物的总键能之和
2.规避两个易失分点
(1)旧化学键的断裂和新化学键的形成是同时进行的,缺少任一个过程都不是化学变化。
(2)计算物质中键的个数时,不能忽略物质的结构,如1
mol晶体硅中含2
mol
Si—Si键。1
mol
SiO2中含4
mol
Si—O键。
ΔH=生成物的总能量-反应物的总能量
考点二
I
热化学方程式
表示参与化学反应的物质的
和
的关系的化学方程式。
1.概念
表明了化学反应中的
变化和
变化。
如:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6
kJ·mol-1
2.意义
表示:2
mol氢气和1
mol氧气反应生成2
mol液态水时放出571.6
kJ的热量。
(4)注意守恒关系:①原子守恒和得失电子守恒;
②能量守恒。(ΔH与化学计量数相对应)
3.书写
(1)注明反应条件:反应热与测定条件(温度、压强等)有关。绝大多数反应是在25
℃、101
kPa下进行的,可不注明。
(2)注明物质状态:常用
、
、
、
分别表示固体、液体、气体、溶液。
(3)注意符号单位:ΔH应包括“+”或“-”、数字和单位(kJ·mol-1)。
物质的量
反应热
物质
能量
s
l
g
aq
考点二
I
热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。且化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。
(5)区别于普通方程式:一般不注“↑”、“↓”以及“点燃”、“加热”等。
(6)注意热化学方程式的化学计量数
热化学方程式
深度思考
深
度
思
考
1.ΔH的单位“kJ·mol-1”的含义是什么?
2.怎样理解可逆反应中的反应热?
答案 无论化学反应是否可逆,热化学方程式中的反应热ΔH都表示反应进行到底(完全转化)时的能量变化。如2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64
kJ·mol-1,ΔH是指2
mol
SO2(g)和1
mol
O2(g)完全转化为2
mol
SO3(g)时放出的能量。若在相同的温度和压强下,向某容器中加入2
mol
SO2(g)和1
mol
O2(g),反应达到平衡时放出的能量为Q,因反应不能完全转化为SO3(g),故Q<196.64
kJ。
深度思考
深
度
思
考
知识梳理·题型构建
80%
题组一 热化学方程式的书写
N2(g)+2O2(g)===2NO2(g)
ΔH=+67.8
kJ·mol-1
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
ΔH=-1
427.2
kJ·mol-1
N2(g)+3H2(g)===2NH3(g) ΔH=-92
kJ·mol-1
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH=-2Q
kJ·mol-1
题组一
1
2
题组二
3
4
题组一 热化学方程式的书写
题组一
1
2
题组二
3
4
(3)N2
(g)+3H
2
(g)===2NH
3
(g) ΔH=(
946+436×3-391×6)
kJ·
mol-1=-92
kJ·mol-1。
(4)根据C原子守恒有:C2H5OH~2CO2~2CaCO3。生成100
g
CaCO3沉淀,则乙醇为0.5
mol,据此可写出反应的热化学方程式。
题组一 热化学方程式的书写
解析 由图可知,产物总能量低于反应物总能量,该反应是放热反应,ΔH=E1-E2=134
kJ·mol-1-368
kJ·mol-1=-234
kJ·mol-1。
NO2(g)+CO(g)===CO2(g)+NO(g)
ΔH=-234
kJ·mol-1
题组一
1
2
题组二
3
4
题组二 热化学方程式的判断
解析 写热化学方程式时要重点注意其与普通化学方程式不同的几点:(1)产物的稳定状态,H2O为液态,C的稳定化合物为CO2;(2)单位是kJ·mol-1,不是kJ;(3)数值,ΔH的数值要与方程式中计量系数保持一致;(4)符号,吸热用“+”,放热用“-”。仅②④符合要求。
B
题组一
1
2
题组二
3
4
题组二 热化学方程式的判断
B
解析 选项A中根据燃烧热的定义可知产物应是SO2;
题组一
1
2
题组二
3
4
选项C中热化学方程式没有标明各物质的聚集状态;
选项D中ΔH应为正值。
4.下列热化学方程式书写正确的是(ΔH的绝对值均正确)
( )
A.S(s)+O2(g)===SO3(g)
ΔH=-315
kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=-57.3
kJ·mol-1(中和热)
C.C2H5OH+3O2===2CO2+3H2O
ΔH=-1
368.8
kJ·mol-1(反应热)
D.2H2O(g)===2H2(g)+O2(g)
ΔH=-483.6
kJ·mol-1(反应热)
(5)看反应热的数值与化学计量数是否对应。
“五看”法判断热化学方程式的正误
(1)看方程式是否配平;
(2)看各物质的聚集状态是否正确;
(3)看ΔH的“+”、“-”符号是否正确;
(4)看反应热的单位是否为kJ·mol-1;
考点三
I
燃烧热和中和热
燃烧热的限定词有恒压(101
kPa时)、可燃物的物质的量(1
mol)、完全燃烧、
的氧化物等,其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C→
,H→
,S→
等。
1.燃烧热
(1)概念:
所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用
表示。
在101
kPa时,1
mol纯物质完全燃烧生成稳定的氧化物时
例如C的燃烧热为393.5
kJ·mol-1,表示在101
kPa时,1
mol
C完全燃烧放出393.5
kJ的热量。
(2)表示的意义:
kJ·mol-1
稳定
CO2(g)
H2O(l)
SO2(g)
考点三
I
(3)书写热化学方程式:
燃烧热和中和热
(4)燃烧热的计算:
考点三
I
燃烧热和中和热
2.中和热
在稀溶液中,强酸跟强碱发生中和反应生成
时的反应热叫中和热。
(1)概念:
(2)注意几个限定词:
①稀溶液;
②产物是1
mol液态H2O;
③用离子方程式可表示为OH-(aq)+H+(aq)===H2O(l)
ΔH=-57.3
kJ·mol-1。
(3)中和热的测定
①测定原理
②装置如图(在横线上填出仪器的名称)
1mol液态H2O
环形玻璃搅拌棒
温度计
深度思考
深
度
思
考
偏小
题组一 燃烧热、中和热的含义及表达
题组一
题组二
1
2
3
题组一 燃烧热、中和热的含义及表达
题组一
题组二
1
2
3
答案
A
题组一
题组二
1
2
3
题组一 燃烧热、中和热的含义及表达
题组一
题组二
1
2
3
答案
D
题组一 燃烧热、中和热的含义及表达
解析 本题考查热化学方程式的有关知识,关键在于明确有关反应热的各种概念及热化学方程式的书写方法及正误判断。H2SO4和Ba(OH)2反应时还生成BaSO4沉淀,故反应热还应包括BaSO4沉淀的生成热,A错;
(3)由于中和反应和燃烧均是放热反应,表示中和热和燃烧热时可不带“-”号。
反应热答题规范指导
(1)用“焓变(ΔH)”表示反应热时,ΔH>0表示吸热,ΔH<0表示放热,因而,ΔH后所跟数值需要带“+”、“-”符号。
(2)描述反应热时,无论是用“反应热”、“焓变”表示还是用ΔH表示,其后所跟数值需要带“+”、“-”符号。
题组二 中和热测定误差分析和数据处理
确保盐酸被完全中和
C
题组一
题组二
1
2
3
D
ΔH1=ΔH2<ΔH3
-51.8
kJ·mol-1
题组一
题组二
1
2
3
题组二 中和热测定误差分析和数据处理
(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是________________________________________________________。
H2SO4与Ba(OH)2反应生成BaSO4沉淀的生成热会影响反应的反应热
不能
题组一
题组二
1
2
3
题组二 中和热测定误差分析和数据处理
考点四
I
有关反应热的比较、计算
对放热反应,放热越多,ΔH
;对吸热反应,吸热越多,ΔH
。
1.ΔH的比较
比较ΔH的大小时需考虑正负号
(1)根据热化学方程式计算:
2.反应热的有关计算
(2)根据盖斯定律求算
反应热与反应物的物质的量成正比。
应用盖斯定律进行简单计算时,关键在于设计反应过程,同时注意:
①参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
②当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。
越小
越大
考点四
I
有关反应热的比较、计算
Q(放)=n(可燃物)×|ΔH|
③将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
④在设计反应过程中,会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
(3)根据物质燃烧放热的数值计算:
说明 方法(2)常用于判断物质能量的大小关系及稳定性。
深度思考
深
度
思
考
试比较下列三组ΔH的大小
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
ΔH1____ΔH2(填“>”、“<”或“=”,下同)。
解析 因为C(g)===C(l) ΔH3<0
则ΔH3=ΔH2-ΔH1,ΔH2<ΔH1。
(2)同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
则ΔH1____ΔH2。
解析
ΔH2+ΔH3=ΔH1,
则ΔH3=ΔH1-ΔH2,又ΔH3<0,所以ΔH1<ΔH2。
>
<
深度思考
深
度
思
考
<
题组一 反应热大小的比较和计算
题组一
1
2
题组二
3
4
题组一
1
2
题组二
3
4
题组一 反应热大小的比较和计算
答案
C
285.8
-571.6
题组一
1
2
题组二
3
4
题组一 反应热大小的比较和计算
在比较反应热(ΔH)的大小时,带符号比较。对于放热反应,放出的热量越多,ΔH反而越小。
规避反应热大小比较的易失分点:
题组二 盖斯定律的应用
题组一
1
2
题组二
3
4
B
题组一
1
2
题组二
3
4
题组二 盖斯定律的应用
利用盖斯定律书写热化学方程式
考点五
I
能
源
1.概念
能提供
的自然资源。
2.发展阶段
时期→
时期→
时期。
3.分类
(1)化石燃料
①种类:
、
、
。
②特点:蕴藏量有限,且
再生。
(2)新能源
①种类:
、
、
、
、
和
等。
②特点:资源丰富,
再生,没有污染或污染很小。
4.能源问题
(1)我国目前使用的主要能源是
,它们的蕴藏量有限,
而且不能再生,最终将会枯竭。
(2)化石燃料的大量使用带来严重的
问题。
能量
柴草
化石能源
多能源结构
煤
石油
天然气
不能
太阳能
氢能
风能
地热能
海洋能
生物质能
可以
化石燃料
环境污染
考点五
I
能
源
一是保证燃烧时有
,如鼓入空气、增大O2浓度等。
5.解决能源问题的措施
(1)提高能源的使用效率
①改善开采、运输、加工等各个环节。
②科学控制燃烧反应,使燃料充分燃烧。
开发资源丰富、可以再生、没有污染或污染很小的新能源。
二是保证燃料与空气有
,如将固体
,
使液体
等。
(2)开发新的能源
适当过量的空气
足够大的接触面积
粉碎成粉末
喷成雾状
深度思考
深
度
思
考
解析 未经分类的生活垃圾使用填埋法处理的措施不仅污染环境,还造成资源浪费,③不正确。
A
C
探究高考·明确考向
解析 太阳能热水器的使用不属于生物质能的利用。
解析 植物油不属于化石燃料。
解析 无磷洗涤剂与碳的排放不相关。
解析 水的状态错误。
解析 合成氨反应为可逆反应,并不能完全转化。
×
×
×
×
×
1
2
3
4
5
6
7
8
探究高考·明确考向
√
√
1
2
3
4
5
6
7
8
探究高考·明确考向
√
√
1
2
3
4
5
6
7
8
探究高考·明确考向
B
1
2
3
4
5
6
7
8
探究高考·明确考向
解析 根据反应物和生成物能量的高低来分析、解决问题。化学反应都伴随能量变化,当反应物的总能量高于生成物的总能量时,该反应为放热反应;当反应物的总能量低于生成物的总能量时,该反应为吸热反应。反应①的ΔH>0,为吸热反应,故可排除A项和C项。反应②的ΔH<0,为放热反应,B项错误,故选D。
D
1
2
3
4
5
6
7
8
探究高考·明确考向
C
1
2
3
4
5
6
7
8
探究高考·明确考向
强
32
1
2
3
4
5
6
7
8
探究高考·明确考向
1
2
3
4
5
6
7
8
探究高考·明确考向
6.[2011·四川理综,29(1)]已知1
g
FeS2完全燃烧放出7.1
kJ热量,FeS2燃烧反应的热化学方程式为
____________________________________________________________。
4FeS2(s)+11O2(g)===8SO2(g)+2Fe2O3(s) ΔH=-3
408
kJ·mol-1
1
2
3
4
5
6
7
8
探究高考·明确考向
7.[2012·广东理综,31(4)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=____________;碘电极作为该电池的________极。
正
1
2
3
4
5
6
7
8
探究高考·明确考向
8.[2011·山东理综,28(2)]已知:2SO2(g)+O2(g)??2SO3(g)
ΔH=-196.6
kJ·mol-1
2NO(g)+O2(g)
2NO2(g) ΔH=-113.0
kJ·mol-1
则反应NO2(g)+SO2(g)
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
-41.8
1
2
3
4
5
6
7
8
练出高分
B
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
C
1
2
3
4
5
6
7
8
9
10
11
12
13
解析 热化学方程式的系数表示物质的量,故A、D错误;
B的说法不准确,未强调“水蒸气”,且应为吸收热量。
练出高分
C
1
2
3
4
5
6
7
8
9
10
11
12
13
解析 等物质的量的反应物,气态时所具有的能量高于液态时所具有的能量。根据ΔH=生成物的总能量-反应物的总能量,可知选项C的ΔH数值最小。
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
B
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
D
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
C
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
A
解析 根据盖斯定律可知,①-②=③,所以ΔH1-ΔH2=ΔH3。
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
D
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
D
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=
M
<
。
-290
kJ·mol-1
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
98
kJ
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
NO2(g)+CO(g)===NO(g)+CO2(g)
ΔH=-234
kJ·mol-1
134
NO(g)+CO2(g)===NO2(g)+CO(g)
ΔH=+234
kJ·mol-1
368
234
368
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
(a-b)
kJ·mol-1
放热
926
496.4
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
放出能量31.4
kJ
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
(2d-a-e)
kJ·mol-1
75%
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
819
585
练出高分
1
2
3
4
5
6
7
8
9
10
11
12
13
