原电池
图片预览







文档简介
(共22张PPT)
复习回顾
一、原电池是
______________________的装置。
将化学能转化为电能
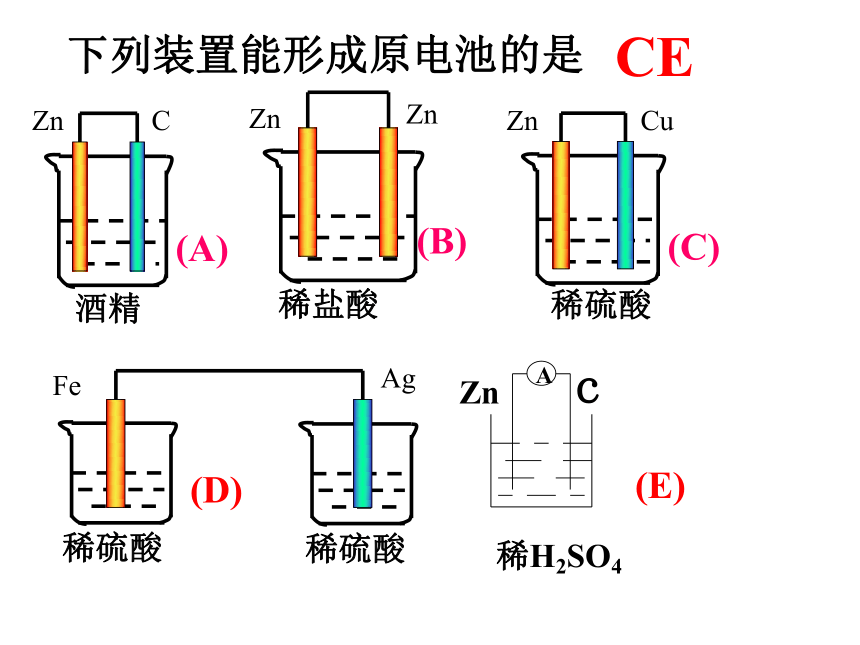
下列装置能形成原电池的是
A
稀H2SO4
Zn c
稀硫酸
稀硫酸
Ag
Fe
(D)
酒精
Zn
C
(A)
Zn
稀盐酸
Zn
(B)
稀硫酸
Zn
Cu
(C)
(E)
CE
①有活泼性不同的两种金属做电极(或一种是非金属电极)
②都插入电解质溶液中
③形成闭合回路
④ 某一电极能与电解质溶液发生氧化还原反应
思考:有下列材料: Zn片、Cu片、导线、西红柿,根据构成原电池的条件,请大家推断一下能否组成原电池?
复习回顾
当电解质溶液为稀H2SO4时:
Zn电极是____(正或负)极,
其电极反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为
_______________,该反应是_________反应。
负
Zn -2e - = Zn 2+
氧化
正
2H+ +2e- =H2↑
还原
规律:负氧活
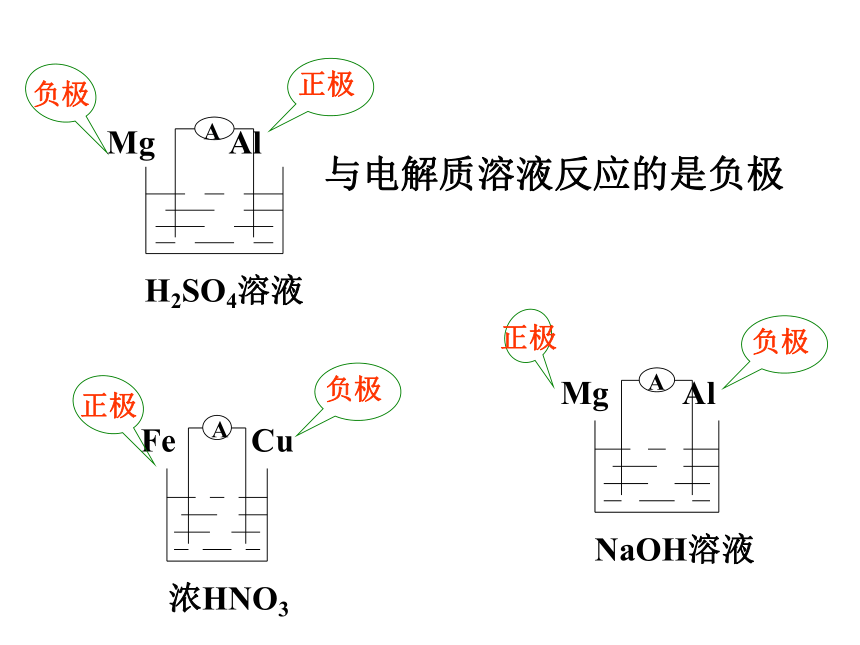
浓HNO3
Fe Cu
A
负极
正极
NaOH溶液
Mg Al
A
负极
正极
H2SO4溶液
Mg Al
A
负极
正极
与电解质溶液反应的是负极
溶液中的阳离子移向 极,阴离子移向 极
负
正
正
负
电流的产生:
外电路:
电子
电子由 极流向 极
原电池内部:
自由移动的离子
在用锌片,铜片和稀硫酸组成的原电池装置中,经一段时间后,下列说法中正确的是( )
A、锌片是正极,铜片上有气泡产生
B、电流方向是从锌片流向铜片
C、溶液中 H+ 的物质的量减小
D、溶液中的 向正极移动
C
SO42 -
正极:
负极:
总反应:
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
总反应是负极与电解质溶液的反应
下列反应不能设计成原电池的是
B Fe+Cu2+=Fe2++Cu
A Zn+2H+=Zn2++H2↑
C Cu+ 2Ag+ =2 Ag+ Cu2+
D H++OH-=H2O
D
对锌铜原电 池工作原理的进一步探究
上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
实验现象:
分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
有盐桥存在时电流计指针发生偏转,即有电流通过电路。取出盐桥,电流计指针即回到零点,说明没有电流通过。
将琼胶置于烧杯中,加入饱和的KCl溶液,加热使琼胶熔成糊状,趁热倒入U形管中。冷却后即可充当盐桥。
琼脂在食品工业的应用中具有一种极其有用的独特性质。其特点:具有凝固性、稳定性,可用作增稠剂、凝固剂、悬浮剂。 广泛用于制造粒粒橙及各种饮料、果冻、冰淇淋、糕点、软糖、罐头、肉制品、八宝粥、银耳燕窝、凉拌食品等等。
盐桥的作用:
(1)使整个装置构成通路
(2)平衡电荷。
K+移向 ,Cl-移向 。
双液原电池的工作原理
1、构造特点:
由两个半电池组成,每个半电池中的电极与电解质溶液互不反应,中间通过盐桥连接形成闭合回路。
2、电极反应:
负极(Zn):Zn-2e-=Zn2+
(氧化反应)
正极(Cu):Cu2++2e-=Cu
(还原反应)
电池反应:
Zn+Cu2+=Zn2++Cu
电池符号: Zn ︱ ZnSO4‖ CuSO4 ︱ Cu
负极 盐桥 正极
一般是
①由两极材料判断,
活泼的金属为 极,
②根据电子流动方向判断,
电子由 流向 极
③根据电流方向判断,
由 极流向 极
④根据电解质溶液内离子的定向移动方向,
阴离子移向的极是 极,阳离子移向的极是 极,
⑤根据两极发生的变化判断,
发生氧化反应的总是 极
负
负极
正
正
负
负
正
负
紧跟高考
1、100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成H2的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸
B.加入数滴CuCl2溶液
C. 加入适量蒸馏水
D. 加入适量的NaCl溶液
B
形成原电池可使反应速度加快
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
参考答案
(+)
(-)
G
Zn
C
FeCl3
溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
盐桥
Zn
C
ZnCl2溶液
FeCl3溶液
G
2、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池:若a、 b相连时,a为负极;c、d相连,d上有气体逸出;a、c相连时,a极减轻;b、d相连,b为正极。则四种金属的活动性为( )
a ﹥ b ﹥ c ﹥ d B. a ﹥ c ﹥ b ﹥ d
C. a ﹥ c ﹥ d ﹥b D. b ﹥ d ﹥ c ﹥ a
紧跟高考
C
判断下列原电池的正、负极,并写出电极反应式和总反应方程式
AgNO3
C Cu
A
稀H2SO4
Fe Cu
A
CuSO4
Zn C
A
复习回顾
一、原电池是
______________________的装置。
将化学能转化为电能
下列装置能形成原电池的是
A
稀H2SO4
Zn c
稀硫酸
稀硫酸
Ag
Fe
(D)
酒精
Zn
C
(A)
Zn
稀盐酸
Zn
(B)
稀硫酸
Zn
Cu
(C)
(E)
CE
①有活泼性不同的两种金属做电极(或一种是非金属电极)
②都插入电解质溶液中
③形成闭合回路
④ 某一电极能与电解质溶液发生氧化还原反应
思考:有下列材料: Zn片、Cu片、导线、西红柿,根据构成原电池的条件,请大家推断一下能否组成原电池?
复习回顾
当电解质溶液为稀H2SO4时:
Zn电极是____(正或负)极,
其电极反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为
_______________,该反应是_________反应。
负
Zn -2e - = Zn 2+
氧化
正
2H+ +2e- =H2↑
还原
规律:负氧活
浓HNO3
Fe Cu
A
负极
正极
NaOH溶液
Mg Al
A
负极
正极
H2SO4溶液
Mg Al
A
负极
正极
与电解质溶液反应的是负极
溶液中的阳离子移向 极,阴离子移向 极
负
正
正
负
电流的产生:
外电路:
电子
电子由 极流向 极
原电池内部:
自由移动的离子
在用锌片,铜片和稀硫酸组成的原电池装置中,经一段时间后,下列说法中正确的是( )
A、锌片是正极,铜片上有气泡产生
B、电流方向是从锌片流向铜片
C、溶液中 H+ 的物质的量减小
D、溶液中的 向正极移动
C
SO42 -
正极:
负极:
总反应:
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
总反应是负极与电解质溶液的反应
下列反应不能设计成原电池的是
B Fe+Cu2+=Fe2++Cu
A Zn+2H+=Zn2++H2↑
C Cu+ 2Ag+ =2 Ag+ Cu2+
D H++OH-=H2O
D
对锌铜原电 池工作原理的进一步探究
上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
实验现象:
分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
有盐桥存在时电流计指针发生偏转,即有电流通过电路。取出盐桥,电流计指针即回到零点,说明没有电流通过。
将琼胶置于烧杯中,加入饱和的KCl溶液,加热使琼胶熔成糊状,趁热倒入U形管中。冷却后即可充当盐桥。
琼脂在食品工业的应用中具有一种极其有用的独特性质。其特点:具有凝固性、稳定性,可用作增稠剂、凝固剂、悬浮剂。 广泛用于制造粒粒橙及各种饮料、果冻、冰淇淋、糕点、软糖、罐头、肉制品、八宝粥、银耳燕窝、凉拌食品等等。
盐桥的作用:
(1)使整个装置构成通路
(2)平衡电荷。
K+移向 ,Cl-移向 。
双液原电池的工作原理
1、构造特点:
由两个半电池组成,每个半电池中的电极与电解质溶液互不反应,中间通过盐桥连接形成闭合回路。
2、电极反应:
负极(Zn):Zn-2e-=Zn2+
(氧化反应)
正极(Cu):Cu2++2e-=Cu
(还原反应)
电池反应:
Zn+Cu2+=Zn2++Cu
电池符号: Zn ︱ ZnSO4‖ CuSO4 ︱ Cu
负极 盐桥 正极
一般是
①由两极材料判断,
活泼的金属为 极,
②根据电子流动方向判断,
电子由 流向 极
③根据电流方向判断,
由 极流向 极
④根据电解质溶液内离子的定向移动方向,
阴离子移向的极是 极,阳离子移向的极是 极,
⑤根据两极发生的变化判断,
发生氧化反应的总是 极
负
负极
正
正
负
负
正
负
紧跟高考
1、100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成H2的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸
B.加入数滴CuCl2溶液
C. 加入适量蒸馏水
D. 加入适量的NaCl溶液
B
形成原电池可使反应速度加快
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
参考答案
(+)
(-)
G
Zn
C
FeCl3
溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
盐桥
Zn
C
ZnCl2溶液
FeCl3溶液
G
2、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池:若a、 b相连时,a为负极;c、d相连,d上有气体逸出;a、c相连时,a极减轻;b、d相连,b为正极。则四种金属的活动性为( )
a ﹥ b ﹥ c ﹥ d B. a ﹥ c ﹥ b ﹥ d
C. a ﹥ c ﹥ d ﹥b D. b ﹥ d ﹥ c ﹥ a
紧跟高考
C
判断下列原电池的正、负极,并写出电极反应式和总反应方程式
AgNO3
C Cu
A
稀H2SO4
Fe Cu
A
CuSO4
Zn C
A
