四川省成都市新津区高级中学2020-2021学年高二下学期开学考试化学试题 Word版缺答案
文档属性
| 名称 | 四川省成都市新津区高级中学2020-2021学年高二下学期开学考试化学试题 Word版缺答案 |
|
|
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-11 00:00:00 | ||
图片预览


文档简介
新津中学高2019级(高二)下期入学考试题
化 学
可能用到的原子量:H-1 C-12
第Ⅰ卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意)
1.在压强为2.20×101 kPa、温度达到374 ℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
A.二氧化碳与超临界水作用生成汽油的反应,属于吸热反应
B.“水热反应”过程中只有化学变化,没有物理变化
C.火力发电厂有望利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
2.在测定中和热的实验中,下列说法不正确的是( )
A.在测定中和热实验中需要使用的仪器有天平、量筒﹑烧杯、滴定管、温度计
B.为了准确测定反应混合溶液的温度,实验中温度计水银球不能与小烧杯底部接触
C.用50 mL 0.55 mol ·L-1的NaOH 溶液与60 mL 0.50 mol ·L-1的盐酸反应,
测得的中和热数值不变
D.使用环形玻璃搅拌棒是为了加大反应速率,减小实验误差
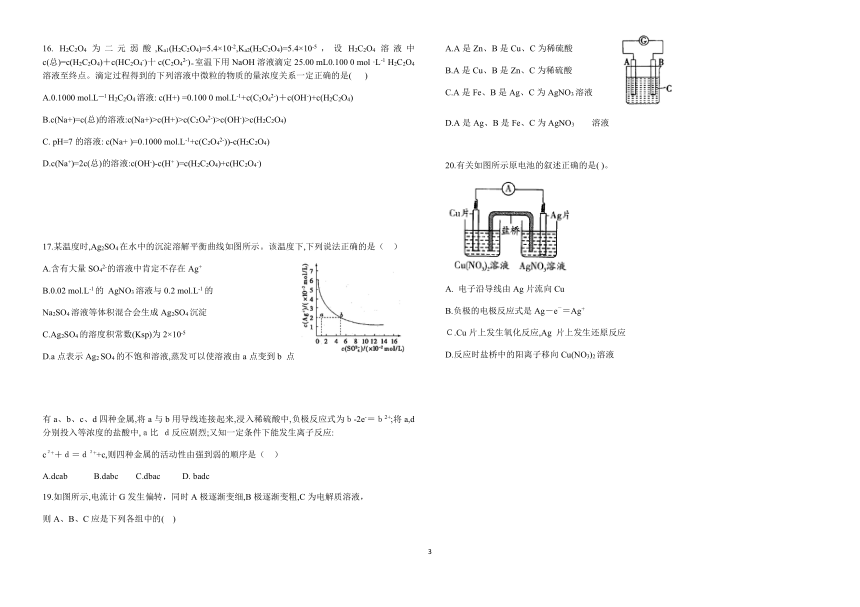
3.2A(g)?B(g) ?H1(?H1>0);2A(g)?B(1)?H2。下列能量变化示意图正确的是( )
4.已知 1 mol X2 (g)完全燃烧生成 X2O(g)放出能量a kJ,且X2中 l mol X-X键断裂时吸收能量b kJ,氧气中 l mol O=O键断裂时吸收能量ckJ,则X2O中 l mol X-O键形成时放出的能量为( )
A.falsekJ BfalseKJ C.falsekJ D.false kJ
5.已知“凡气体分子总数增大的反应一定是熵增加的反应”。下列反应一定能自发进行的是( )
A.2O3(g)=302(g) ?H<0 B.2CO(g)=2C(s)+O2 (g) ?H>0
C.N2(g)+3H2(g)?2NH3(g) ?H<0 D.CaCO3(s)=CaO(s)+CO2(g) ?H>0
6.反应P(g)+3Q(g)?2R(l)+2S(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
A.V(P)=0.15 mol/(L·min) B.V(Q)=0.6 mol/(L· min)
C.V(R)=0. 1 mol/(L·s) D.V(S)=0.45 mol/(L· min)
7.在一定条件下,将2 mol A和1 mol B混合于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g)?xC(g)+2D(g),5s时测得气体压强是反应前的false。则x为( )
A.1 B.2 C.3 D.条件不足,无法计算
8.在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应A(s) +2B(g)?C(g)+D(g)已达到平衡状态的是( )。
A.混合气体的压强
B.混合气体的密度
C.气体的总物质的量
D.单位时间内生成n mol C的同时消耗2n mol B
9.密闭容器中一定量的混合气体发生以下反应:
xA(g)十yB(g)?zC(g),平衡时测得A的浓度为0.50 mol.L-1,在温度不变时,把容器容积扩
大到原来的2倍,使其重新达到平衡,此时A的浓度为0.30 mol.L-1,下列叙述正确的是( )
A.平衡一定向右移动 B.B的转化率降低
C.x+y10.某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)?2NO2(g),在其他条件相同时,测得实验数据如下表:
根据表中数据,下列说法不正确的是( )
升高温度,反应速率加快
增大压强,反应速率加快
C.在1.0×105 Pa、90℃条件下,当转化率为98%时反应不一定达到平衡
D.若进入反应塔的混合气体为a mol,反应速率以V=?n/?t表示,则在8.0×105Pa、 30℃条件下,转化率从50%增至90%时段NO的反应速率为falsemol.s-1
11.在CH3COOH ?CH3COO- + H+的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是( )
A.加入 NaOH B.加入盐酸 C.加水 D.升高温度
12.下列实验事实或数据可以说明次氯酸为弱电解质的是( )
A.0.001 mol/L的HClO溶液的pH=3
B.次氯酸具有漂白性
C.温度为25℃时,次氯酸钠水溶液的pH>7
D.用HClO 的水溶液做导电实验时,灯泡很暗
13.若溶液中由水电离产生的c(OH-)=1×10-14 mol.L-1,满足此条件的溶液中一定不能
大量共存的离子组是( )
A13+ Na+ NO3- Cl-
B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- HCO3-
K+ Fe3+ SO42- NO3-
14.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考甲、乙两图,从下表中选出正确选项( )
15.下列说法正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液分别加热、蒸发、浓缩结晶、灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再加水稀释到所需的浓度
C.向CuCl2溶液中加入CuO,调节PH可除去溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
16. H2C2O4为二元弱酸,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,设H2C2O4溶液中 c(总)=c(H2C2O4)+c(HC2O4-)十c(C2O42-)。室温下用NaOH溶液滴定25.00 mL0.100 0 mol ·L-1 H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.1000 mol.L―1 H2C2O4溶液: c(H+) =0.100 0 mol.L-1+c(C2O42-)+c(OH-)+c(H2C2O4)
B.c(Na+)=c(总)的溶液:c(Na+)>c(H+)>c(C2O42-)>c(OH-)>c(H2C2O4)
C. pH=7的溶液: c(Na+ )=0.1000 mol.L-1+c(C2O42-))-c(H2C2O4)
D.c(Na+)=2c(总)的溶液:c(OH-)-c(H+ )=c(H2C2O4)+c(HC2O4-)
17.某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是( )
39179504445A.含有大量SO42-的溶液中肯定不存在Ag+
B.0.02 mol.L-1的 AgNO3溶液与0.2 mol.L-1的
Na2SO4溶液等体积混合会生成Ag2SO4沉淀
C.Ag2SO4的溶度积常数(Ksp)为2×10-5
D.a点表示Ag2 SO4的不饱和溶液,蒸发可以使溶液由a点变到b 点
有a、b、c、d四种金属,将a与b用导线连接起来,浸入稀硫酸中,负极反应式为b-2e-=b2+;将a,d分别投入等浓度的盐酸中,a比 d反应剧烈;又知一定条件下能发生离子反应:
c2++d=d2++c,则四种金属的活动性由强到弱的顺序是( )
A.dcab B.dabc C.dbac D. badc
19.如图所示,电流计G发生偏转,同时A极逐渐变细,B极逐渐变粗,C为电解质溶液,
则A、B、C应是下列各组中的( )
2667000-109220A.A是Zn、B是Cu、C为稀硫酸
B.A是Cu、B是Zn、C为稀硫酸
C.A是Fe、B是Ag、C为AgNO3溶液
D.A是Ag、B是Fe、C为AgNO3溶液
20.有关如图所示原电池的叙述正确的是( )。
电子沿导线由Ag片流向Cu
B.负极的电极反应式是Ag-e-=Ag+
C.Cu片上发生氧化反应,Ag 片上发生还原反应
D.反应时盐桥中的阳离子移向Cu(NO3)2溶液
第Ⅱ卷 (非选择题 60分)
21.(12分)化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫作反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列?H表示物质燃烧热的是_____;不能表示物质中和热的是_____。(填字母)
A.H2(g)+falseO2(g)=2H2O(g) ?H1 B.C(s)+falseO2(g)=CO(g) ?H2
C.CH4(g)+202g)=CO2(g)+2H2O(l) ?H3 D.C(s)+O2(g)=CO2(g) ?H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ?H5
F. NaOH(aq)+HCl( aq)=NaCl( aq)+H2O(l) ?H6
G.2NaOH(aq)+H2SO4( aq)=Na2SO4( aq)+2H2O(l) ?H7
CH3COOH(aq)+NaOH(aq)=CH3COONa( aq)十H2O(l) ?H8
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:___________________
充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100 mL浓度为4 mol.L-1的KOH 溶液完全反应生成正盐。则燃烧l mol丁烷放出的热量为 。
4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4 mol.L-1的KOH 溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是______mol
(5)氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76 、TiH1.73 .CeH2.69 、ZrH1.98.PrH2.65. TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840 体积的氢气(钯粉的密度为10.64 g. cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式: 。
22.(13分) 某同学在用稀硫酸与锌粒制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
( 1)上述实验中发生反应的化学方程式有:_________________________________
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________________
(3)实验室中现有Na2SO4, MgSO4,Ag2SO4,K2SO4四种溶液,可与上述实验中 CuSO4溶液起相似作用的
是____________
(4)要加快上述实验中气体产生的速率,还可采取的措施有_____________、____________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中: V2= ,V6= ,V10=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
__________________________________________________
(13分)(1)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+ 、OH-,存在的分子只有H2O,
根据题意回答下列问题。
①写出酸H2A的电离方程式:______________________
②若溶液M由10 mL 2 mol.L-1 NaHA 溶液与10 mL 2 mol .L-1 NaOH 溶液混合而得,则溶液M的pH_______(填“>”“<”或“=”)7,
溶液M中各粒子的浓度关系正确的是______(填序号)。
c( Na+) >c(A2- ) > c( OH-) >c(H+)
c( HA-)+2c(H2A)+c(H+)= c(OH-)
c(A2- ) +c(HA- )+c( OH- ) =c( Na+ )+c(H+)
c(A2- ) + c(HA-) = 1 mol.L-1
(2)实验室可用NaOH 溶液吸收 NO2,,反应为2NO2+2NaOH=NaNO3+ NaNO2+ H2O。含0.2 mol NaOH 的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1 mol. L-1的CH3COONa溶液,则两溶液中c(NO3- ) .c( NO2-)和 c(CH3COO-)由大到小的顺序为___________________________
(已知HNO2的电离常数Ka=7.1 ×10-4, CH3COOH 的电离常数K。=1.7 ×10-5)。
可使溶液A和溶液B的 pH相等的方法是______________________(填序号)。
向溶液A中加适量水 b.向溶液A中加适量 NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液(NaOH 溶液)吸收SO2的过程中, pH随n( SO32-):n( HSO3-)的变化关系如下表:
①由上表判断 NaHSO3溶液显____性。
②当吸收液呈中性时,溶液中离子浓度的大小关系为_____________________
24. (11分)α-铁纳米粉在现代电子工业上用途极为广泛,用赤铁矿石(含 Fe2O3, FeO,也含有 Al2O3,MnO2 ,CuO等)制备纳米铁颗粒的实验流程如下:
已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
回答以下问题:
实验流程中首先对赤铁矿进行“碾碎”,目的是_____________________
(2)固体A的成分是________________(填写化学式),在滤液A中加H2O2的目的是
_________________________(用离子方程式进行说明)。
(3)步骤②中需调节pH的范围是________________________________
(4)步骤③中灼烧所需的仪器有酒精灯、三脚架、_________________________(填仪器名称),
发生反应的化学方程式为_________________________
25.(11分)(1) Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴 CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0192。
3402965162560②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0250。
根据上述实验结果判断,还原CoO( s)为Co(s)的倾向是CO_____H2(填“大于”或“小于”)。
(2)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。右图为刚性容器中,进料浓度比c(HCl) :c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
①由图可推知该反应的?H______0(填>、<、=,下同)平衡常数K(300℃)_______K(400℃)
②曲线C代表进料浓度比c(HCl):c(O2)为___________
设HCl初始浓度为c。,根据进料浓度比c(HCl): c(O2)=4:1的数据计算K(400 ℃)=______________
(列出计算式)。
③按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过高的不利影响是___________
④Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+falseCl2(g) ?H1=+89kJ .mol-1
CuCl(s)+falseO2(g)=CuO(s)+falseC12(g) ?H2=-25 kJ.mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ?AH3=-120 kJ .mol-1
则4HClg)+O2 (g)=2C12(g)十2H2O(g)的?H=_________kJ.mol-1。
化 学
可能用到的原子量:H-1 C-12
第Ⅰ卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意)
1.在压强为2.20×101 kPa、温度达到374 ℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
A.二氧化碳与超临界水作用生成汽油的反应,属于吸热反应
B.“水热反应”过程中只有化学变化,没有物理变化
C.火力发电厂有望利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
2.在测定中和热的实验中,下列说法不正确的是( )
A.在测定中和热实验中需要使用的仪器有天平、量筒﹑烧杯、滴定管、温度计
B.为了准确测定反应混合溶液的温度,实验中温度计水银球不能与小烧杯底部接触
C.用50 mL 0.55 mol ·L-1的NaOH 溶液与60 mL 0.50 mol ·L-1的盐酸反应,
测得的中和热数值不变
D.使用环形玻璃搅拌棒是为了加大反应速率,减小实验误差
3.2A(g)?B(g) ?H1(?H1>0);2A(g)?B(1)?H2。下列能量变化示意图正确的是( )
4.已知 1 mol X2 (g)完全燃烧生成 X2O(g)放出能量a kJ,且X2中 l mol X-X键断裂时吸收能量b kJ,氧气中 l mol O=O键断裂时吸收能量ckJ,则X2O中 l mol X-O键形成时放出的能量为( )
A.falsekJ BfalseKJ C.falsekJ D.false kJ
5.已知“凡气体分子总数增大的反应一定是熵增加的反应”。下列反应一定能自发进行的是( )
A.2O3(g)=302(g) ?H<0 B.2CO(g)=2C(s)+O2 (g) ?H>0
C.N2(g)+3H2(g)?2NH3(g) ?H<0 D.CaCO3(s)=CaO(s)+CO2(g) ?H>0
6.反应P(g)+3Q(g)?2R(l)+2S(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
A.V(P)=0.15 mol/(L·min) B.V(Q)=0.6 mol/(L· min)
C.V(R)=0. 1 mol/(L·s) D.V(S)=0.45 mol/(L· min)
7.在一定条件下,将2 mol A和1 mol B混合于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g)?xC(g)+2D(g),5s时测得气体压强是反应前的false。则x为( )
A.1 B.2 C.3 D.条件不足,无法计算
8.在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应A(s) +2B(g)?C(g)+D(g)已达到平衡状态的是( )。
A.混合气体的压强
B.混合气体的密度
C.气体的总物质的量
D.单位时间内生成n mol C的同时消耗2n mol B
9.密闭容器中一定量的混合气体发生以下反应:
xA(g)十yB(g)?zC(g),平衡时测得A的浓度为0.50 mol.L-1,在温度不变时,把容器容积扩
大到原来的2倍,使其重新达到平衡,此时A的浓度为0.30 mol.L-1,下列叙述正确的是( )
A.平衡一定向右移动 B.B的转化率降低
C.x+y
根据表中数据,下列说法不正确的是( )
升高温度,反应速率加快
增大压强,反应速率加快
C.在1.0×105 Pa、90℃条件下,当转化率为98%时反应不一定达到平衡
D.若进入反应塔的混合气体为a mol,反应速率以V=?n/?t表示,则在8.0×105Pa、 30℃条件下,转化率从50%增至90%时段NO的反应速率为falsemol.s-1
11.在CH3COOH ?CH3COO- + H+的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是( )
A.加入 NaOH B.加入盐酸 C.加水 D.升高温度
12.下列实验事实或数据可以说明次氯酸为弱电解质的是( )
A.0.001 mol/L的HClO溶液的pH=3
B.次氯酸具有漂白性
C.温度为25℃时,次氯酸钠水溶液的pH>7
D.用HClO 的水溶液做导电实验时,灯泡很暗
13.若溶液中由水电离产生的c(OH-)=1×10-14 mol.L-1,满足此条件的溶液中一定不能
大量共存的离子组是( )
A13+ Na+ NO3- Cl-
B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- HCO3-
K+ Fe3+ SO42- NO3-
14.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考甲、乙两图,从下表中选出正确选项( )
15.下列说法正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液分别加热、蒸发、浓缩结晶、灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再加水稀释到所需的浓度
C.向CuCl2溶液中加入CuO,调节PH可除去溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
16. H2C2O4为二元弱酸,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,设H2C2O4溶液中 c(总)=c(H2C2O4)+c(HC2O4-)十c(C2O42-)。室温下用NaOH溶液滴定25.00 mL0.100 0 mol ·L-1 H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.1000 mol.L―1 H2C2O4溶液: c(H+) =0.100 0 mol.L-1+c(C2O42-)+c(OH-)+c(H2C2O4)
B.c(Na+)=c(总)的溶液:c(Na+)>c(H+)>c(C2O42-)>c(OH-)>c(H2C2O4)
C. pH=7的溶液: c(Na+ )=0.1000 mol.L-1+c(C2O42-))-c(H2C2O4)
D.c(Na+)=2c(总)的溶液:c(OH-)-c(H+ )=c(H2C2O4)+c(HC2O4-)
17.某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是( )
39179504445A.含有大量SO42-的溶液中肯定不存在Ag+
B.0.02 mol.L-1的 AgNO3溶液与0.2 mol.L-1的
Na2SO4溶液等体积混合会生成Ag2SO4沉淀
C.Ag2SO4的溶度积常数(Ksp)为2×10-5
D.a点表示Ag2 SO4的不饱和溶液,蒸发可以使溶液由a点变到b 点
有a、b、c、d四种金属,将a与b用导线连接起来,浸入稀硫酸中,负极反应式为b-2e-=b2+;将a,d分别投入等浓度的盐酸中,a比 d反应剧烈;又知一定条件下能发生离子反应:
c2++d=d2++c,则四种金属的活动性由强到弱的顺序是( )
A.dcab B.dabc C.dbac D. badc
19.如图所示,电流计G发生偏转,同时A极逐渐变细,B极逐渐变粗,C为电解质溶液,
则A、B、C应是下列各组中的( )
2667000-109220A.A是Zn、B是Cu、C为稀硫酸
B.A是Cu、B是Zn、C为稀硫酸
C.A是Fe、B是Ag、C为AgNO3溶液
D.A是Ag、B是Fe、C为AgNO3溶液
20.有关如图所示原电池的叙述正确的是( )。
电子沿导线由Ag片流向Cu
B.负极的电极反应式是Ag-e-=Ag+
C.Cu片上发生氧化反应,Ag 片上发生还原反应
D.反应时盐桥中的阳离子移向Cu(NO3)2溶液
第Ⅱ卷 (非选择题 60分)
21.(12分)化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫作反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列?H表示物质燃烧热的是_____;不能表示物质中和热的是_____。(填字母)
A.H2(g)+falseO2(g)=2H2O(g) ?H1 B.C(s)+falseO2(g)=CO(g) ?H2
C.CH4(g)+202g)=CO2(g)+2H2O(l) ?H3 D.C(s)+O2(g)=CO2(g) ?H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ?H5
F. NaOH(aq)+HCl( aq)=NaCl( aq)+H2O(l) ?H6
G.2NaOH(aq)+H2SO4( aq)=Na2SO4( aq)+2H2O(l) ?H7
CH3COOH(aq)+NaOH(aq)=CH3COONa( aq)十H2O(l) ?H8
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:___________________
充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100 mL浓度为4 mol.L-1的KOH 溶液完全反应生成正盐。则燃烧l mol丁烷放出的热量为 。
4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4 mol.L-1的KOH 溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是______mol
(5)氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76 、TiH1.73 .CeH2.69 、ZrH1.98.PrH2.65. TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840 体积的氢气(钯粉的密度为10.64 g. cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式: 。
22.(13分) 某同学在用稀硫酸与锌粒制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
( 1)上述实验中发生反应的化学方程式有:_________________________________
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________________
(3)实验室中现有Na2SO4, MgSO4,Ag2SO4,K2SO4四种溶液,可与上述实验中 CuSO4溶液起相似作用的
是____________
(4)要加快上述实验中气体产生的速率,还可采取的措施有_____________、____________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中: V2= ,V6= ,V10=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
__________________________________________________
(13分)(1)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+ 、OH-,存在的分子只有H2O,
根据题意回答下列问题。
①写出酸H2A的电离方程式:______________________
②若溶液M由10 mL 2 mol.L-1 NaHA 溶液与10 mL 2 mol .L-1 NaOH 溶液混合而得,则溶液M的pH_______(填“>”“<”或“=”)7,
溶液M中各粒子的浓度关系正确的是______(填序号)。
c( Na+) >c(A2- ) > c( OH-) >c(H+)
c( HA-)+2c(H2A)+c(H+)= c(OH-)
c(A2- ) +c(HA- )+c( OH- ) =c( Na+ )+c(H+)
c(A2- ) + c(HA-) = 1 mol.L-1
(2)实验室可用NaOH 溶液吸收 NO2,,反应为2NO2+2NaOH=NaNO3+ NaNO2+ H2O。含0.2 mol NaOH 的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1 mol. L-1的CH3COONa溶液,则两溶液中c(NO3- ) .c( NO2-)和 c(CH3COO-)由大到小的顺序为___________________________
(已知HNO2的电离常数Ka=7.1 ×10-4, CH3COOH 的电离常数K。=1.7 ×10-5)。
可使溶液A和溶液B的 pH相等的方法是______________________(填序号)。
向溶液A中加适量水 b.向溶液A中加适量 NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液(NaOH 溶液)吸收SO2的过程中, pH随n( SO32-):n( HSO3-)的变化关系如下表:
①由上表判断 NaHSO3溶液显____性。
②当吸收液呈中性时,溶液中离子浓度的大小关系为_____________________
24. (11分)α-铁纳米粉在现代电子工业上用途极为广泛,用赤铁矿石(含 Fe2O3, FeO,也含有 Al2O3,MnO2 ,CuO等)制备纳米铁颗粒的实验流程如下:
已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
回答以下问题:
实验流程中首先对赤铁矿进行“碾碎”,目的是_____________________
(2)固体A的成分是________________(填写化学式),在滤液A中加H2O2的目的是
_________________________(用离子方程式进行说明)。
(3)步骤②中需调节pH的范围是________________________________
(4)步骤③中灼烧所需的仪器有酒精灯、三脚架、_________________________(填仪器名称),
发生反应的化学方程式为_________________________
25.(11分)(1) Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴 CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0192。
3402965162560②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0250。
根据上述实验结果判断,还原CoO( s)为Co(s)的倾向是CO_____H2(填“大于”或“小于”)。
(2)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。右图为刚性容器中,进料浓度比c(HCl) :c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
①由图可推知该反应的?H______0(填>、<、=,下同)平衡常数K(300℃)_______K(400℃)
②曲线C代表进料浓度比c(HCl):c(O2)为___________
设HCl初始浓度为c。,根据进料浓度比c(HCl): c(O2)=4:1的数据计算K(400 ℃)=______________
(列出计算式)。
③按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过高的不利影响是___________
④Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+falseCl2(g) ?H1=+89kJ .mol-1
CuCl(s)+falseO2(g)=CuO(s)+falseC12(g) ?H2=-25 kJ.mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ?AH3=-120 kJ .mol-1
则4HClg)+O2 (g)=2C12(g)十2H2O(g)的?H=_________kJ.mol-1。
同课章节目录
