2020-2021学年人教版九年级化学下册9.3溶液的浓度 强化小测
文档属性
| 名称 | 2020-2021学年人教版九年级化学下册9.3溶液的浓度 强化小测 |  | |
| 格式 | docx | ||
| 文件大小 | 161.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-11 13:39:52 | ||
图片预览

文档简介
《溶液的浓度》小测
班级:
姓名:
座号:
成绩:
一、选择题(共12小题,每小题4分,共48分)
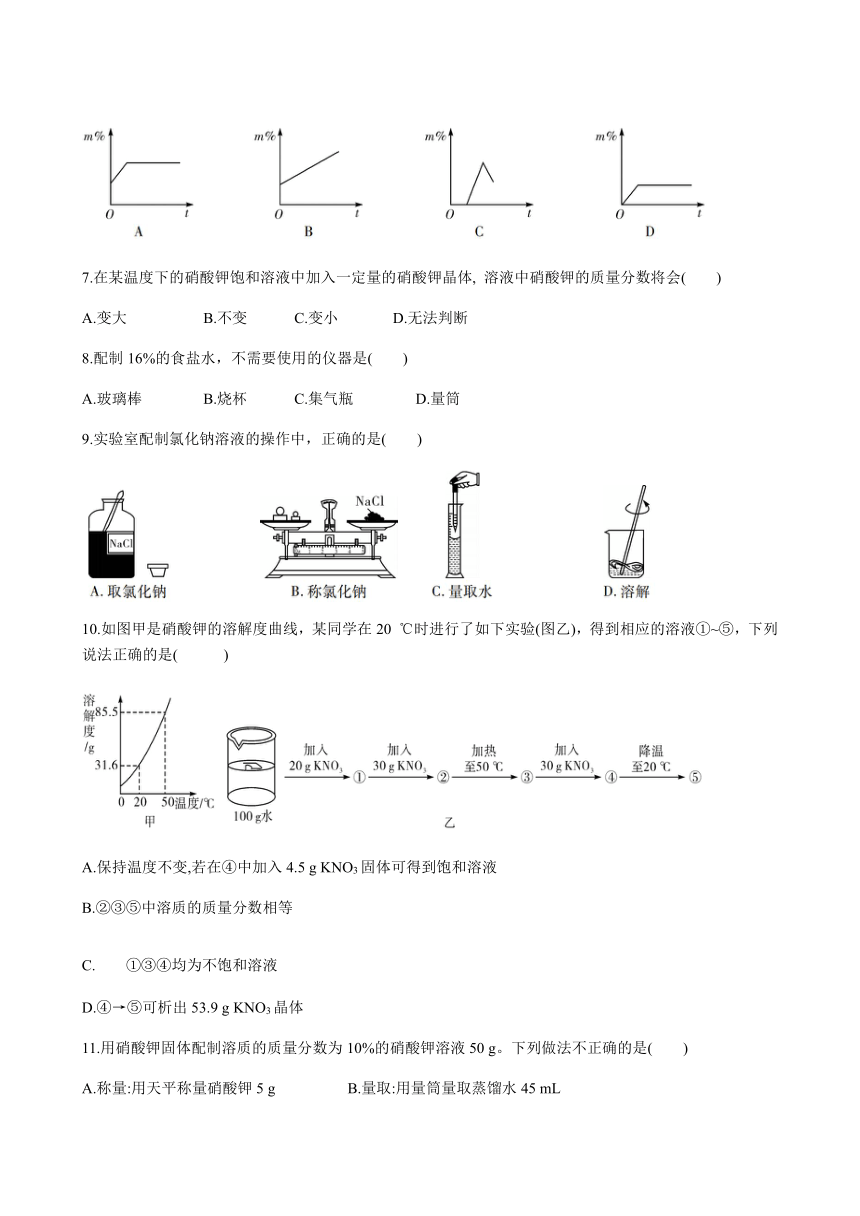
1.室温时,分别向含有100
mL水的M、N两个烧杯中加入5
g、10
g硫酸铜,如图所示。则下列说法正确的是( )
A.M烧杯中溶液的颜色浅,溶质质量分数大
B.M烧杯中溶液的颜色深,溶质质量分数小
C.N烧杯中溶液的颜色深,溶质质量分数大
D.N烧杯中溶液的颜色浅,溶质质量分数小
2.对溶质的质量分数是10%的NaCl溶液含义的解释错误的是( )
A.100
g水中溶解了10
g
NaCl
B.100
g
NaCl溶液中含有10
g
NaCl
C.NaCl与溶液质量之比是1∶10
D.将10
g
NaCl
溶于90
g水中所得溶液
3.冬天,人们常用甘油溶液护肤,使皮肤保持湿润,质量分数为80%的甘油溶液护肤效果最佳。配制80%的甘油溶液500
g,所需甘油的质量为( )
A.80
g
B.40
g
C.400
g
D.100
g
4.一定温度下,将溶液用水稀释,一定不发生变化的量是( )
A.溶液的质量
B.溶质的质量
C.溶剂的质量
D.溶质的质量分数
5.将50
g
98%的浓硫酸溶于450
g水中,所得溶液中溶质的质量分数为( )
A.9.8%
B.10.2%
C.10.8%
D.19.6%
6.保持温度不变,蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是( )
7.在某温度下的硝酸钾饱和溶液中加入一定量的硝酸钾晶体,
溶液中硝酸钾的质量分数将会( )
A.变大
B.不变
C.变小
D.无法判断
8.配制16%的食盐水,不需要使用的仪器是( )
A.玻璃棒
B.烧杯
C.集气瓶
D.量筒
9.实验室配制氯化钠溶液的操作中,正确的是( )
10.如图甲是硝酸钾的溶解度曲线,某同学在20
℃时进行了如下实验(图乙),得到相应的溶液①~⑤,下列说法正确的是(
)
A.保持温度不变,若在④中加入4.5
g
KNO3固体可得到饱和溶液
B.②③⑤中溶质的质量分数相等
C.①③④均为不饱和溶液
D.④→⑤可析出53.9
g
KNO3晶体
11.用硝酸钾固体配制溶质的质量分数为10%的硝酸钾溶液50
g。下列做法不正确的是( )
A.称量:用天平称量硝酸钾5
g
B.量取:用量筒量取蒸馏水45
mL
C.溶解:将硝酸钾倒入量筒中溶解
D.转移:将配好的溶液转移至试剂瓶
12.要配制100
g
5%的NaCl溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是( )
A.烧杯、试管、玻璃棒
B.烧杯、胶头滴管、玻璃棒
C.烧杯、胶头滴管、漏斗
D.烧杯、酒精灯、玻璃棒
二、填空题(52分)
13.(18分)为了使100g10%的硝酸钾溶液的质量分数增加到20%,有下列方法:增加
g硝酸钾;蒸发
g水;加入40%的硝酸钾溶液
g。
14.某化学兴趣小组同学为回收一块质量为40
g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100
g,烧杯内剩余固体27
g。请完成下列计算:
(1)40
g铜锌合金中锌的质量是___________g。?(6分)
(2)计算所用稀硫酸中溶质的质量分数。(28分)(H—1
O—16
S—32
Zn—64
Cu—
64
)
参考答案:
1.C
2.A
3.C
4.B
5.A
6.A
7.B
8.C
9.D
10.C
11.C
12.B
13.(1)25
(2)50
(3)50
14.解:(1)40g铜锌合金中锌的质量为40
g-27
g=13
g
(2)设所用稀硫酸中溶质的质量为x。
Zn
+
H2SO4
ZnSO4
+
H2↑
65
98
13
g
x
=
x=19.6
g
所用稀硫酸中溶质的质量分数:×100%=19.6%。
答:所用稀硫酸中溶质的质量分数是19.6%。
班级:
姓名:
座号:
成绩:
一、选择题(共12小题,每小题4分,共48分)
1.室温时,分别向含有100
mL水的M、N两个烧杯中加入5
g、10
g硫酸铜,如图所示。则下列说法正确的是( )
A.M烧杯中溶液的颜色浅,溶质质量分数大
B.M烧杯中溶液的颜色深,溶质质量分数小
C.N烧杯中溶液的颜色深,溶质质量分数大
D.N烧杯中溶液的颜色浅,溶质质量分数小
2.对溶质的质量分数是10%的NaCl溶液含义的解释错误的是( )
A.100
g水中溶解了10
g
NaCl
B.100
g
NaCl溶液中含有10
g
NaCl
C.NaCl与溶液质量之比是1∶10
D.将10
g
NaCl
溶于90
g水中所得溶液
3.冬天,人们常用甘油溶液护肤,使皮肤保持湿润,质量分数为80%的甘油溶液护肤效果最佳。配制80%的甘油溶液500
g,所需甘油的质量为( )
A.80
g
B.40
g
C.400
g
D.100
g
4.一定温度下,将溶液用水稀释,一定不发生变化的量是( )
A.溶液的质量
B.溶质的质量
C.溶剂的质量
D.溶质的质量分数
5.将50
g
98%的浓硫酸溶于450
g水中,所得溶液中溶质的质量分数为( )
A.9.8%
B.10.2%
C.10.8%
D.19.6%
6.保持温度不变,蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是( )
7.在某温度下的硝酸钾饱和溶液中加入一定量的硝酸钾晶体,
溶液中硝酸钾的质量分数将会( )
A.变大
B.不变
C.变小
D.无法判断
8.配制16%的食盐水,不需要使用的仪器是( )
A.玻璃棒
B.烧杯
C.集气瓶
D.量筒
9.实验室配制氯化钠溶液的操作中,正确的是( )
10.如图甲是硝酸钾的溶解度曲线,某同学在20
℃时进行了如下实验(图乙),得到相应的溶液①~⑤,下列说法正确的是(
)
A.保持温度不变,若在④中加入4.5
g
KNO3固体可得到饱和溶液
B.②③⑤中溶质的质量分数相等
C.①③④均为不饱和溶液
D.④→⑤可析出53.9
g
KNO3晶体
11.用硝酸钾固体配制溶质的质量分数为10%的硝酸钾溶液50
g。下列做法不正确的是( )
A.称量:用天平称量硝酸钾5
g
B.量取:用量筒量取蒸馏水45
mL
C.溶解:将硝酸钾倒入量筒中溶解
D.转移:将配好的溶液转移至试剂瓶
12.要配制100
g
5%的NaCl溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是( )
A.烧杯、试管、玻璃棒
B.烧杯、胶头滴管、玻璃棒
C.烧杯、胶头滴管、漏斗
D.烧杯、酒精灯、玻璃棒
二、填空题(52分)
13.(18分)为了使100g10%的硝酸钾溶液的质量分数增加到20%,有下列方法:增加
g硝酸钾;蒸发
g水;加入40%的硝酸钾溶液
g。
14.某化学兴趣小组同学为回收一块质量为40
g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100
g,烧杯内剩余固体27
g。请完成下列计算:
(1)40
g铜锌合金中锌的质量是___________g。?(6分)
(2)计算所用稀硫酸中溶质的质量分数。(28分)(H—1
O—16
S—32
Zn—64
Cu—
64
)
参考答案:
1.C
2.A
3.C
4.B
5.A
6.A
7.B
8.C
9.D
10.C
11.C
12.B
13.(1)25
(2)50
(3)50
14.解:(1)40g铜锌合金中锌的质量为40
g-27
g=13
g
(2)设所用稀硫酸中溶质的质量为x。
Zn
+
H2SO4
ZnSO4
+
H2↑
65
98
13
g
x
=
x=19.6
g
所用稀硫酸中溶质的质量分数:×100%=19.6%。
答:所用稀硫酸中溶质的质量分数是19.6%。
同课章节目录
