苏教版高中化学必修二专题三第一单元 3.石油炼制、乙烯课件(35张ppt)
文档属性
| 名称 | 苏教版高中化学必修二专题三第一单元 3.石油炼制、乙烯课件(35张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-11 20:26:31 | ||
图片预览









文档简介
(共35张PPT)
石油炼制
乙烯
专题三
有机化合物的获得与应用
第一单元
化石燃料和有机化合物
石油
——工业的血液
【阅读并思考】
石油是怎样形成的?
石油所含的元素主要有哪些?
石油主要由哪些物质组成?
石油是古代动植物遗体经过非常
复杂的变化而形成的。
是一种黑色或暗深棕色的粘稠的油状液体,不溶于水,有特殊气味,密度小于水,没有一定的熔点和沸点。
1、组成元素:
除C、H元素外,还含有少量的
O、N、S
等元素
2、组成化合物:主要是由各种烷烃、环烷烃
和芳香烃所组成的混合物
1、石油概述
3、状态:大部分是液态烃,同时溶有少量的气态烃、固态烃。没有固定的沸点.
注意:石油的化学成分随产地的不同而不同。
2、石油的炼制
实验室蒸馏石油
蒸
馏
烧
瓶
冷
凝
管
接液管
锥
形
瓶
温度计
酒
精
灯
铁架台
冷凝水出口
冷凝水进口
铁圈、石棉网
石油蒸馏
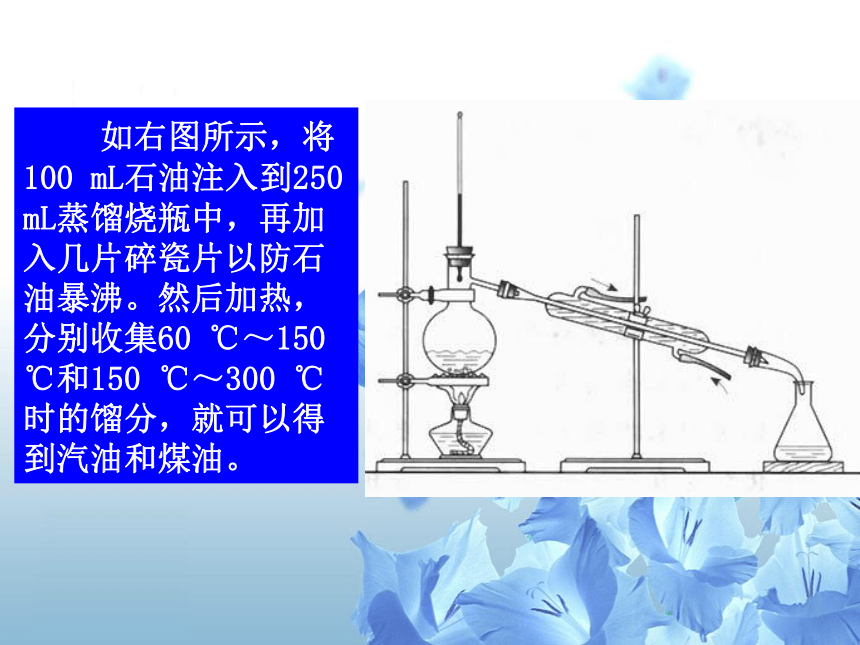
如右图所示,将100
mL石油注入到250
mL蒸馏烧瓶中,再加入几片碎瓷片以防石油暴沸。然后加热,分别收集60
℃~150
℃和150
℃~300
℃时的馏分,就可以得到汽油和煤油。
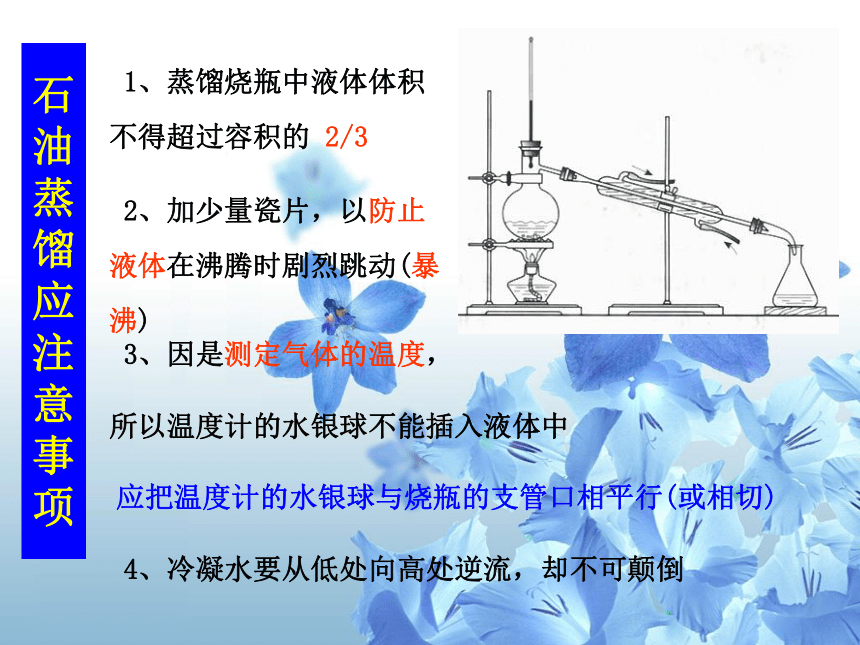
1、蒸馏烧瓶中液体体积不得超过容积的
2/3
2、加少量瓷片,以防止液体在沸腾时剧烈跳动(暴沸)
3、因是测定气体的温度,
所以温度计的水银球不能插入液体中
应把温度计的水银球与烧瓶的支管口相平行(或相切)
4、冷凝水要从低处向高处逆流,却不可颠倒
石油蒸馏应注意事项
原理:
各种纯净物都有自已固定的熔、沸点,当加热时,沸点低的物质先挥发变成气态,沸点高的物质不易挥发,而仍留在液体内,从而达到分离的目的。
蒸馏:适用于不同物质之间沸点相差较大的混合物的分离,精确蒸馏可得到纯净物。
分馏:适用于不同物质之间沸点相差较为接近的混合物的分离,得到的物质为混合物。
注意:
①
蒸馏与分馏的原理是一致的,都是物理变化,
混合物
▲
气体
冷凝
液体
气化
(1)蒸馏与分馏
石油分馏产品及用途示意图
石油的裂化
目的:提高汽油的产量和质量;
原理:在一定条件下,将相对分子质量较大的烃断裂为相对分子质量较小的烃的过程;
类型:催化裂化
C16H34
催化剂
加热、
加压
C8H18
辛烷
+
C8H16
辛烯
故裂化汽油中含有不饱和烃。
原料:
重油或石蜡
(2)石油的裂化和裂解
目的:为了获得更多的短链的不饱和气态烃(主要是乙烯)
衡量石油化工发展水平的重要标志
原理:采用比裂化更高的温度(700℃--1000℃),把具有长链的分子烃断裂成各种短链的气态烃的过程。
深度的裂化
注意:裂解气的成分:主要是乙烯还含有丙烯、异丁烯、甲烷、乙烷、异丁烷、硫化氢和碳的氧化物等。
石油的裂解
丁烷
丁烯
乙烯
乙烷
甲烷
丙烯
C4H8
2C2H4
催化剂
加热、
加压
乙烯
C4H10
CH4
+
C3H6
催化剂
加热、
加压
C8H18
C4H10
+
C4H8
催化剂
加热、
加压
C4H10
C2H4
+
C2H6
催化剂
加热、
加压
乙
烯
一、乙烯的模型
乙烷的模型
分子式
C2H4
C2H6
电子式
结构式
结构简式
分子内各原子的相对位置
2个碳原子和4个氢原子在
上
2个碳原子和6个氢原子在
上
分子式
C2H4
C2H6
电子式
结构式
结构简式
CH2=CH2
CH3-CH3
分子内各原子的相对位置
2个碳原子和4个氢原子在
同一平面上
2个碳原子和6个氢原子不在同一平面
上
H:C::C:H
H:C:C:H
H
H
..
..
..
..
..
..
H
H
H
H
H-C=C-H
H
H
H-C-C-H
H
H
H
H
乙烯与乙烷结构的对比
分子式
乙烷
乙烯
结构式
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子的位子
2C和4H在同一平面上
C—C
C=C
109?28ˊ
1.54
348
2C和6H不在同一平面上
120?
1.33
615
CH2=CH2
CH3-CH3
说
明:
3、C=C的键能并不是C-C的两倍,键长也不是C-C的1/2,说明C=C双键中有一个键不稳定,容易断裂,有一个键较稳定。
1、分子里含有碳碳双键或碳碳三键,碳原子
所结合的氢原子少于饱和链烃里的氢原子数,这样的烃叫做不饱和烃。
2、链烃分子里含有碳碳双键的不饱和烃称为
烯烃,乙烯是最简单的烯烃。
。
二、乙烯的性质
1.氧化反应
(1)将乙烯气体点燃
化学反应方程式:
(产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光)
常温下为无色、无味的气体,比空气轻,
难溶于水
乙烯的物理性质:
乙烯的化学性质:
[活动与探究]观察并记录下列实验现象,实验事实说明乙烯有什么性质?
实验1:把乙烯气体通入酸性高锰酸钾溶液中。
实验2:把乙烯气体通溴的四氯化碳或溴水溶液中。
实验现象
实验1
实验2
可使酸性高锰酸钾褪色
溴的红棕色很快褪去
可使酸性高锰酸钾褪色---
根据实验1归纳:
12KMnO4+18H2SO4+5C2H4→12MnSO4+6K2SO4+
10CO2↑+28
H2O
被氧化剂氧化
将乙烯气体通入溴的CCl4溶液或溴水中,可以见到溴的红棕色很快褪去,说明
根据实验2归纳:
乙烯是否被溴氧化?
乙烯与溴发生反应。
否,乙烯与溴发生了加成反应
有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应
2、乙烯的加成反应
完成:
CH2=CH2
+
H—H
→
CH2=CH2
+
H—X→
CH2=CH2
+
H—OH→
乙
炔
H
C
C
H
?
?
一、乙炔的结构
分子式
C2H2
电子式
结构式
H?C?C?H
二、乙炔的性质
物理性质
纯的乙炔是没有颜色、没有臭味的气体。密度是1.16克/升,
比空气稍轻。微溶于水,易溶于有机溶剂。
思考:根据乙炔物理性质如何收集乙炔气体?
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
1.
氧化反应
(1)
在空气或在氧气中燃烧—完全氧化
2C2H2
+
5O2
4CO2
+
2H2O
点燃
化学性质
甲烷、乙烯、乙炔的燃烧
????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
化学性质
1.
氧化反应
(1)
在空气或在氧气中燃烧
2C2H2
+
5O2
→4
CO2
+
2H2O
(2)
被氧化剂氧化
使酸性KMnO4溶液褪色
—完全氧化
点燃
2.加成反应
1,
2—二溴乙烯
1,
1,
2,
2—四溴乙烷
与氢气
书写下列化学方程式
CH2=CH2
CH?CH
+
H2
催化剂
CH2=CH2
+
H2
催化剂
CH3?CH3
CH2=CHCl
CH?CH
+
HCl
催化剂
3.乙炔的用途
(1)乙炔是一种重要的基本有机原料,可以
用来制备氯乙烯、聚氯乙烯和乙醛等。
CH2=CHCl
CH?CH
+
HCl
催化剂
nCH2=CH
Cl
加温、加压
催化剂
CH2?CH
Cl
n
(2)乙炔燃烧时产生的氧炔焰可用来切割或
焊接金属。
石油炼制
乙烯
专题三
有机化合物的获得与应用
第一单元
化石燃料和有机化合物
石油
——工业的血液
【阅读并思考】
石油是怎样形成的?
石油所含的元素主要有哪些?
石油主要由哪些物质组成?
石油是古代动植物遗体经过非常
复杂的变化而形成的。
是一种黑色或暗深棕色的粘稠的油状液体,不溶于水,有特殊气味,密度小于水,没有一定的熔点和沸点。
1、组成元素:
除C、H元素外,还含有少量的
O、N、S
等元素
2、组成化合物:主要是由各种烷烃、环烷烃
和芳香烃所组成的混合物
1、石油概述
3、状态:大部分是液态烃,同时溶有少量的气态烃、固态烃。没有固定的沸点.
注意:石油的化学成分随产地的不同而不同。
2、石油的炼制
实验室蒸馏石油
蒸
馏
烧
瓶
冷
凝
管
接液管
锥
形
瓶
温度计
酒
精
灯
铁架台
冷凝水出口
冷凝水进口
铁圈、石棉网
石油蒸馏
如右图所示,将100
mL石油注入到250
mL蒸馏烧瓶中,再加入几片碎瓷片以防石油暴沸。然后加热,分别收集60
℃~150
℃和150
℃~300
℃时的馏分,就可以得到汽油和煤油。
1、蒸馏烧瓶中液体体积不得超过容积的
2/3
2、加少量瓷片,以防止液体在沸腾时剧烈跳动(暴沸)
3、因是测定气体的温度,
所以温度计的水银球不能插入液体中
应把温度计的水银球与烧瓶的支管口相平行(或相切)
4、冷凝水要从低处向高处逆流,却不可颠倒
石油蒸馏应注意事项
原理:
各种纯净物都有自已固定的熔、沸点,当加热时,沸点低的物质先挥发变成气态,沸点高的物质不易挥发,而仍留在液体内,从而达到分离的目的。
蒸馏:适用于不同物质之间沸点相差较大的混合物的分离,精确蒸馏可得到纯净物。
分馏:适用于不同物质之间沸点相差较为接近的混合物的分离,得到的物质为混合物。
注意:
①
蒸馏与分馏的原理是一致的,都是物理变化,
混合物
▲
气体
冷凝
液体
气化
(1)蒸馏与分馏
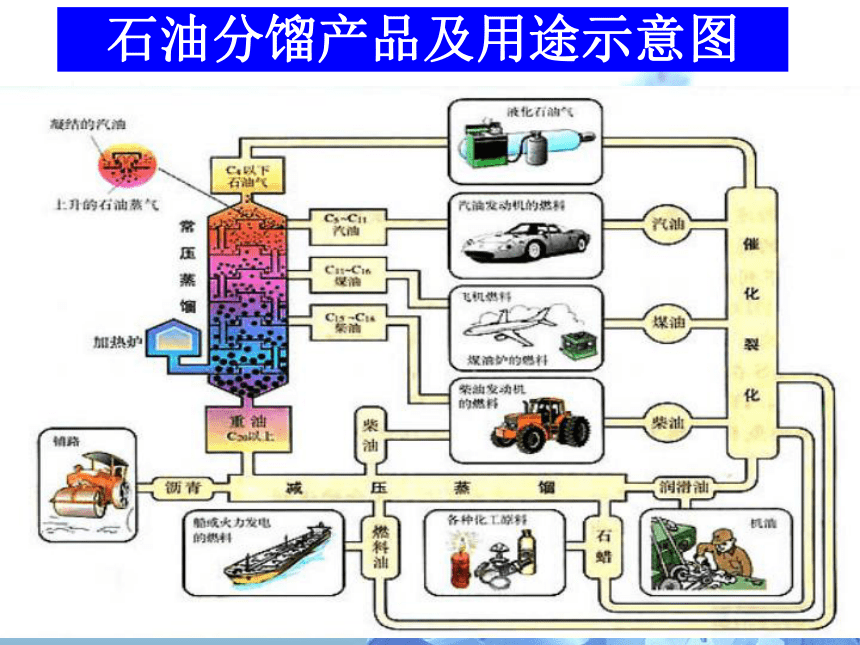
石油分馏产品及用途示意图
石油的裂化
目的:提高汽油的产量和质量;
原理:在一定条件下,将相对分子质量较大的烃断裂为相对分子质量较小的烃的过程;
类型:催化裂化
C16H34
催化剂
加热、
加压
C8H18
辛烷
+
C8H16
辛烯
故裂化汽油中含有不饱和烃。
原料:
重油或石蜡
(2)石油的裂化和裂解
目的:为了获得更多的短链的不饱和气态烃(主要是乙烯)
衡量石油化工发展水平的重要标志
原理:采用比裂化更高的温度(700℃--1000℃),把具有长链的分子烃断裂成各种短链的气态烃的过程。
深度的裂化
注意:裂解气的成分:主要是乙烯还含有丙烯、异丁烯、甲烷、乙烷、异丁烷、硫化氢和碳的氧化物等。
石油的裂解
丁烷
丁烯
乙烯
乙烷
甲烷
丙烯
C4H8
2C2H4
催化剂
加热、
加压
乙烯
C4H10
CH4
+
C3H6
催化剂
加热、
加压
C8H18
C4H10
+
C4H8
催化剂
加热、
加压
C4H10
C2H4
+
C2H6
催化剂
加热、
加压
乙
烯
一、乙烯的模型
乙烷的模型
分子式
C2H4
C2H6
电子式
结构式
结构简式
分子内各原子的相对位置
2个碳原子和4个氢原子在
上
2个碳原子和6个氢原子在
上
分子式
C2H4
C2H6
电子式
结构式
结构简式
CH2=CH2
CH3-CH3
分子内各原子的相对位置
2个碳原子和4个氢原子在
同一平面上
2个碳原子和6个氢原子不在同一平面
上
H:C::C:H
H:C:C:H
H
H
..
..
..
..
..
..
H
H
H
H
H-C=C-H
H
H
H-C-C-H
H
H
H
H
乙烯与乙烷结构的对比
分子式
乙烷
乙烯
结构式
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子的位子
2C和4H在同一平面上
C—C
C=C
109?28ˊ
1.54
348
2C和6H不在同一平面上
120?
1.33
615
CH2=CH2
CH3-CH3
说
明:
3、C=C的键能并不是C-C的两倍,键长也不是C-C的1/2,说明C=C双键中有一个键不稳定,容易断裂,有一个键较稳定。
1、分子里含有碳碳双键或碳碳三键,碳原子
所结合的氢原子少于饱和链烃里的氢原子数,这样的烃叫做不饱和烃。
2、链烃分子里含有碳碳双键的不饱和烃称为
烯烃,乙烯是最简单的烯烃。
。
二、乙烯的性质
1.氧化反应
(1)将乙烯气体点燃
化学反应方程式:
(产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光)
常温下为无色、无味的气体,比空气轻,
难溶于水
乙烯的物理性质:
乙烯的化学性质:
[活动与探究]观察并记录下列实验现象,实验事实说明乙烯有什么性质?
实验1:把乙烯气体通入酸性高锰酸钾溶液中。
实验2:把乙烯气体通溴的四氯化碳或溴水溶液中。
实验现象
实验1
实验2
可使酸性高锰酸钾褪色
溴的红棕色很快褪去
可使酸性高锰酸钾褪色---
根据实验1归纳:
12KMnO4+18H2SO4+5C2H4→12MnSO4+6K2SO4+
10CO2↑+28
H2O
被氧化剂氧化
将乙烯气体通入溴的CCl4溶液或溴水中,可以见到溴的红棕色很快褪去,说明
根据实验2归纳:
乙烯是否被溴氧化?
乙烯与溴发生反应。
否,乙烯与溴发生了加成反应
有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应
2、乙烯的加成反应
完成:
CH2=CH2
+
H—H
→
CH2=CH2
+
H—X→
CH2=CH2
+
H—OH→
乙
炔
H
C
C
H
?
?
一、乙炔的结构
分子式
C2H2
电子式
结构式
H?C?C?H
二、乙炔的性质
物理性质
纯的乙炔是没有颜色、没有臭味的气体。密度是1.16克/升,
比空气稍轻。微溶于水,易溶于有机溶剂。
思考:根据乙炔物理性质如何收集乙炔气体?
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
1.
氧化反应
(1)
在空气或在氧气中燃烧—完全氧化
2C2H2
+
5O2
4CO2
+
2H2O
点燃
化学性质
甲烷、乙烯、乙炔的燃烧
????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
化学性质
1.
氧化反应
(1)
在空气或在氧气中燃烧
2C2H2
+
5O2
→4
CO2
+
2H2O
(2)
被氧化剂氧化
使酸性KMnO4溶液褪色
—完全氧化
点燃
2.加成反应
1,
2—二溴乙烯
1,
1,
2,
2—四溴乙烷
与氢气
书写下列化学方程式
CH2=CH2
CH?CH
+
H2
催化剂
CH2=CH2
+
H2
催化剂
CH3?CH3
CH2=CHCl
CH?CH
+
HCl
催化剂
3.乙炔的用途
(1)乙炔是一种重要的基本有机原料,可以
用来制备氯乙烯、聚氯乙烯和乙醛等。
CH2=CHCl
CH?CH
+
HCl
催化剂
nCH2=CH
Cl
加温、加压
催化剂
CH2?CH
Cl
n
(2)乙炔燃烧时产生的氧炔焰可用来切割或
焊接金属。
