高中化学人教版(2019)第一章物质及其变化 第三节氧化还原反应课件40张ppt
文档属性
| 名称 | 高中化学人教版(2019)第一章物质及其变化 第三节氧化还原反应课件40张ppt |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-13 21:45:10 | ||
图片预览








文档简介
第一章 第三节
氧化还原反应
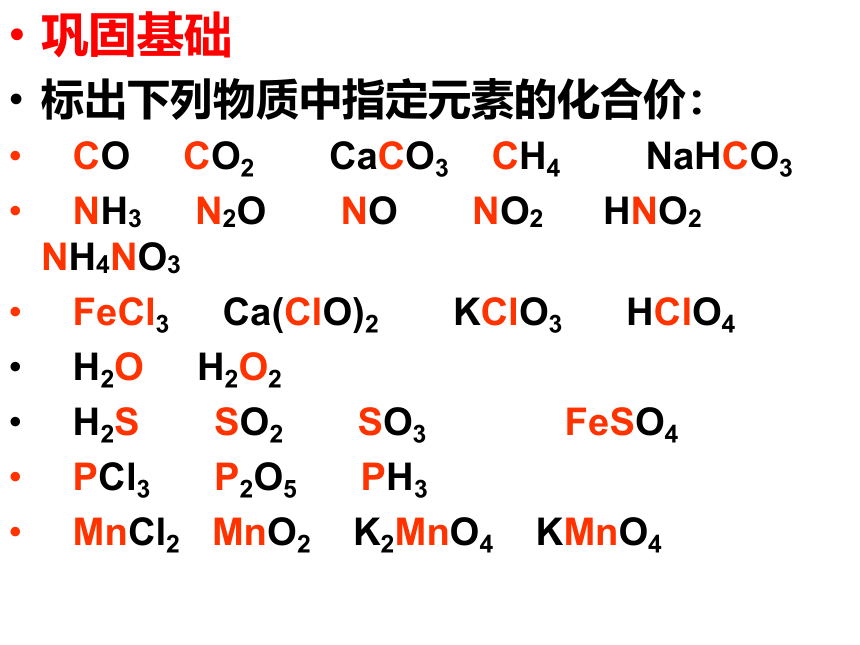
巩固基础
标出下列物质中指定元素的化合价:
CO CO2 CaCO3 CH4 NaHCO3
NH3 N2O NO NO2 HNO2 NH4NO3
FeCl3 Ca(ClO)2 KClO3 HClO4
H2O H2O2
H2S SO2 SO3 FeSO4
PCl3 P2O5 PH3
MnCl2 MnO2 K2MnO4 KMnO4
【思考与讨论】
Fe2O3+3CO = 2 Fe+3CO2↑
高温
2CuO + C=2Cu+CO2↑
高温
(1) 请根据初中学过的氧化反应和还原反应相应的知识,分析以下反应。
物质
反应物
发生的反应
(氧化反应和还原反应)
得氧物质
失氧物质
C
CuO
氧化反应
还原反应
思考:氧化反应和还原反应是分别独立进行的吗?为什么?
结论1:在同一个反应中:氧化反应和还原反应是同时发生的。这一类反应统称为——氧化还原反应。
CO
Fe2O3
1、从氧的得失角度分析氧化还原反应
【思考与讨论】
(2) 请标出下列反应化合价,比较反应前后化合价的变化
(3) 请分析上述2个反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。
结论2:
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
Fe2O3+3CO = 2 Fe+3CO2↑
2CuO + C=2Cu+CO2↑
高温
高温
2.从元素化合价升降的角度
分析氧化还原反应
探究1: 怎样判断一个反应是不是氧化还原反应?
【课堂练习】分析反应: H2+Cl2 =2HCl
Fe + CuSO4 = FeSO4 + Cu
2Na+Cl2 = 2NaCl
是不是氧化还原反应,为什么?
判断依据:有无元素化合价发生变化
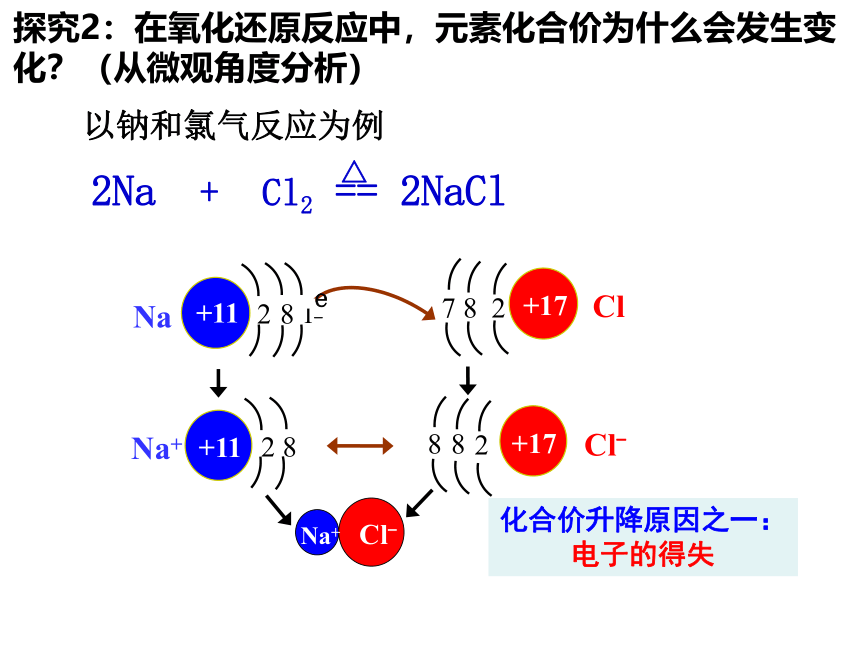
探究2:在氧化还原反应中,元素化合价为什么会发生变化?(从微观角度分析)
Na+ Cl-
化合价升降原因之一:
电子的得失
Na
Cl
+11
2
8
1
7 8 2
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
2Na + Cl2 == 2NaCl
△
以钠和氯气反应为例
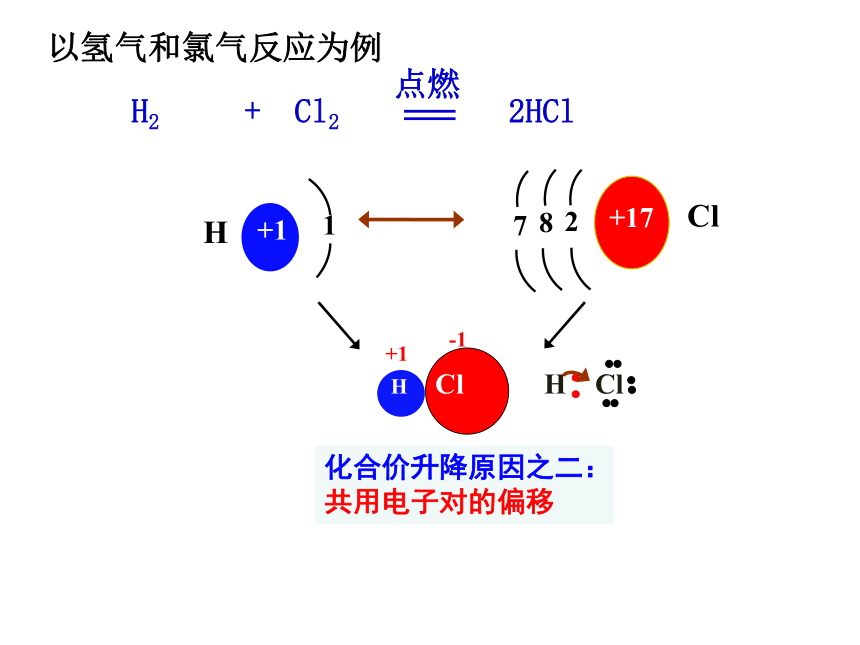
H Cl
H Cl
-1
化合价升降原因之二:
共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
+1
以氢气和氯气反应为例
H2 + Cl2 2HCl
点燃
元素的原子失去电子,则元素的化合价升高,物质被氧化,发生氧化反应
元素的原子得到电子,则元素的化合价降低,物质被还原,发生还原反应
总结:氧化还原反应的本质:电子转移(得失或偏移)
活动与思考:1、请判断下列反应是否是氧化还原反应?
1. 2NO + O2 ══ 2NO2
2. CO2 + CaO ══ CaCO3
3. NH4HCO3 ══ NH3↑ + CO2↑ + H2O
4. 2KClO3 ══ 2KCl + 3O2↑
5. Fe + 2HCl ══ FeCl2 + H2↑
6. Zn + CuSO4 ══ ZnSO4 + Cu
7. HCl + KOH ══ KCl + H2O
8. BaCl2 + Na2SO4 ══ BaSO4↓ + 2NaCl
√
×
√
√
√
×
×
×
MnO2
Δ
2、对于氧化还原反应,请指出被氧化和被还原的元素?
发生氧化反应和还原反应的物质?
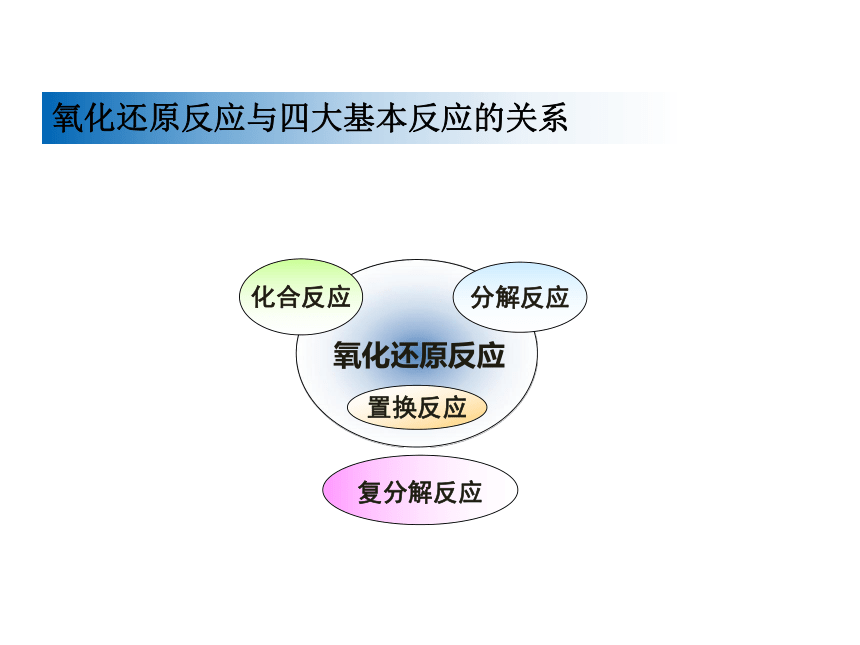
3、指出下列反应分别属于四种基本反应类型中的哪一种?
4、归纳氧化还原反应与四种基本反应类型的关系?
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
氧化还原反应与四大基本反应的关系
氧化还原反应电子转移的表示方法——1、双线桥法
例如:2Na+Cl2=2NaCl
步骤:
标价态,连双线,注得失
得失电子总数表示:原子个数 × 每个原子得失电子数(化合价之差)
注意:
0 0 +1-1
失去2 e-
得到2 e-
得电子总数=失电子总数 =电子转移总数
思考:怎样表示氧化还原反应中电子的转移?
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(4) 3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑+ 4H2O
(1) 2NaBr + Cl2 == 2NaCl + Br2
(6) 2H2S + SO2 == 3S↓ + 2H2O
(3) 2FeCl2 + Cl2 == 2FeCl3
(5) Cl2 + 2NaOH == NaCl + NaClO + H2O
(2) 2Al + 6HCl == 2AlCl3 + 3H2↑
(7)6HCl(浓) + KClO3 = 3Cl2↑+ KCl+3H2O
(8)H2S+H2SO4(浓)=S +SO2+2H2O
表示电子转移的方法
书写要点:
1. 箭头由反应物中化合价升高的元素,指向反应物中化合价降低的元素
2. 在线桥上表明电子转移总数,不用写出得失
氧化还原反应电子转移的表示方法——2、单线桥法
Fe
2
+
+
+3
+2
+4
0
2O3
3
O
C
3
C
O2
Fe
6e-
用单线桥法表示下列氧化还原反应
1)MnO2+4HCl(浓) == MnCl2+Cl2 ↑ +2H2O
△
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
通电
点燃
3)2Fe +3Cl2 == 2FeCl3
失去电子
(或电子对偏离
的物质)
得到电子
(或电子对偏向
的物质)
e-
还原剂
氧化剂
氧化还原反应的基本概念
1.氧化剂和还原剂
(1)氧化剂
①氧化剂是 电子(或电子对 )的物质,具有氧化性。
②氧化剂在反应时所含元素的化合价 ,本身被还原。
(2)还原剂
①还原剂是 电子(或电子对 )的物质,具有还原性。
②还原剂在反应时所含元素的化合价 ,本身被氧化。
得到
偏向
降低
失去
偏离
升高
2.氧化产物和还原产物
(1)氧化产物:还原剂被 生成的物质。
(2)还原产物:氧化剂被 生成的物质。
氧化
还原
二、氧化还原反应的基本概念
3、氧化性、还原性
思考1:氧化剂具有 性,
还原剂具有 性.
氧化
还原
思考2:S2-有氧化性吗? Fe3+ 有还原性吗? S 呢?
氧化性:物质得到电子的能力。越容易得到越强。
还原性:物质失去电子的能力。越容易失去越强。
元素处于最高价态:只有氧化性
元素处于最低价态:只有还原性
元素处于中间价态:既有氧化性又有还原性
还原剂
化合价升高
失电子
被氧化
发生氧化反应
氧化产物
氧化剂
化合价降低
得电子
被还原
发生还原反应
还原产物
还原剂 + 氧化剂 = 还原产物 + 氧化产物
记忆口诀:
整理与归纳
反应物
生成物
同时发生
电子:升 失 降 得
升 还原剂 氧化
降 氧化剂 还原
1)MnO2+4HCl(浓) == MnCl2+Cl2 ↑ +2H2O
△
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
通电
点燃
3)2Fe +3Cl2 == 2FeCl3
5)Cl2+2NaOH=NaCl+NaClO+H2O
4)2H2S+SO2=3S +2H2O
2HClO == 2HCl + O2
光照
6)
(7)6HCl(浓) + KClO3 = 3Cl2↑+ KCl+3H2O
1、指出下列反应的氧化剂、还原剂、氧化产物、还原产物
2、在氧化还原反应中,反应物不是氧化剂,就是还原剂;
生成物不是氧化产物,就是还原产物,这种说法对吗?
3、(4)、(7)方程式中氧化产物和还原产物的个数比?
4、(1)、(5)、(7)方程式中氧化剂和还原剂的个数比?
K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O
反应中,________是氧化剂;______是还原剂;
?_____元素被氧化;_______元素被还原;
______是氧化产物;______是还原产物;
电子转移的总数为__________。
6e-
K2Cr2O7
HCl
Cl
Cr
Cl2
CrCl3
巩固与提升
思考:此反应中HCl表现出的化学性质?(酸性?氧化性?
还原性?挥发性?)
常见氧化剂和还原剂
21
总原则:
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数目的多少
1.根据化学方程式判断:
氧化性:
氧化剂>氧化产物
还原性:
还原剂>还原产物
物质的氧化性或还原性强弱的比较:
【例题1】
反应① H2SO3+I2+H2O===2HI+H2SO4
反应② 2FeCl3+2HI===2FeCl2+I2+2HCl
请判断:H2SO3、I-、Fe2+三者还原性的强弱;
Fe3+、I2、H2SO4三者氧化性的强弱。
【答案】还原性:H2SO3>I->Fe2+;
氧化性:Fe3+>I2>H2SO4。
2.依据元素活动性顺序判断
(1)金属越活泼,其单质的还原性越强,
对应阳离子的氧化性逐渐减弱。
(2)非金属越活泼,其单质氧化性越强,
对应阴离子的还原性越弱。
氧化性:
F2> Cl2>Br2
H2+Cl2 光照 2HCl
H2+Br2 500℃ 2HBr
H2+F2 2HF
3、根据反应条件的不同进行判断
已知: 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl = MnCl2+Cl2↑+2H2O
O2+4HCl ==== 2H2O+2Cl2↑
△
△
催化剂
则: 氧化性 KMnO4> MnO2> O2
4.依据影响因素判断
(1)浓度:
同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCl>稀HCl。
(2)温度:
同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化(还原)性越强。
氧化性:KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
例如: 将氯水滴加到NaBr和KI的混合液中,
先发生的反应是:
后发生的反应是:
优先规律:
因为还原性 :KI>NaBr
一种氧化剂同时和几种还原剂相遇时,
先与还原性最强的物质反应;
一种还原剂同时和几种氧化剂相遇时,
先与氧化性最强的物质反应。
练习: 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A Mg B Cu C Ag D H2
C
氧化还原反应的规律:
氧化还原反应的规律:
守恒规律:
氧化还原反应中电子有失必有得
得电子总数=失电子总数。
(体现:化合价降低总数=化合价升高总数)
化合价升高或降低总数的计算:
变价元素原子的个数×一个该原子所变化合价
例:某溶液中含有a个Fe2+,若将其完全氧化成Fe3+,则需要酸性KMnO4多少个?(已知:酸性条件下高锰酸钾的还原产物为Mn2+)(用a表示)
例、Na2Sx在碱性溶液中可被NaClO氧化为
Na2SO4,而NaClO被还原为NaCl,若反应
中Na2Sx与NaClO的个数之比为1:16,
则x的值为:
A.2 B.3 C.4 D.5
D
二.氧化还原反应方程式的配平方法
基本原则
(1)得失电子守恒(2)质量守恒(3)电荷守恒
【例题1】正向配平:
H2S+HNO3―→S↓+NO↑+H2O
【练习1】
__KI+__KIO3+__H2SO4==__I2+__K2SO4+_H2O
3H2S+2HNO3===3S↓+2NO↑+4H2O
【答案】5 1 3 3 3 3
Cl2 + Ca(OH)2 = CaCl2 + Ca(ClO)2 + H2O
【例题2】逆向配平:
【练习2】
__S+__NaOH==__Na2S+__Na2SO3+__H2O
【答案】3 6 2 1 3
例3、部分氧化还原反应的配平:
Cu + HNO3(稀)—Cu(NO3)2 + NO↑+ H2O
练习3.
HCl(浓)+KMnO4 —KCl + MnCl2 + Cl2↑+ H2O
整体配平:
一种物质中有两种或以上元素化合价发生变化。
【例题4】__FeS2+__O2===__Fe2O3+__SO2
【答案】4 11 2 8
【例题5】缺项配平
将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
_NaBiO3+__Mn2++__→__Na++__Bi3++__MnO4-+__
缺项配平:给出的方程式,缺少一种或几种反应物(生成物),一般是H+或OH-或H2O,需要溶液环境判断。
【答案】 5 2 14H+ 5 5 2 7H2O
MnO4- + Cl- + ___ - Cl2 + Mn2++ ____(缺项配平
提示:酸性高锰酸钾和浓盐酸反应)
2 10 16 H+ 5 2 8H2O
(2)若每3个Cu2O可还原2个 HNO3,则X 是什么物质?
练习4:某反应中有下列物质 Cu2O HNO3 Cu(NO3)2 X H2O 问:
(1)该反应中还原剂为 氧化剂为 。
(3)写出配平化学方程式,并标出电子转移的方向和数目。
练习:配平下列化学方程式。
1、 NH3 + O2 - NO + H2O
2、(NH4)2SO4 - NH3 + SO2 + N2 + H2O
3、K2Cr2O7 + HCl(浓)- KCl + CrCl3+ H2O + Cl2↑
4、 I2 + Cl2 + H2O - HIO3 + HCl
4 5 4 6
3 4 3 1 6
1 14 2 2 7 3
1 5 6 2 10
5. HCl(浓) + KClO3 - ClO2↑+ Cl2↑+ KCl + H2O
6. Na2SO3 + Na2S + H2SO4 - Na2SO4 + S↓+ H2O
4 2 2 1 2 2
1 2 3 3 3 3
实验室制取少量的氮气,常利用的反应是NaNO2+NH4Cl NaCl+N2↑+2H2O。
关于该反应说法正确的是
A.NaNO2是还原剂
B.此化学方程式转移的电子为6 e-
C.NH4Cl中的氮元素被氧化
D.N2既是氧化剂又是还原剂
√
小试牛刀
例:已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A. 2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B. I2+SO2+2H2O===H2SO4+2HI
C. 2Fe2++I2===2Fe3++2I-
D. H2O2+SO2===H2SO4
还原剂
还原产物
还原剂
还原产物
还原剂
还原产物
还原剂
氧化剂
还原性:SO2>Fe2+
还原性:SO2>I-
还原性:Fe2+>I-
还原性:SO2>H2O2
小试牛刀
G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平)。
①G→Q + NaCl
② Q + H2O→X+H2
③Y + NaOH→G + Q + H2O
④ Z + NaOH→Q + X + H2O
这五种化合物中氯的化合价由低到高的顺序为:
G Y Q Z X
小试牛刀
氧化还原反应
巩固基础
标出下列物质中指定元素的化合价:
CO CO2 CaCO3 CH4 NaHCO3
NH3 N2O NO NO2 HNO2 NH4NO3
FeCl3 Ca(ClO)2 KClO3 HClO4
H2O H2O2
H2S SO2 SO3 FeSO4
PCl3 P2O5 PH3
MnCl2 MnO2 K2MnO4 KMnO4
【思考与讨论】
Fe2O3+3CO = 2 Fe+3CO2↑
高温
2CuO + C=2Cu+CO2↑
高温
(1) 请根据初中学过的氧化反应和还原反应相应的知识,分析以下反应。
物质
反应物
发生的反应
(氧化反应和还原反应)
得氧物质
失氧物质
C
CuO
氧化反应
还原反应
思考:氧化反应和还原反应是分别独立进行的吗?为什么?
结论1:在同一个反应中:氧化反应和还原反应是同时发生的。这一类反应统称为——氧化还原反应。
CO
Fe2O3
1、从氧的得失角度分析氧化还原反应
【思考与讨论】
(2) 请标出下列反应化合价,比较反应前后化合价的变化
(3) 请分析上述2个反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。
结论2:
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
Fe2O3+3CO = 2 Fe+3CO2↑
2CuO + C=2Cu+CO2↑
高温
高温
2.从元素化合价升降的角度
分析氧化还原反应
探究1: 怎样判断一个反应是不是氧化还原反应?
【课堂练习】分析反应: H2+Cl2 =2HCl
Fe + CuSO4 = FeSO4 + Cu
2Na+Cl2 = 2NaCl
是不是氧化还原反应,为什么?
判断依据:有无元素化合价发生变化
探究2:在氧化还原反应中,元素化合价为什么会发生变化?(从微观角度分析)
Na+ Cl-
化合价升降原因之一:
电子的得失
Na
Cl
+11
2
8
1
7 8 2
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
2Na + Cl2 == 2NaCl
△
以钠和氯气反应为例
H Cl
H Cl
-1
化合价升降原因之二:
共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
+1
以氢气和氯气反应为例
H2 + Cl2 2HCl
点燃
元素的原子失去电子,则元素的化合价升高,物质被氧化,发生氧化反应
元素的原子得到电子,则元素的化合价降低,物质被还原,发生还原反应
总结:氧化还原反应的本质:电子转移(得失或偏移)
活动与思考:1、请判断下列反应是否是氧化还原反应?
1. 2NO + O2 ══ 2NO2
2. CO2 + CaO ══ CaCO3
3. NH4HCO3 ══ NH3↑ + CO2↑ + H2O
4. 2KClO3 ══ 2KCl + 3O2↑
5. Fe + 2HCl ══ FeCl2 + H2↑
6. Zn + CuSO4 ══ ZnSO4 + Cu
7. HCl + KOH ══ KCl + H2O
8. BaCl2 + Na2SO4 ══ BaSO4↓ + 2NaCl
√
×
√
√
√
×
×
×
MnO2
Δ
2、对于氧化还原反应,请指出被氧化和被还原的元素?
发生氧化反应和还原反应的物质?
3、指出下列反应分别属于四种基本反应类型中的哪一种?
4、归纳氧化还原反应与四种基本反应类型的关系?
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
氧化还原反应与四大基本反应的关系
氧化还原反应电子转移的表示方法——1、双线桥法
例如:2Na+Cl2=2NaCl
步骤:
标价态,连双线,注得失
得失电子总数表示:原子个数 × 每个原子得失电子数(化合价之差)
注意:
0 0 +1-1
失去2 e-
得到2 e-
得电子总数=失电子总数 =电子转移总数
思考:怎样表示氧化还原反应中电子的转移?
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(4) 3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑+ 4H2O
(1) 2NaBr + Cl2 == 2NaCl + Br2
(6) 2H2S + SO2 == 3S↓ + 2H2O
(3) 2FeCl2 + Cl2 == 2FeCl3
(5) Cl2 + 2NaOH == NaCl + NaClO + H2O
(2) 2Al + 6HCl == 2AlCl3 + 3H2↑
(7)6HCl(浓) + KClO3 = 3Cl2↑+ KCl+3H2O
(8)H2S+H2SO4(浓)=S +SO2+2H2O
表示电子转移的方法
书写要点:
1. 箭头由反应物中化合价升高的元素,指向反应物中化合价降低的元素
2. 在线桥上表明电子转移总数,不用写出得失
氧化还原反应电子转移的表示方法——2、单线桥法
Fe
2
+
+
+3
+2
+4
0
2O3
3
O
C
3
C
O2
Fe
6e-
用单线桥法表示下列氧化还原反应
1)MnO2+4HCl(浓) == MnCl2+Cl2 ↑ +2H2O
△
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
通电
点燃
3)2Fe +3Cl2 == 2FeCl3
失去电子
(或电子对偏离
的物质)
得到电子
(或电子对偏向
的物质)
e-
还原剂
氧化剂
氧化还原反应的基本概念
1.氧化剂和还原剂
(1)氧化剂
①氧化剂是 电子(或电子对 )的物质,具有氧化性。
②氧化剂在反应时所含元素的化合价 ,本身被还原。
(2)还原剂
①还原剂是 电子(或电子对 )的物质,具有还原性。
②还原剂在反应时所含元素的化合价 ,本身被氧化。
得到
偏向
降低
失去
偏离
升高
2.氧化产物和还原产物
(1)氧化产物:还原剂被 生成的物质。
(2)还原产物:氧化剂被 生成的物质。
氧化
还原
二、氧化还原反应的基本概念
3、氧化性、还原性
思考1:氧化剂具有 性,
还原剂具有 性.
氧化
还原
思考2:S2-有氧化性吗? Fe3+ 有还原性吗? S 呢?
氧化性:物质得到电子的能力。越容易得到越强。
还原性:物质失去电子的能力。越容易失去越强。
元素处于最高价态:只有氧化性
元素处于最低价态:只有还原性
元素处于中间价态:既有氧化性又有还原性
还原剂
化合价升高
失电子
被氧化
发生氧化反应
氧化产物
氧化剂
化合价降低
得电子
被还原
发生还原反应
还原产物
还原剂 + 氧化剂 = 还原产物 + 氧化产物
记忆口诀:
整理与归纳
反应物
生成物
同时发生
电子:升 失 降 得
升 还原剂 氧化
降 氧化剂 还原
1)MnO2+4HCl(浓) == MnCl2+Cl2 ↑ +2H2O
△
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
通电
点燃
3)2Fe +3Cl2 == 2FeCl3
5)Cl2+2NaOH=NaCl+NaClO+H2O
4)2H2S+SO2=3S +2H2O
2HClO == 2HCl + O2
光照
6)
(7)6HCl(浓) + KClO3 = 3Cl2↑+ KCl+3H2O
1、指出下列反应的氧化剂、还原剂、氧化产物、还原产物
2、在氧化还原反应中,反应物不是氧化剂,就是还原剂;
生成物不是氧化产物,就是还原产物,这种说法对吗?
3、(4)、(7)方程式中氧化产物和还原产物的个数比?
4、(1)、(5)、(7)方程式中氧化剂和还原剂的个数比?
K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O
反应中,________是氧化剂;______是还原剂;
?_____元素被氧化;_______元素被还原;
______是氧化产物;______是还原产物;
电子转移的总数为__________。
6e-
K2Cr2O7
HCl
Cl
Cr
Cl2
CrCl3
巩固与提升
思考:此反应中HCl表现出的化学性质?(酸性?氧化性?
还原性?挥发性?)
常见氧化剂和还原剂
21
总原则:
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数目的多少
1.根据化学方程式判断:
氧化性:
氧化剂>氧化产物
还原性:
还原剂>还原产物
物质的氧化性或还原性强弱的比较:
【例题1】
反应① H2SO3+I2+H2O===2HI+H2SO4
反应② 2FeCl3+2HI===2FeCl2+I2+2HCl
请判断:H2SO3、I-、Fe2+三者还原性的强弱;
Fe3+、I2、H2SO4三者氧化性的强弱。
【答案】还原性:H2SO3>I->Fe2+;
氧化性:Fe3+>I2>H2SO4。
2.依据元素活动性顺序判断
(1)金属越活泼,其单质的还原性越强,
对应阳离子的氧化性逐渐减弱。
(2)非金属越活泼,其单质氧化性越强,
对应阴离子的还原性越弱。
氧化性:
F2> Cl2>Br2
H2+Cl2 光照 2HCl
H2+Br2 500℃ 2HBr
H2+F2 2HF
3、根据反应条件的不同进行判断
已知: 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl = MnCl2+Cl2↑+2H2O
O2+4HCl ==== 2H2O+2Cl2↑
△
△
催化剂
则: 氧化性 KMnO4> MnO2> O2
4.依据影响因素判断
(1)浓度:
同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCl>稀HCl。
(2)温度:
同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化(还原)性越强。
氧化性:KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
例如: 将氯水滴加到NaBr和KI的混合液中,
先发生的反应是:
后发生的反应是:
优先规律:
因为还原性 :KI>NaBr
一种氧化剂同时和几种还原剂相遇时,
先与还原性最强的物质反应;
一种还原剂同时和几种氧化剂相遇时,
先与氧化性最强的物质反应。
练习: 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A Mg B Cu C Ag D H2
C
氧化还原反应的规律:
氧化还原反应的规律:
守恒规律:
氧化还原反应中电子有失必有得
得电子总数=失电子总数。
(体现:化合价降低总数=化合价升高总数)
化合价升高或降低总数的计算:
变价元素原子的个数×一个该原子所变化合价
例:某溶液中含有a个Fe2+,若将其完全氧化成Fe3+,则需要酸性KMnO4多少个?(已知:酸性条件下高锰酸钾的还原产物为Mn2+)(用a表示)
例、Na2Sx在碱性溶液中可被NaClO氧化为
Na2SO4,而NaClO被还原为NaCl,若反应
中Na2Sx与NaClO的个数之比为1:16,
则x的值为:
A.2 B.3 C.4 D.5
D
二.氧化还原反应方程式的配平方法
基本原则
(1)得失电子守恒(2)质量守恒(3)电荷守恒
【例题1】正向配平:
H2S+HNO3―→S↓+NO↑+H2O
【练习1】
__KI+__KIO3+__H2SO4==__I2+__K2SO4+_H2O
3H2S+2HNO3===3S↓+2NO↑+4H2O
【答案】5 1 3 3 3 3
Cl2 + Ca(OH)2 = CaCl2 + Ca(ClO)2 + H2O
【例题2】逆向配平:
【练习2】
__S+__NaOH==__Na2S+__Na2SO3+__H2O
【答案】3 6 2 1 3
例3、部分氧化还原反应的配平:
Cu + HNO3(稀)—Cu(NO3)2 + NO↑+ H2O
练习3.
HCl(浓)+KMnO4 —KCl + MnCl2 + Cl2↑+ H2O
整体配平:
一种物质中有两种或以上元素化合价发生变化。
【例题4】__FeS2+__O2===__Fe2O3+__SO2
【答案】4 11 2 8
【例题5】缺项配平
将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
_NaBiO3+__Mn2++__→__Na++__Bi3++__MnO4-+__
缺项配平:给出的方程式,缺少一种或几种反应物(生成物),一般是H+或OH-或H2O,需要溶液环境判断。
【答案】 5 2 14H+ 5 5 2 7H2O
MnO4- + Cl- + ___ - Cl2 + Mn2++ ____(缺项配平
提示:酸性高锰酸钾和浓盐酸反应)
2 10 16 H+ 5 2 8H2O
(2)若每3个Cu2O可还原2个 HNO3,则X 是什么物质?
练习4:某反应中有下列物质 Cu2O HNO3 Cu(NO3)2 X H2O 问:
(1)该反应中还原剂为 氧化剂为 。
(3)写出配平化学方程式,并标出电子转移的方向和数目。
练习:配平下列化学方程式。
1、 NH3 + O2 - NO + H2O
2、(NH4)2SO4 - NH3 + SO2 + N2 + H2O
3、K2Cr2O7 + HCl(浓)- KCl + CrCl3+ H2O + Cl2↑
4、 I2 + Cl2 + H2O - HIO3 + HCl
4 5 4 6
3 4 3 1 6
1 14 2 2 7 3
1 5 6 2 10
5. HCl(浓) + KClO3 - ClO2↑+ Cl2↑+ KCl + H2O
6. Na2SO3 + Na2S + H2SO4 - Na2SO4 + S↓+ H2O
4 2 2 1 2 2
1 2 3 3 3 3
实验室制取少量的氮气,常利用的反应是NaNO2+NH4Cl NaCl+N2↑+2H2O。
关于该反应说法正确的是
A.NaNO2是还原剂
B.此化学方程式转移的电子为6 e-
C.NH4Cl中的氮元素被氧化
D.N2既是氧化剂又是还原剂
√
小试牛刀
例:已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A. 2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B. I2+SO2+2H2O===H2SO4+2HI
C. 2Fe2++I2===2Fe3++2I-
D. H2O2+SO2===H2SO4
还原剂
还原产物
还原剂
还原产物
还原剂
还原产物
还原剂
氧化剂
还原性:SO2>Fe2+
还原性:SO2>I-
还原性:Fe2+>I-
还原性:SO2>H2O2
小试牛刀
G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平)。
①G→Q + NaCl
② Q + H2O→X+H2
③Y + NaOH→G + Q + H2O
④ Z + NaOH→Q + X + H2O
这五种化合物中氯的化合价由低到高的顺序为:
G Y Q Z X
小试牛刀
