高中化学人教版(2019)必修二专题6 第1单元 第3课时 化学反应的限度化学平衡状态 课件(18张ppt
文档属性
| 名称 | 高中化学人教版(2019)必修二专题6 第1单元 第3课时 化学反应的限度化学平衡状态 课件(18张ppt |

|
|
| 格式 | zip | ||
| 文件大小 | 185.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-13 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
专题6
化学反应与能量变化
第一单元 化学反应速率与反应限度
第3课时 化学反应的限度 化学平衡状态
你知道吗?
新制的氯水中有哪些微粒?
Cl2、H2O、H+、Cl-、HClO、ClO-
为什么氯水中有这么多微粒?
因为Cl2能和H2O发生可逆反应:
Cl2
+
H2O
HCl
+
HClO
说明:反应不可能完全进行到底,即反应有一定的限度
HClO H+
+
ClO-
活动与探究p7
实验步骤
实验现象
实验结论
①FeCl3+KI
②在①中加CCl4振荡、静置
③取②的上层溶液,滴加KSCN溶液
发生了反应
溶液由黄色变为棕黄色
分层,上层:浅绿色
下层:紫红色
有I2、Fe2+生成
溶液呈血红色
下层溶液中有Fe3+
FeCl3溶液与KI溶液的反应
可见:此反应没有进行到底,
该反应有一定的限度。
2Fe3++2I-
=2Fe2++I2
是否为完全反应?
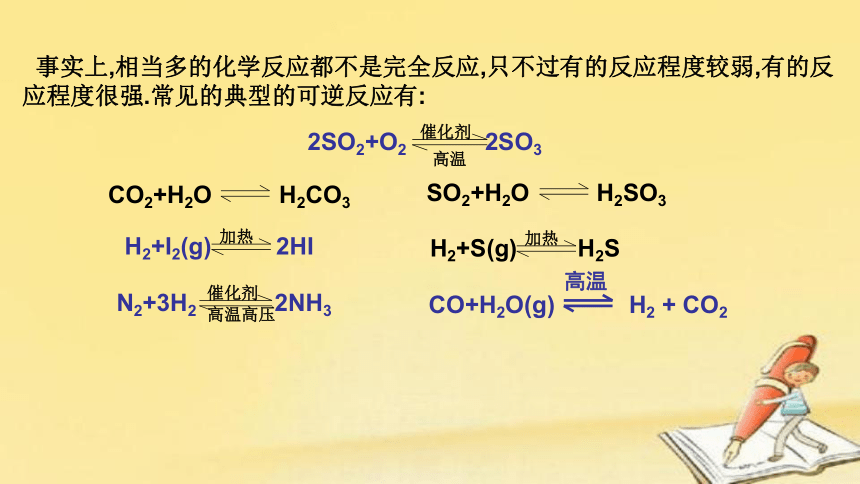
事实上,相当多的化学反应都不是完全反应,只不过有的反应程度较弱,有的反应程度很强.常见的典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
CO2+H2O
H2CO3
H2+I2(g)
2HI
加热
SO2+H2O
H2SO3
H2+S(g)
H2S
加热
CO+H2O(g)
H2
+
CO2
高温
一、化学反应的限度
(1)定义:在相同条件下同时向正、反两个方向进行的反应。
(2)正反应:从左到右进行的反应
(3)逆反应:从右到左进行的反应
可逆反应用“
”表示
1、可逆反应
2、特点:可逆反应不可能完全进行到底,任意时刻,反应体系中同时存在反应物和生成物。
3、判断依据:反应物与生成物共存。
化学平衡的概念
时间
速率
O
·
·
时间
浓度
O
·
·
v正
v逆
t1
t1
反应物
生成物
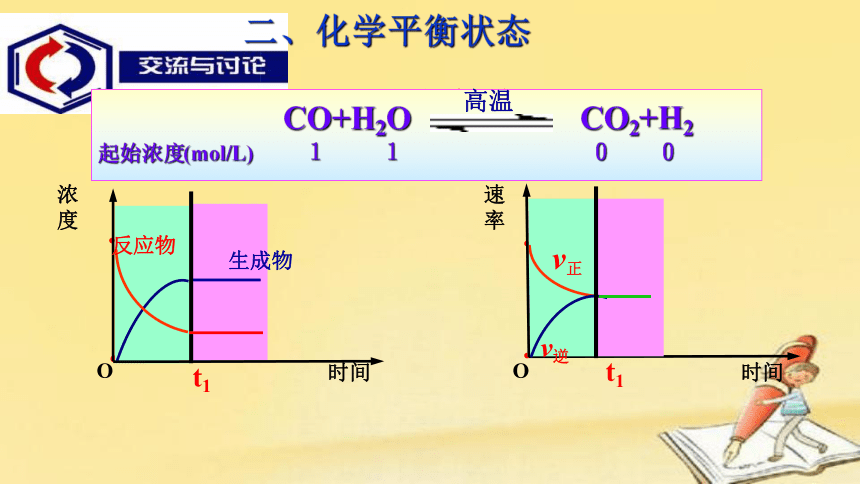
CO+H2O
CO2+H2
起始浓度(mol/L) 1 1 0 0
高温
二、化学平衡状态
2.化学平衡状态的特征
动
动态平衡:V(正)
≠0;V(逆)
≠0
等
定
变
V(正)=V(逆)
≠0
c(B)或n(B)或φ(B)一定
条件改变→平衡改变
逆
化学平衡的研究对象是可逆反应
二、化学平衡状态
指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
1.化学平衡状态的定义
本质特征
外在表现
(1)υ正
=
υ逆
(本质特征)
①
同一种物质:该物质的生成速率等于它的消耗速率。
②
不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。(即一正一逆)
3.化学平衡状态的标志
二、化学平衡状态
【例1】下列说法可以证明反应N2+3H2
2NH3
已达平衡状态的是(
)
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
AC
(2)反应混合物中各组成成分的含量保持不变(外部表现):
①
各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
②
各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③反应物的转化率、产物的产率保持不变。
④若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
二、化学平衡状态
【例2】在一定条件下,可以说明在密闭容器中可逆反应:
2SO2(气)+O2(气)
2SO3(气)
,
已经达平衡状态的事实是(
)
SO3不再分解
SO2的消耗速率和SO3的生成速率相等
C.
SO2和SO3的物质的量浓度相等
D.反应容器内SO3的物质的量不随时间而变化
D
二、化学平衡状态
1、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(气)+3B(气)
2C(气)+D(气)已达平衡状态的是
(
)
A.反应器内A、B、C、D四种气体共存
B.单位时间内生成n
mol
A的同时生成2n
mol
C
C.A、B、C、D的物质的量浓度之比为1:3:2:1
D.
3V正(B)=2V逆(C)
B
练习
是否
平衡
正、逆反应速率关系
在单位时间内消耗了mmolA的同时生成了mmolA
在单位时间内消耗了nmolB的同时消耗了pmolC
在单位时间内生成了nmolB的同时消耗了qmolD
ひ(A)
?ひ(B)
?ひ(C)
?ひ(D)
==
m
?
n
?
p
?
q
ひ正不一定等于ひ逆
mA(g)
+
n
B(g)
p
C(g)
+q
D(g)
不一定
不一定
平
衡
平
衡
小结:化学平衡状态的判断
对同一物质,正逆速率相等;对不同物质,正逆速率比等于化学计量数比则达平衡。
是
否
平
衡
混合体系中各组分的
含量
各物质的物质的量或物质的量的分数一定
各物质的质量或质量分数一定
各气体的体积或体积分数一定
总体积、总物质的量、总压强一定(拓展提高)
mA(g)
+
n
B(g)
pC(g)
+q
D(g)
平
衡
平
衡
平
衡
不一定
某种物理量,正(逆)向反应会变,则其不变,则达平衡;反之,不一定。
小结:化学平衡状态的判断
是
否
平
衡
总物质的量或压强
当m
+
n≠p
+
q
时,总物质的量或压强一定(其它条件一定)
当m
+
n
=p
+
q
时,总物质的量或压强一定(其它条件一定)
混合气体的平均M
当
m
+
n≠
p
+
q
时,M一定
当
m
+
n
=
p
+
q
时,M一定
mA(g)
+
nB(g)
pC(g)
+qD(g)
不一定
不一定
平
衡
平
衡
某种物理量,正(逆)向反应会变,则其不变,则达平衡;反之,不一定。
小结:化学平衡状态的判断
拓展提高
注意化学反应的特点
密度
ρ
C(s)+CO2(g)
2CO(g)
(ρ一定)
N2(g)+3H2(g)
2NH3(g)
(ρ一定)
H2(g)+I2(g)
2HI(g)
(ρ一定)
不一定
不一定
平
衡
某种物理量,正(逆)向反应会变,则其不变,则达平衡;反之,不一定。
小结:化学平衡状态的判断
拓展提高
专题6
化学反应与能量变化
第一单元 化学反应速率与反应限度
第3课时 化学反应的限度 化学平衡状态
你知道吗?
新制的氯水中有哪些微粒?
Cl2、H2O、H+、Cl-、HClO、ClO-
为什么氯水中有这么多微粒?
因为Cl2能和H2O发生可逆反应:
Cl2
+
H2O
HCl
+
HClO
说明:反应不可能完全进行到底,即反应有一定的限度
HClO H+
+
ClO-
活动与探究p7
实验步骤
实验现象
实验结论
①FeCl3+KI
②在①中加CCl4振荡、静置
③取②的上层溶液,滴加KSCN溶液
发生了反应
溶液由黄色变为棕黄色
分层,上层:浅绿色
下层:紫红色
有I2、Fe2+生成
溶液呈血红色
下层溶液中有Fe3+
FeCl3溶液与KI溶液的反应
可见:此反应没有进行到底,
该反应有一定的限度。
2Fe3++2I-
=2Fe2++I2
是否为完全反应?
事实上,相当多的化学反应都不是完全反应,只不过有的反应程度较弱,有的反应程度很强.常见的典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
CO2+H2O
H2CO3
H2+I2(g)
2HI
加热
SO2+H2O
H2SO3
H2+S(g)
H2S
加热
CO+H2O(g)
H2
+
CO2
高温
一、化学反应的限度
(1)定义:在相同条件下同时向正、反两个方向进行的反应。
(2)正反应:从左到右进行的反应
(3)逆反应:从右到左进行的反应
可逆反应用“
”表示
1、可逆反应
2、特点:可逆反应不可能完全进行到底,任意时刻,反应体系中同时存在反应物和生成物。
3、判断依据:反应物与生成物共存。
化学平衡的概念
时间
速率
O
·
·
时间
浓度
O
·
·
v正
v逆
t1
t1
反应物
生成物
CO+H2O
CO2+H2
起始浓度(mol/L) 1 1 0 0
高温
二、化学平衡状态
2.化学平衡状态的特征
动
动态平衡:V(正)
≠0;V(逆)
≠0
等
定
变
V(正)=V(逆)
≠0
c(B)或n(B)或φ(B)一定
条件改变→平衡改变
逆
化学平衡的研究对象是可逆反应
二、化学平衡状态
指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
1.化学平衡状态的定义
本质特征
外在表现
(1)υ正
=
υ逆
(本质特征)
①
同一种物质:该物质的生成速率等于它的消耗速率。
②
不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。(即一正一逆)
3.化学平衡状态的标志
二、化学平衡状态
【例1】下列说法可以证明反应N2+3H2
2NH3
已达平衡状态的是(
)
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
AC
(2)反应混合物中各组成成分的含量保持不变(外部表现):
①
各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
②
各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③反应物的转化率、产物的产率保持不变。
④若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
二、化学平衡状态
【例2】在一定条件下,可以说明在密闭容器中可逆反应:
2SO2(气)+O2(气)
2SO3(气)
,
已经达平衡状态的事实是(
)
SO3不再分解
SO2的消耗速率和SO3的生成速率相等
C.
SO2和SO3的物质的量浓度相等
D.反应容器内SO3的物质的量不随时间而变化
D
二、化学平衡状态
1、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(气)+3B(气)
2C(气)+D(气)已达平衡状态的是
(
)
A.反应器内A、B、C、D四种气体共存
B.单位时间内生成n
mol
A的同时生成2n
mol
C
C.A、B、C、D的物质的量浓度之比为1:3:2:1
D.
3V正(B)=2V逆(C)
B
练习
是否
平衡
正、逆反应速率关系
在单位时间内消耗了mmolA的同时生成了mmolA
在单位时间内消耗了nmolB的同时消耗了pmolC
在单位时间内生成了nmolB的同时消耗了qmolD
ひ(A)
?ひ(B)
?ひ(C)
?ひ(D)
==
m
?
n
?
p
?
q
ひ正不一定等于ひ逆
mA(g)
+
n
B(g)
p
C(g)
+q
D(g)
不一定
不一定
平
衡
平
衡
小结:化学平衡状态的判断
对同一物质,正逆速率相等;对不同物质,正逆速率比等于化学计量数比则达平衡。
是
否
平
衡
混合体系中各组分的
含量
各物质的物质的量或物质的量的分数一定
各物质的质量或质量分数一定
各气体的体积或体积分数一定
总体积、总物质的量、总压强一定(拓展提高)
mA(g)
+
n
B(g)
pC(g)
+q
D(g)
平
衡
平
衡
平
衡
不一定
某种物理量,正(逆)向反应会变,则其不变,则达平衡;反之,不一定。
小结:化学平衡状态的判断
是
否
平
衡
总物质的量或压强
当m
+
n≠p
+
q
时,总物质的量或压强一定(其它条件一定)
当m
+
n
=p
+
q
时,总物质的量或压强一定(其它条件一定)
混合气体的平均M
当
m
+
n≠
p
+
q
时,M一定
当
m
+
n
=
p
+
q
时,M一定
mA(g)
+
nB(g)
pC(g)
+qD(g)
不一定
不一定
平
衡
平
衡
某种物理量,正(逆)向反应会变,则其不变,则达平衡;反之,不一定。
小结:化学平衡状态的判断
拓展提高
注意化学反应的特点
密度
ρ
C(s)+CO2(g)
2CO(g)
(ρ一定)
N2(g)+3H2(g)
2NH3(g)
(ρ一定)
H2(g)+I2(g)
2HI(g)
(ρ一定)
不一定
不一定
平
衡
某种物理量,正(逆)向反应会变,则其不变,则达平衡;反之,不一定。
小结:化学平衡状态的判断
拓展提高
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
