人教版(2019)高一化学必修第一册 第二章 第一节 钠及其化合物 第1课时 钠(24张PPT)
文档属性
| 名称 | 人教版(2019)高一化学必修第一册 第二章 第一节 钠及其化合物 第1课时 钠(24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-13 21:50:28 | ||
图片预览






文档简介
(共24张PPT)
第二章 海水中的重要元素----钠和氯
第一节 钠及其化合物
第1课时 钠
在人类社会的发展过程中,金属起着重要的作用。人类在五千年前就开始使用青铜器,三千年前开始使用铁器,20世纪开始使用铝器。为什么人类使用金属的顺序是青铜、铁器、铝器,而不是其他顺序呢?
1.了解金属的通性。
2.掌握钠氧气的反应。(重点)
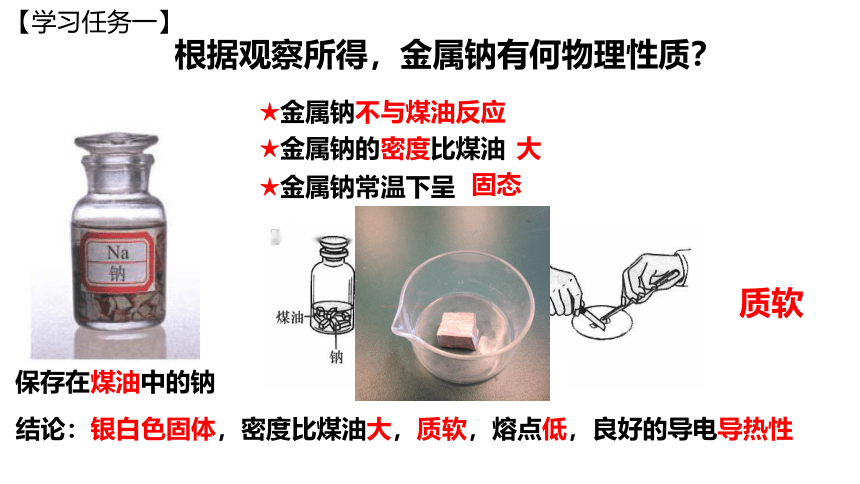
根据观察所得,金属钠有何物理性质?
★金属钠不与煤油反应
★金属钠的密度比煤油
★金属钠常温下呈
固态
大
保存在煤油中的钠
结论:银白色固体,密度比煤油大,质软,熔点低,良好的导电导热性
质软
【学习任务一】
【学习任务二】
【思考】初中的时候,我们已经知道了钠原子的结构。请画出其原子结构示意图。并结合已有知识,预测钠的性质,设计实验证明。
预测:从钠的原子结构来看,它的原子的最外电子层上只有1个电子,在化学反应中该电子很容易失去。因此,钠应该具有很强的还原性。可以和氧气等氧化剂反应。此外,结合金属活动顺序表,猜测钠可以和酸反应。
现象:
切开的光亮的金属断面很
快地变暗。
反应:
4Na + O2 = 2Na2O (常温下)
结论:
★常温下易与空气中的氧气反应
【实验2-1】用镊子取一小块钠,用滤纸吸干表面的煤油后,观察钠的光泽和颜色,用刀切去一端的外皮,再观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
【学习任务三】
实验探究1
银白色
在空气中表面变暗
切面
放置一会儿
【讨论】根据上述现象,解析钠保存在煤油中的原因。
钠在常温下能与氧气反应。因此,在实验室中,要把钠保存在石蜡油或煤油中,以隔绝空气。
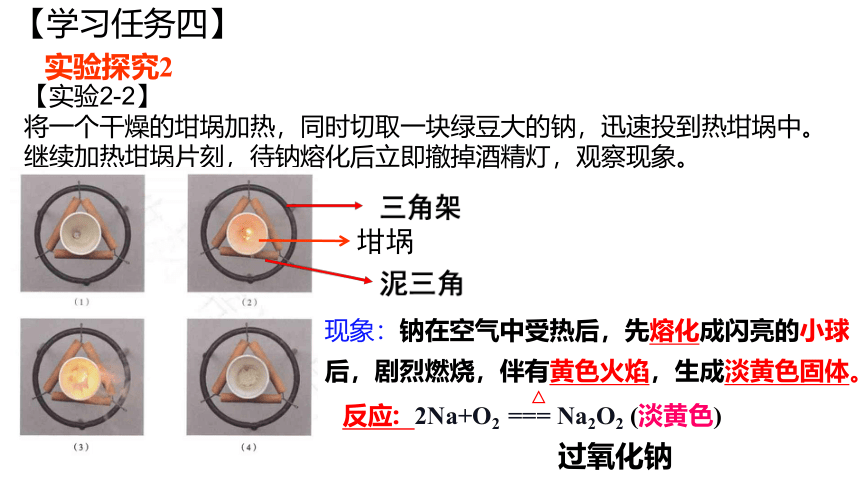
【学习任务四】
【实验2-2】
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
现象:钠在空气中受热后,先熔化成闪亮的小球后,剧烈燃烧,伴有黄色火焰,生成淡黄色固体。
坩埚
实验探究2
反应: 2Na+O2 === Na2O2 (淡黄色)
△
过氧化钠
2Na +O2 == Na2O2 (淡黄色)
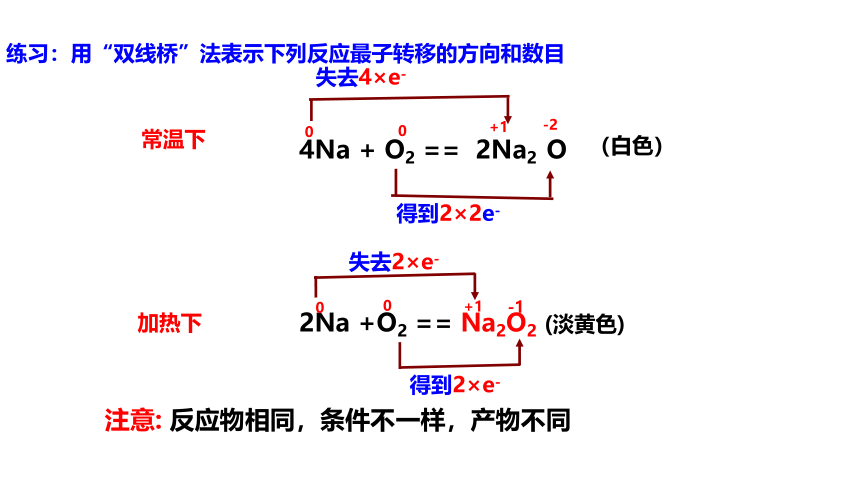
练习:用“双线桥”法表示下列反应最子转移的方向和数目
常温下
4Na + O2 == 2Na2 O
(白色)
加热下
失去2×e-
得到2×e-
失去4×e-
得到2×2e-
注意: 反应物相同,条件不一样,产物不同
0
0
+1
-2
0
0
+1
-1
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
1、钠与氧气反应:
(1)空气中缓慢氧化
(2)钠在空气中燃烧
结论:反应物相同,反应条件不同,产物不同。
小结:钠的化学性质
4Na+O2==2Na2O (白色固体)
2Na+O2 === Na2O2 (淡黄色)
△
Na 原子最外层的只有一个电子,易失去,故Na 化学性质很活泼,具有很强的还原性。
保存:煤油或石蜡中
2.钠与其他非金属
Na + S
研磨
爆炸
Na + Cl2
点燃
(白烟)
2 2NaCl
2 Na2S
珠江水面惊现神秘“水雷”
据中新社电 广州市珠江河段上,近两天惊现神秘“水雷”,6个装满货物铁皮桶漂浮在水面上,有3个发生剧烈爆炸,另外3个被有关部门成功打捞,期间无人员伤亡。
一位目击者说,早上10时多,河面上突然冒起一股白烟,从漂在水面上的一个铁桶内窜出明亮的黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。直到中午,这个铁桶又连续爆炸多次,爆炸腾起的白色烟雾近10米高。
经专家初步认定,铁桶内装的是遇水极易燃烧的金属钠。
新闻链接
【学习任务五】
【探究实验】
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
实验现象
分析:
实验现象:
浮
熔
游
响
红
ρ钠<ρ水
反应放热,钠熔点低
有气体生成
产生气体逸出发出的声音
有碱性物质生成
2Na + 2H2O == 2NaOH + H2
Na与酸反应:2Na + 2HCl == 2NaCl + H2
(比水更剧烈)
记忆小技巧:“芙蓉又想红”
思考讨论
(1)将金属钠投入到水和煤油的分层混合液中,有什么实验现象?
密度:水>钠>煤油。故钠会沉到水和煤油的分界线,反应放氢气使钠球往上弹,然后又掉下来,再弹。如此反复直到反应完。
【评价一】
写出钠和水反应的离子方程式,用双线桥表示电子转移的方向和数目,指出氧化剂、还原剂、氧化产物、还原产物。
2Na+2H2O==2Na++ 2OH- +H2↑
失2e-,化合价升高,被氧化
得2e-,化合价升降低,被还原
还原剂 氧化剂 氧化产物 还原产物
【思考】钠投入稀盐酸中,反应历程是怎样的?理由是?
钠先和酸反应,再和水反应。因为反应实际是钠与氢离子反应,酸电离出的氢离子浓度更大。
【评价二】
Na投入CuSO4溶液中,现象为浮、熔、游、响、蓝色沉淀。请写出化学方程式。
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
2Na + 2H2O +CuSO4=Cu(OH)2 +Na2SO4 + H2↑
实质:钠先和水反应,生成的氢氧化钠再与某些盐反应。
【先水后盐】
【评价三】
将金属钠投到FeCl3溶液中会有什么现象?为什么?
现象:浮、游、熔、响、红褐色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
1.下列关于金属Na的叙述正确的是
A. 做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤
纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再
加入少量水,然后观察并记录实验现象
B. 钠与滴有酚酞的冷水反应的现象简述为浮、熔、游、响、红,
离子方程式为: Na + 2H2O=Na++2OH— +H2↑
C. 将钠投入到饱和NaCl溶液中,有氢气放出,还有白色晶体析出
D. 取用金属钠时,剩余的钠不能放回原瓶
【评价四】
小结:
金属与水反应的实质是置换出水中的H
强 弱
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
还原性
与水
反应
与冷水
剧烈反应
生成碱
和氢气
与沸水
缓慢反应
生成碱
和氢气
与水蒸气
高温下反应
生成氢气
和氧化物
不反应
1.与氧气反应:
4Na+O2==2Na2O 2Na+O2==Na2O2
△
一、物理性质:银白色固体,质软,熔点低,良好的导电导热性
2.与水反应 2Na+2H2O=2NaOH+H2↑
浮、熔、游、响、红
3.与盐酸的反应 2Na+2HCl====2NaCl+H2↑
4.与盐溶液的反应 (如:CuSO4溶液)[先盐后水]
2Na+2H2O=2NaOH+H2↑ 2NaOH + CuSO4=Cu(OH)2 ↓ +Na2SO4
课堂小结:钠
二、化学性质:
随堂练习
1、钠与水反应的化学方程式:
;
2、钠保存在煤油中的原因?
;
3、当火灾现场有像钠这样活泼的金属存放
时能用水灭火吗?如果不能应该怎样?
。
2Na + 2H2O =2NaOH +H2↑
钠能与水、O2反应
不能,必须用干燥沙土灭火
谢谢
第二章 海水中的重要元素----钠和氯
第一节 钠及其化合物
第1课时 钠
在人类社会的发展过程中,金属起着重要的作用。人类在五千年前就开始使用青铜器,三千年前开始使用铁器,20世纪开始使用铝器。为什么人类使用金属的顺序是青铜、铁器、铝器,而不是其他顺序呢?
1.了解金属的通性。
2.掌握钠氧气的反应。(重点)
根据观察所得,金属钠有何物理性质?
★金属钠不与煤油反应
★金属钠的密度比煤油
★金属钠常温下呈
固态
大
保存在煤油中的钠
结论:银白色固体,密度比煤油大,质软,熔点低,良好的导电导热性
质软
【学习任务一】
【学习任务二】
【思考】初中的时候,我们已经知道了钠原子的结构。请画出其原子结构示意图。并结合已有知识,预测钠的性质,设计实验证明。
预测:从钠的原子结构来看,它的原子的最外电子层上只有1个电子,在化学反应中该电子很容易失去。因此,钠应该具有很强的还原性。可以和氧气等氧化剂反应。此外,结合金属活动顺序表,猜测钠可以和酸反应。
现象:
切开的光亮的金属断面很
快地变暗。
反应:
4Na + O2 = 2Na2O (常温下)
结论:
★常温下易与空气中的氧气反应
【实验2-1】用镊子取一小块钠,用滤纸吸干表面的煤油后,观察钠的光泽和颜色,用刀切去一端的外皮,再观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
【学习任务三】
实验探究1
银白色
在空气中表面变暗
切面
放置一会儿
【讨论】根据上述现象,解析钠保存在煤油中的原因。
钠在常温下能与氧气反应。因此,在实验室中,要把钠保存在石蜡油或煤油中,以隔绝空气。
【学习任务四】
【实验2-2】
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
现象:钠在空气中受热后,先熔化成闪亮的小球后,剧烈燃烧,伴有黄色火焰,生成淡黄色固体。
坩埚
实验探究2
反应: 2Na+O2 === Na2O2 (淡黄色)
△
过氧化钠
2Na +O2 == Na2O2 (淡黄色)
练习:用“双线桥”法表示下列反应最子转移的方向和数目
常温下
4Na + O2 == 2Na2 O
(白色)
加热下
失去2×e-
得到2×e-
失去4×e-
得到2×2e-
注意: 反应物相同,条件不一样,产物不同
0
0
+1
-2
0
0
+1
-1
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
1、钠与氧气反应:
(1)空气中缓慢氧化
(2)钠在空气中燃烧
结论:反应物相同,反应条件不同,产物不同。
小结:钠的化学性质
4Na+O2==2Na2O (白色固体)
2Na+O2 === Na2O2 (淡黄色)
△
Na 原子最外层的只有一个电子,易失去,故Na 化学性质很活泼,具有很强的还原性。
保存:煤油或石蜡中
2.钠与其他非金属
Na + S
研磨
爆炸
Na + Cl2
点燃
(白烟)
2 2NaCl
2 Na2S
珠江水面惊现神秘“水雷”
据中新社电 广州市珠江河段上,近两天惊现神秘“水雷”,6个装满货物铁皮桶漂浮在水面上,有3个发生剧烈爆炸,另外3个被有关部门成功打捞,期间无人员伤亡。
一位目击者说,早上10时多,河面上突然冒起一股白烟,从漂在水面上的一个铁桶内窜出明亮的黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。直到中午,这个铁桶又连续爆炸多次,爆炸腾起的白色烟雾近10米高。
经专家初步认定,铁桶内装的是遇水极易燃烧的金属钠。
新闻链接
【学习任务五】
【探究实验】
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
实验现象
分析:
实验现象:
浮
熔
游
响
红
ρ钠<ρ水
反应放热,钠熔点低
有气体生成
产生气体逸出发出的声音
有碱性物质生成
2Na + 2H2O == 2NaOH + H2
Na与酸反应:2Na + 2HCl == 2NaCl + H2
(比水更剧烈)
记忆小技巧:“芙蓉又想红”
思考讨论
(1)将金属钠投入到水和煤油的分层混合液中,有什么实验现象?
密度:水>钠>煤油。故钠会沉到水和煤油的分界线,反应放氢气使钠球往上弹,然后又掉下来,再弹。如此反复直到反应完。
【评价一】
写出钠和水反应的离子方程式,用双线桥表示电子转移的方向和数目,指出氧化剂、还原剂、氧化产物、还原产物。
2Na+2H2O==2Na++ 2OH- +H2↑
失2e-,化合价升高,被氧化
得2e-,化合价升降低,被还原
还原剂 氧化剂 氧化产物 还原产物
【思考】钠投入稀盐酸中,反应历程是怎样的?理由是?
钠先和酸反应,再和水反应。因为反应实际是钠与氢离子反应,酸电离出的氢离子浓度更大。
【评价二】
Na投入CuSO4溶液中,现象为浮、熔、游、响、蓝色沉淀。请写出化学方程式。
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
2Na + 2H2O +CuSO4=Cu(OH)2 +Na2SO4 + H2↑
实质:钠先和水反应,生成的氢氧化钠再与某些盐反应。
【先水后盐】
【评价三】
将金属钠投到FeCl3溶液中会有什么现象?为什么?
现象:浮、游、熔、响、红褐色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
1.下列关于金属Na的叙述正确的是
A. 做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤
纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再
加入少量水,然后观察并记录实验现象
B. 钠与滴有酚酞的冷水反应的现象简述为浮、熔、游、响、红,
离子方程式为: Na + 2H2O=Na++2OH— +H2↑
C. 将钠投入到饱和NaCl溶液中,有氢气放出,还有白色晶体析出
D. 取用金属钠时,剩余的钠不能放回原瓶
【评价四】
小结:
金属与水反应的实质是置换出水中的H
强 弱
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
还原性
与水
反应
与冷水
剧烈反应
生成碱
和氢气
与沸水
缓慢反应
生成碱
和氢气
与水蒸气
高温下反应
生成氢气
和氧化物
不反应
1.与氧气反应:
4Na+O2==2Na2O 2Na+O2==Na2O2
△
一、物理性质:银白色固体,质软,熔点低,良好的导电导热性
2.与水反应 2Na+2H2O=2NaOH+H2↑
浮、熔、游、响、红
3.与盐酸的反应 2Na+2HCl====2NaCl+H2↑
4.与盐溶液的反应 (如:CuSO4溶液)[先盐后水]
2Na+2H2O=2NaOH+H2↑ 2NaOH + CuSO4=Cu(OH)2 ↓ +Na2SO4
课堂小结:钠
二、化学性质:
随堂练习
1、钠与水反应的化学方程式:
;
2、钠保存在煤油中的原因?
;
3、当火灾现场有像钠这样活泼的金属存放
时能用水灭火吗?如果不能应该怎样?
。
2Na + 2H2O =2NaOH +H2↑
钠能与水、O2反应
不能,必须用干燥沙土灭火
谢谢
