第三章 铁 金属材料 第一节铁及其化合物 第一课时 课件23张-人教版(2019)高中化学必修一
文档属性
| 名称 | 第三章 铁 金属材料 第一节铁及其化合物 第一课时 课件23张-人教版(2019)高中化学必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-13 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
第三章 铁 金属材料
课标中的内容要求
主题 内容要求
主题2 常见的无机物及其应用 2.4 金属及其化合物
结合真实情境中的应用实例或通过实验探究,了解钠、铁及其重要化合物的主要性质,了解这些物质在生产、生活中的应用
2.7 学生必做实验
铁及其化合物的性质
主题5 化学与社会发展
5.2 化学科学在材料科学、人类健康等方面的重要作用
知道金属材料、无机非金属材料、高分子材料等常见材料类型,结合实例认识材料组成、性能及应用的联系
第三章 铁 金属材料
第一节 铁及其化合物
第一课时 铁的单质
身边的化学,发现问题
2018年,网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。这是不是不法商家添加的呢?
一、铁的单质
1、铁的存在
陨铁 铁单质
赤铁矿
氧化铁Fe2O3
磁铁矿
四氧化三铁Fe3O4
化合态
(1)、陨铁:以单质形态存在
(2)、矿石中的铁元素:主要以+2、+3价化合物存在
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
人类最早使用的铁就是来自太空的陨铁。
甘肃灵台出土的春秋初年秦国的铜柄铁剑
(3)春秋初年就已经掌握了用还原的方法把铁从铁矿石中提炼出来
Ⅰ 、原理:
利用还原剂将铁从矿石中还原出来。
铁矿石、焦炭、空气等。
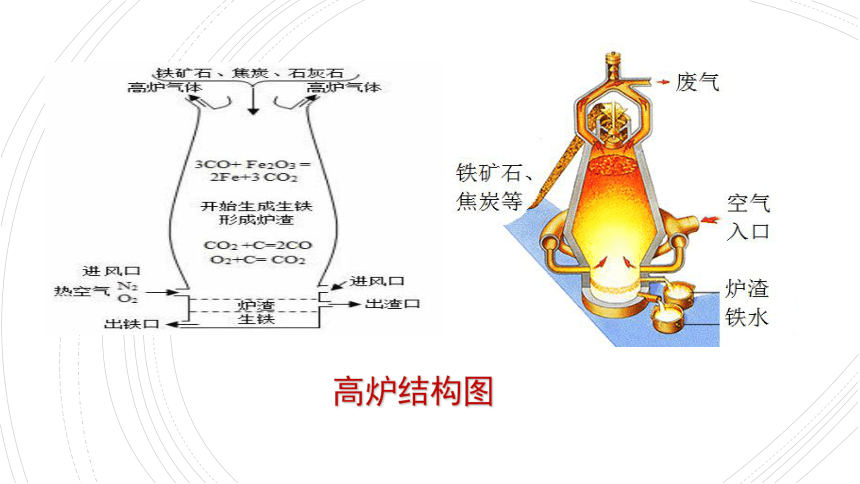
Ⅱ、高炉炼铁
炼铁高炉;
⑴设备:
⑵原料:
⑶主要反应:
Fe2O3 + 3CO === 2Fe + 3CO2
高温
思考:其中焦炭的作用?—热源形成
a.生成CO2:C + O2==CO2
b.生成CO:CO2+C==2CO
点燃
炉渣回收:CaCO3 = CaO+CO2 ↑ CaO+SiO2 = CaSiO3
高温
高温
高炉结构图
纯铁具有金属的共性,
如具有银白色金属光泽,具有导电性、导热性和延展性。
(1)、共性:
(2)、特性:
铁能被磁铁吸引,具有铁磁性。
熔点(高): 1538℃、
沸点(高): 2750℃
密度(大): 7.86g/cm3
【例题1】下列关于铁的叙述,错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁铁吸引,在磁场作用下,铁自身能产生磁场
C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态也有化合态
D.纯铁的抗腐蚀能力强,在干燥空气中不易被氧化
C
2、铁的物理性质
3、铁的化学性质
铁单质只有还原性
而铁与氧化性较强的氧化剂(如氯气,等)反应,铁原子则失去3个电子生成+ 3价铁的化合物。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+ 2价铁的化合物;
Fe+2HCl==FeCl2+H2↑
铁与盐酸反应:
Fe+CuSO4==FeSO4+Cu
铁与硫酸铜反应:
Fe-2e-→Fe2+
Fe-2e-→Fe2+
2Fe+3Cl2===2FeCl3
Fe-3e-→Fe3+
问1:钠有哪些化学性质?
钠可以与非金属、水、酸、盐反应。
问2:那铁有哪些化学性质?
(一)、与非金属单质反应
铁也可以与非金属、水、酸、盐反应。
(1)与O2反应
3Fe+2O2===Fe3O4
点燃
现象:
铁在潮湿的空气中易被腐蚀,生成铁锈,其主要成分为
点燃:
常温:
(2)与Cl2反应
2Fe+3Cl2===2FeCl3
现象:
剧烈燃烧,火星四射。
Fe2O3·xH2O。
剧烈燃烧,生成棕色的烟。
(3)与S反应
Fe+S===FeS
氧化性:Cl2 > S
【思考与讨论】
材料:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水(如图3~4),这是为什么呢?
生活经验告诉我们,在常温下,铁与水是不发生反应的。根据材料,在高温下,铁可能与水发生反应。
现象:
加热时试管内铁粉红热,生成黑色固体,点燃肥皂泡可听到爆鸣声。
(二)、与水反应
3Fe+4H2O(g) ====Fe3O4+4H2
高温
常温下,铁与水是不反应的。但在高温下可与水蒸气反应:
现象:
加热时试管内铁粉红热,生成黑色固体,点燃肥皂泡可听到爆鸣声。
实验注意点:
①试管口略向下倾斜;
②酒精灯先加热湿棉花,有水蒸气后,
再点燃酒精灯加热还原铁粉;
③加热一会后再将导管插入到肥皂水中;
④结束时,先撤导管,再移酒精灯。
Fe+2H+===Fe2++H2↑
与非氧化性酸,如盐酸、稀硫酸反应离子方程式:
(三)、与酸反应
Fe+2Fe3+===3Fe2+
(2)与FeCl3溶液反应(离子方程式):
Fe+Cu2+===Fe2++Cu
(1)与CuSO4溶液反应(离子方程式):
(四)、与盐溶液反应
据世界卫生组织调查报告,全世界约有10%~30%的人群有不同程度的缺铁。缺铁性贫血是我国,也是世界上最常见的贫血。
【思考】如何合理补铁?
必要时,我们可以根据医生建议补充一些补铁口服液。
练习1:某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是__________________,B中反应的化学方程式为_____________。
(2)D的作用是___________________________________。
(3)E中的现象是________________________________。
(4)A、B两个装置中应先点燃______处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_____________。
答案:
(1)产生水蒸气 3Fe+4H2O(g)= Fe3O4+4H2
(2)吸收未反应的水蒸气
(3)黑色固体变为红色,右端管壁有水珠生成
(4)A 收集H2,并检验其纯度
高温
C
3.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.只有①③ C.只有①②③ D.全部
B
4.下列有关铁与水反应的说法中正确的是( )
A.在任何条件下,铁与水均能发生反应
B.在高温时,铁与水蒸气反应生成氢氧化铁和H2
C.在高温时,铁与水蒸气反应生成氧化铁和H2
D.在高温时,铁与水蒸气反应生成四氧化三铁和H2
D
5.把足量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为( )
A.1∶4 B.2∶7 C.1∶2 D.3∶8
A
谢谢大家
第三章 铁 金属材料
课标中的内容要求
主题 内容要求
主题2 常见的无机物及其应用 2.4 金属及其化合物
结合真实情境中的应用实例或通过实验探究,了解钠、铁及其重要化合物的主要性质,了解这些物质在生产、生活中的应用
2.7 学生必做实验
铁及其化合物的性质
主题5 化学与社会发展
5.2 化学科学在材料科学、人类健康等方面的重要作用
知道金属材料、无机非金属材料、高分子材料等常见材料类型,结合实例认识材料组成、性能及应用的联系
第三章 铁 金属材料
第一节 铁及其化合物
第一课时 铁的单质
身边的化学,发现问题
2018年,网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。这是不是不法商家添加的呢?
一、铁的单质
1、铁的存在
陨铁 铁单质
赤铁矿
氧化铁Fe2O3
磁铁矿
四氧化三铁Fe3O4
化合态
(1)、陨铁:以单质形态存在
(2)、矿石中的铁元素:主要以+2、+3价化合物存在
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
人类最早使用的铁就是来自太空的陨铁。
甘肃灵台出土的春秋初年秦国的铜柄铁剑
(3)春秋初年就已经掌握了用还原的方法把铁从铁矿石中提炼出来
Ⅰ 、原理:
利用还原剂将铁从矿石中还原出来。
铁矿石、焦炭、空气等。
Ⅱ、高炉炼铁
炼铁高炉;
⑴设备:
⑵原料:
⑶主要反应:
Fe2O3 + 3CO === 2Fe + 3CO2
高温
思考:其中焦炭的作用?—热源形成
a.生成CO2:C + O2==CO2
b.生成CO:CO2+C==2CO
点燃
炉渣回收:CaCO3 = CaO+CO2 ↑ CaO+SiO2 = CaSiO3
高温
高温
高炉结构图
纯铁具有金属的共性,
如具有银白色金属光泽,具有导电性、导热性和延展性。
(1)、共性:
(2)、特性:
铁能被磁铁吸引,具有铁磁性。
熔点(高): 1538℃、
沸点(高): 2750℃
密度(大): 7.86g/cm3
【例题1】下列关于铁的叙述,错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁铁吸引,在磁场作用下,铁自身能产生磁场
C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态也有化合态
D.纯铁的抗腐蚀能力强,在干燥空气中不易被氧化
C
2、铁的物理性质
3、铁的化学性质
铁单质只有还原性
而铁与氧化性较强的氧化剂(如氯气,等)反应,铁原子则失去3个电子生成+ 3价铁的化合物。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+ 2价铁的化合物;
Fe+2HCl==FeCl2+H2↑
铁与盐酸反应:
Fe+CuSO4==FeSO4+Cu
铁与硫酸铜反应:
Fe-2e-→Fe2+
Fe-2e-→Fe2+
2Fe+3Cl2===2FeCl3
Fe-3e-→Fe3+
问1:钠有哪些化学性质?
钠可以与非金属、水、酸、盐反应。
问2:那铁有哪些化学性质?
(一)、与非金属单质反应
铁也可以与非金属、水、酸、盐反应。
(1)与O2反应
3Fe+2O2===Fe3O4
点燃
现象:
铁在潮湿的空气中易被腐蚀,生成铁锈,其主要成分为
点燃:
常温:
(2)与Cl2反应
2Fe+3Cl2===2FeCl3
现象:
剧烈燃烧,火星四射。
Fe2O3·xH2O。
剧烈燃烧,生成棕色的烟。
(3)与S反应
Fe+S===FeS
氧化性:Cl2 > S
【思考与讨论】
材料:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水(如图3~4),这是为什么呢?
生活经验告诉我们,在常温下,铁与水是不发生反应的。根据材料,在高温下,铁可能与水发生反应。
现象:
加热时试管内铁粉红热,生成黑色固体,点燃肥皂泡可听到爆鸣声。
(二)、与水反应
3Fe+4H2O(g) ====Fe3O4+4H2
高温
常温下,铁与水是不反应的。但在高温下可与水蒸气反应:
现象:
加热时试管内铁粉红热,生成黑色固体,点燃肥皂泡可听到爆鸣声。
实验注意点:
①试管口略向下倾斜;
②酒精灯先加热湿棉花,有水蒸气后,
再点燃酒精灯加热还原铁粉;
③加热一会后再将导管插入到肥皂水中;
④结束时,先撤导管,再移酒精灯。
Fe+2H+===Fe2++H2↑
与非氧化性酸,如盐酸、稀硫酸反应离子方程式:
(三)、与酸反应
Fe+2Fe3+===3Fe2+
(2)与FeCl3溶液反应(离子方程式):
Fe+Cu2+===Fe2++Cu
(1)与CuSO4溶液反应(离子方程式):
(四)、与盐溶液反应
据世界卫生组织调查报告,全世界约有10%~30%的人群有不同程度的缺铁。缺铁性贫血是我国,也是世界上最常见的贫血。
【思考】如何合理补铁?
必要时,我们可以根据医生建议补充一些补铁口服液。
练习1:某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是__________________,B中反应的化学方程式为_____________。
(2)D的作用是___________________________________。
(3)E中的现象是________________________________。
(4)A、B两个装置中应先点燃______处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_____________。
答案:
(1)产生水蒸气 3Fe+4H2O(g)= Fe3O4+4H2
(2)吸收未反应的水蒸气
(3)黑色固体变为红色,右端管壁有水珠生成
(4)A 收集H2,并检验其纯度
高温
C
3.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.只有①③ C.只有①②③ D.全部
B
4.下列有关铁与水反应的说法中正确的是( )
A.在任何条件下,铁与水均能发生反应
B.在高温时,铁与水蒸气反应生成氢氧化铁和H2
C.在高温时,铁与水蒸气反应生成氧化铁和H2
D.在高温时,铁与水蒸气反应生成四氧化三铁和H2
D
5.把足量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为( )
A.1∶4 B.2∶7 C.1∶2 D.3∶8
A
谢谢大家
