山东省临清三中2011-2012学年高二上学期期末学分认定考前测验化学(理)试题
文档属性
| 名称 | 山东省临清三中2011-2012学年高二上学期期末学分认定考前测验化学(理)试题 |

|
|
| 格式 | zip | ||
| 文件大小 | 105.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-12 00:00:00 | ||
图片预览


文档简介
高二年级期末学分认定考前测验
化学(理)试题
(时间:100分钟 分值:100分)
注明:本试卷分第Ⅰ卷(选择题)第Ⅱ卷(非选择题)两部分。满分100分,
考试时间90分钟。考试结束只交答题卡和答题纸。
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Na—23
一、选择题(包括20小题,1--10每小题2分,11—20每小题3分共50分。每小题只有一个选项符合题意)
1、下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.应用盖斯定律可以计算某些难以测量的反应焓变
C.盐类的水解反应是放热反应
D.在吸热反应中,反应物的总能量比产物的总能量高
2、强弱电解质的本质区别是 ( )
A、导电能力 B、化学键的类型 C、电离程度 D、溶解度
3、下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.实验室配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊
D.水中加入明矾可以净化水。
4、2010年诺贝尔化学奖授予理查德·海克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究。下面关于催化剂的说法正确的是:( )
A.催化剂只改变反应的正反应速率
B.催化剂通过升高反应的活化能来加快反应速率
C.催化剂能够改变反应的反应热
D.催化剂不能改变反应物的转化率。
5、右图所示滴定前后滴定管中液面所处的刻度,则
消耗溶液的体积为 ( )
A.V1 mL B.V2 mL C.(V2-V1)mL D.(V1- V2)mL
6、废电池造成污染的问题日益受到关注。集中处理废电池的首要目的是 ( )
A.回收石墨电极
B.利用电池外壳的金属材料
C.防止电池中渗泄的电解液腐蚀其他物品
D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
7、下列过程中需要通电才可以进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A、①②③ B、②③④ C、②③ D、全部
8、化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A.NH4+的水解反应离子方程式:NH4+ + H2O NH3·H2O + H+
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓
C.镀铜时,阳极的电极反应式为: Cu2++2e- == Cu
D.某反应⊿H<0,则该反应在任意条件下均可自发进行。
9、下列关于金属的腐蚀说法正确的是( )
A.一般来说,金属发生化学腐蚀的速率比电化学腐蚀速率要快
B.保护地下钢管不受腐蚀,可使它连接直流电源的负极
C.钢铁发生析氢腐蚀时,正极的电极反应式为:2H2O+O2+4e-=4OH-
D.轮船底部放一块锌块,所采用的防腐方法为牺牲阴极的阳极保护法
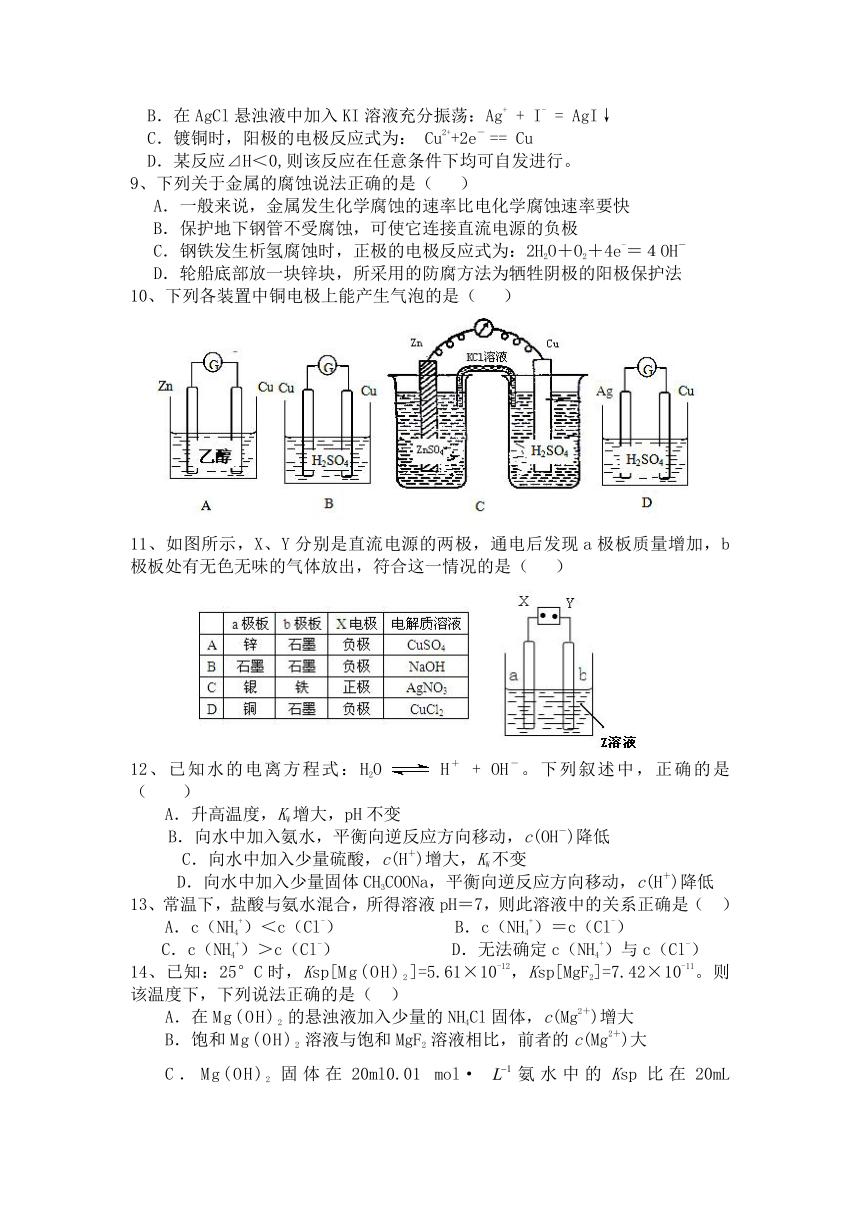
10、下列各装置中铜电极上能产生气泡的是( )
11、如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
12、已知水的电离方程式:H2O H+ + OH-。下列叙述中,正确的是 ( )
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
13、常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是( )
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)
14、已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。则该温度下,下列说法正确的是( )
A.在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
B.饱和Mg(OH)2溶液与饱和MgF2 溶液相比,前者的c(Mg2+)大
C.Mg(OH)2固体在20ml0.01 mol·氨水中的Ksp比在20mL 0.01mol· NH4Cl 溶液中的Ksp小
D.在Mg(OH)2的悬浊液加入NaF 溶液后,Mg(OH)2不可能转化成为MgF2
15、对于可逆反应A(g)+2B(g)2C(g) △H>0,下列图象中正确的是( )
16、用pH试纸测定溶液pH的正确操作是: ( )
A.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
17、有关AgCl的溶解沉淀平衡的说法中,不正确的是()
A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl―
C.升高温度时,AgCl的溶解度增大
D.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体
18.在容积不变的密闭容器中,一定条件下发生反应:2A( )B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为非气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
19. 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol·L-1·s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系: υ(B)=3υ(A); 3υ(C)=2υ(B)。则此反应可表示为
A.2A+3B2C B.A+3B2C
C.3A+B2C D.A+BC
20.在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是
A.pH=3的HNO3跟pH=11的KOH溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钠溶液
第Ⅱ卷(非选择题 共50分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试卷中(除题目有特殊规定外)。
2.答卷前将密封线内的项目填写清楚。
三、(本题包括4小题,共26分)
21.(4分)玛丽太太是一位漂亮的女士,在她一口整齐的牙齿中镶有两颗假牙,其中一颗是纯黄金的,另一颗是不锈钢的。但自按上假牙后,玛丽太太经常牙疼、心情烦躁,经牙医治疗也未有好转。最终还是一位化学工作者治好了她的病。请回答:
(1)这位化学工作者采用的治疗方法是 ;
(2)玛丽太太头疼,烦躁的原因是 。
22.(6分)室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量。
(1)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和溶液的pH。
试填写表中空白:
离子浓度的关系 溶质的化学式 溶液的pH
① [NH4-]>[Cl-]>[OH-]>[H+] pH>7
② [NH4-]=[Cl-] NH4Cl、NH3·H2O
③ NH4Cl pH<7
④ [Cl-]>[H+]>[NH4-]>[OH-] pH<7
23.(7分)已知:H2(g)+O2(g)=H2O(g),
反应过程中能量变化如右图所示:
请回答下列问题:
(1)a、b、c分别代表的意义
a. ,
b. ,
c. ;
(2) 该反应是 反应(填“放热”或“吸热”),ΔH 0(填“>”、“<”或“=”);
(3)若已知2H2O(g)+O2(g)=2H2O(g) ΔH1=-Q1kJ·mol-1;
2H2O(g)+O2(g)=2H2O(l) ΔH2=-Q2kJ·mol-1,
则ΔH1 ΔH2,Q1 Q2(填“>”“<”或“=”)。
24.(9分)在2L密闭容器中,800℃时反应
2NO(g)+O2(g)2NO2(g)体系中,
n(NO)随时间的交化如下表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(2)写出该反应的平衡常数表达式:K= ,已知:K(300℃)>K(350℃),该反应是 反应(填“放热”或“吸热”);
(2)右图中表示NO2的变化的曲线是 ,用O2的浓度变化表示从0~2s内该反应的平均速率v= ;
(3)能说明该反应已经达到平衡状态的是( )
a. v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
四、(本题包括2小题,共12分)
25.(4分)限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。
根据①弱碱在水中存在电离平衡;
②弱碱的阳离子会破坏水的电离平衡。
这两种平衡移动均会引起指示剂颜色变化。
由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据①的实验方法及现象
;
(2)应用根据②的实验方法及现象
。
26.(8分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测其纯度,进行以下操作:
A.在250mL的容量瓶中定量配成250mL烧碱溶液
B.用滴定管量取25.0mL烧碱溶液置于锥形瓶中并滴加几滴酚酞试液
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为amol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL
E. 在锥形瓶下垫一张白纸,滴定到终点,记录终点消耗酸刻度数为V2mL
回答下列问题:
(1)正确的操作步骤顺序是 → → → D → (填写字母);
(2)操作E中在锥形瓶下垫一张白纸的作用是 ;
(3)操作D中液面应调整到 ,尖嘴部分应 ;
(4)滴定到终点时指示剂颜色的变化是 ;
(5)若其他操作正确,但酸式滴定管未用标准H2SO4润洗,会对测定结果有何影响
(填“偏高”、“偏低”或“无影响”)。
五、(本题包括1小题,共12分)
27.(12分)如图为相互串联的甲、乙两电解池。
试回答:
(1)若甲电解池利用电解原理在铁上镀银,
则A是 、 (填电极材料和电极名称),
电极反应是 ;
B(要求同A)是 、 ,
电极反应是 ,应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。C极附近呈 色。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是
mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
高二年级期末学分认定考前测验
化学(科学)参考答案
第Ⅰ卷(选择题,共50分)
1B 2C 3B 4D 5C 6D 7C 8A 9B 10C 11A 12C 13B 14A 15D 16D 17B 18A 19B 20D
三、(共26分)
21.(4分)
(1)将不锈钢的假牙换成纯黄金的或把纯黄金的假牙换成同材质不锈钢的(2分)
(2)因为两种不同的金属含在口中,与唾液中的电解质接触,形成了原电池,产生微电流,这电流刺激了玛丽太太的神经末稍(只要答出形成原电池即可)(2分)
22.(6分) (1)增大 (1分) 减小 (1分)
(2)①NH4Cl、NH3·H2O (1分) ②pH=7 (1分)
③[Cl-]>[NH4+]>[H+]>[OH-](1分) ④NH4Cl、HCl (1分)
23.(7分)
(1)a.破坏1molH2和mol O2中化学键所吸收的能量 (1分)
b.由2mol H和1mol O形成1mol H2O(g)所放出的能量 (1分)
c.反应热 (1分)
(2) 放热 (1分) < (1分) (3) >(1分) <(1分)
24.(9分)
(1)K= (2分) 放热 (1分)
(2)b(1分) 1.5×10-3mol/(L·s)(2分)
(3)b c(2分) (4)c(1分)
四、(共12分)
25.(4分)
(1)取少量稀氨水,滴入酚酞试液,溶液呈红色,加入醋酸铵晶体,溶液的红色变浅 (2分)
(2)取少量NH4Cl晶体,加蒸馏水溶解,滴入紫色石蕊试液,溶液变红色(2分)
26.(8分)
(1)C、A、B、D、E (2分)
(2)便于准确判断滴定终点时锥形瓶内溶液颜色的变化 (1分)
(3)零刻度或零刻度下的某一刻度 (1分) 充满溶液或无气泡 (1分)
(4)由红色变为无色 (1分)
(5)偏高(2分)
五、(共12分)
27.(12分)
(1)铁 阴极 Ag+e-→Ag
银 阳极 Ag→Ag++e- AgNO3溶液
(2)红 浅黄绿色
(3)448 (4)0.1 13(每空1分)
化学(理)试题
(时间:100分钟 分值:100分)
注明:本试卷分第Ⅰ卷(选择题)第Ⅱ卷(非选择题)两部分。满分100分,
考试时间90分钟。考试结束只交答题卡和答题纸。
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Na—23
一、选择题(包括20小题,1--10每小题2分,11—20每小题3分共50分。每小题只有一个选项符合题意)
1、下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.应用盖斯定律可以计算某些难以测量的反应焓变
C.盐类的水解反应是放热反应
D.在吸热反应中,反应物的总能量比产物的总能量高
2、强弱电解质的本质区别是 ( )
A、导电能力 B、化学键的类型 C、电离程度 D、溶解度
3、下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.实验室配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊
D.水中加入明矾可以净化水。
4、2010年诺贝尔化学奖授予理查德·海克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究。下面关于催化剂的说法正确的是:( )
A.催化剂只改变反应的正反应速率
B.催化剂通过升高反应的活化能来加快反应速率
C.催化剂能够改变反应的反应热
D.催化剂不能改变反应物的转化率。
5、右图所示滴定前后滴定管中液面所处的刻度,则
消耗溶液的体积为 ( )
A.V1 mL B.V2 mL C.(V2-V1)mL D.(V1- V2)mL
6、废电池造成污染的问题日益受到关注。集中处理废电池的首要目的是 ( )
A.回收石墨电极
B.利用电池外壳的金属材料
C.防止电池中渗泄的电解液腐蚀其他物品
D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
7、下列过程中需要通电才可以进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A、①②③ B、②③④ C、②③ D、全部
8、化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A.NH4+的水解反应离子方程式:NH4+ + H2O NH3·H2O + H+
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓
C.镀铜时,阳极的电极反应式为: Cu2++2e- == Cu
D.某反应⊿H<0,则该反应在任意条件下均可自发进行。
9、下列关于金属的腐蚀说法正确的是( )
A.一般来说,金属发生化学腐蚀的速率比电化学腐蚀速率要快
B.保护地下钢管不受腐蚀,可使它连接直流电源的负极
C.钢铁发生析氢腐蚀时,正极的电极反应式为:2H2O+O2+4e-=4OH-
D.轮船底部放一块锌块,所采用的防腐方法为牺牲阴极的阳极保护法
10、下列各装置中铜电极上能产生气泡的是( )
11、如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
12、已知水的电离方程式:H2O H+ + OH-。下列叙述中,正确的是 ( )
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
13、常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是( )
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)
14、已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。则该温度下,下列说法正确的是( )
A.在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
B.饱和Mg(OH)2溶液与饱和MgF2 溶液相比,前者的c(Mg2+)大
C.Mg(OH)2固体在20ml0.01 mol·氨水中的Ksp比在20mL 0.01mol· NH4Cl 溶液中的Ksp小
D.在Mg(OH)2的悬浊液加入NaF 溶液后,Mg(OH)2不可能转化成为MgF2
15、对于可逆反应A(g)+2B(g)2C(g) △H>0,下列图象中正确的是( )
16、用pH试纸测定溶液pH的正确操作是: ( )
A.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
17、有关AgCl的溶解沉淀平衡的说法中,不正确的是()
A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl―
C.升高温度时,AgCl的溶解度增大
D.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体
18.在容积不变的密闭容器中,一定条件下发生反应:2A( )B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为非气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
19. 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol·L-1·s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系: υ(B)=3υ(A); 3υ(C)=2υ(B)。则此反应可表示为
A.2A+3B2C B.A+3B2C
C.3A+B2C D.A+BC
20.在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是
A.pH=3的HNO3跟pH=11的KOH溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钠溶液
第Ⅱ卷(非选择题 共50分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试卷中(除题目有特殊规定外)。
2.答卷前将密封线内的项目填写清楚。
三、(本题包括4小题,共26分)
21.(4分)玛丽太太是一位漂亮的女士,在她一口整齐的牙齿中镶有两颗假牙,其中一颗是纯黄金的,另一颗是不锈钢的。但自按上假牙后,玛丽太太经常牙疼、心情烦躁,经牙医治疗也未有好转。最终还是一位化学工作者治好了她的病。请回答:
(1)这位化学工作者采用的治疗方法是 ;
(2)玛丽太太头疼,烦躁的原因是 。
22.(6分)室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量。
(1)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和溶液的pH。
试填写表中空白:
离子浓度的关系 溶质的化学式 溶液的pH
① [NH4-]>[Cl-]>[OH-]>[H+] pH>7
② [NH4-]=[Cl-] NH4Cl、NH3·H2O
③ NH4Cl pH<7
④ [Cl-]>[H+]>[NH4-]>[OH-] pH<7
23.(7分)已知:H2(g)+O2(g)=H2O(g),
反应过程中能量变化如右图所示:
请回答下列问题:
(1)a、b、c分别代表的意义
a. ,
b. ,
c. ;
(2) 该反应是 反应(填“放热”或“吸热”),ΔH 0(填“>”、“<”或“=”);
(3)若已知2H2O(g)+O2(g)=2H2O(g) ΔH1=-Q1kJ·mol-1;
2H2O(g)+O2(g)=2H2O(l) ΔH2=-Q2kJ·mol-1,
则ΔH1 ΔH2,Q1 Q2(填“>”“<”或“=”)。
24.(9分)在2L密闭容器中,800℃时反应
2NO(g)+O2(g)2NO2(g)体系中,
n(NO)随时间的交化如下表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(2)写出该反应的平衡常数表达式:K= ,已知:K(300℃)>K(350℃),该反应是 反应(填“放热”或“吸热”);
(2)右图中表示NO2的变化的曲线是 ,用O2的浓度变化表示从0~2s内该反应的平均速率v= ;
(3)能说明该反应已经达到平衡状态的是( )
a. v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
四、(本题包括2小题,共12分)
25.(4分)限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。
根据①弱碱在水中存在电离平衡;
②弱碱的阳离子会破坏水的电离平衡。
这两种平衡移动均会引起指示剂颜色变化。
由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据①的实验方法及现象
;
(2)应用根据②的实验方法及现象
。
26.(8分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测其纯度,进行以下操作:
A.在250mL的容量瓶中定量配成250mL烧碱溶液
B.用滴定管量取25.0mL烧碱溶液置于锥形瓶中并滴加几滴酚酞试液
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为amol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL
E. 在锥形瓶下垫一张白纸,滴定到终点,记录终点消耗酸刻度数为V2mL
回答下列问题:
(1)正确的操作步骤顺序是 → → → D → (填写字母);
(2)操作E中在锥形瓶下垫一张白纸的作用是 ;
(3)操作D中液面应调整到 ,尖嘴部分应 ;
(4)滴定到终点时指示剂颜色的变化是 ;
(5)若其他操作正确,但酸式滴定管未用标准H2SO4润洗,会对测定结果有何影响
(填“偏高”、“偏低”或“无影响”)。
五、(本题包括1小题,共12分)
27.(12分)如图为相互串联的甲、乙两电解池。
试回答:
(1)若甲电解池利用电解原理在铁上镀银,
则A是 、 (填电极材料和电极名称),
电极反应是 ;
B(要求同A)是 、 ,
电极反应是 ,应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。C极附近呈 色。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是
mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
高二年级期末学分认定考前测验
化学(科学)参考答案
第Ⅰ卷(选择题,共50分)
1B 2C 3B 4D 5C 6D 7C 8A 9B 10C 11A 12C 13B 14A 15D 16D 17B 18A 19B 20D
三、(共26分)
21.(4分)
(1)将不锈钢的假牙换成纯黄金的或把纯黄金的假牙换成同材质不锈钢的(2分)
(2)因为两种不同的金属含在口中,与唾液中的电解质接触,形成了原电池,产生微电流,这电流刺激了玛丽太太的神经末稍(只要答出形成原电池即可)(2分)
22.(6分) (1)增大 (1分) 减小 (1分)
(2)①NH4Cl、NH3·H2O (1分) ②pH=7 (1分)
③[Cl-]>[NH4+]>[H+]>[OH-](1分) ④NH4Cl、HCl (1分)
23.(7分)
(1)a.破坏1molH2和mol O2中化学键所吸收的能量 (1分)
b.由2mol H和1mol O形成1mol H2O(g)所放出的能量 (1分)
c.反应热 (1分)
(2) 放热 (1分) < (1分) (3) >(1分) <(1分)
24.(9分)
(1)K= (2分) 放热 (1分)
(2)b(1分) 1.5×10-3mol/(L·s)(2分)
(3)b c(2分) (4)c(1分)
四、(共12分)
25.(4分)
(1)取少量稀氨水,滴入酚酞试液,溶液呈红色,加入醋酸铵晶体,溶液的红色变浅 (2分)
(2)取少量NH4Cl晶体,加蒸馏水溶解,滴入紫色石蕊试液,溶液变红色(2分)
26.(8分)
(1)C、A、B、D、E (2分)
(2)便于准确判断滴定终点时锥形瓶内溶液颜色的变化 (1分)
(3)零刻度或零刻度下的某一刻度 (1分) 充满溶液或无气泡 (1分)
(4)由红色变为无色 (1分)
(5)偏高(2分)
五、(共12分)
27.(12分)
(1)铁 阴极 Ag+e-→Ag
银 阳极 Ag→Ag++e- AgNO3溶液
(2)红 浅黄绿色
(3)448 (4)0.1 13(每空1分)
同课章节目录
