2020-2021学年人教版初中化学九年级下册第九单元《溶液》测试题(含答案)
文档属性
| 名称 | 2020-2021学年人教版初中化学九年级下册第九单元《溶液》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 145.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-14 18:07:11 | ||
图片预览


文档简介
第九单元《溶液》测试题
一、单选题
1.厨房中的下列调味品与水混合不能得到溶液的是
A.食醋
B.食盐
C.蔗糖
D.香油
2.下列有关实验现象的描述正确的是
A.红磷在空气中燃烧产生白色烟雾
B.铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成四氧化三铁固体
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的深
D.硝酸铵固体溶于水放出大量的热
3.夏日里想随时喝到凉爽的饮料,可以自制化学“冰箱”,即把一种化学试剂放入一定量的水中,就可以形成低温小环境.这种试剂可以是下列物质中的
(
)
A.食盐
B.硝酸铵
C.蔗糖
D.氢氧化钠
4.把少量下列物质分别放入水中,充分搅拌,能得到溶液的是
A.面粉
B.泥土
C.花生油
D.氯化钠
5.下图是A、B、C三种物质的溶解度曲线,下列分析正确的是
A.A的溶解度比B大
B.50℃时把50g
A放入100g水中能得到A的饱和溶液,制得溶液的质量分数是50%
C.将A的饱和溶液变为不饱和溶液,可采用降温的方法
D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A>C
6.甲乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
A.50℃时,100g水中加入20g乙并降温至20℃,溶液中溶质的质量分数不变
B.20℃时,可配制溶质质量分数为30%的乙溶液
C.20℃时,50g水中加入20g乙可得到饱和溶液70g
D.20℃时,甲的某一溶液中的溶质质量分数一定小于乙的某一溶液的质量分数
7.右图是甲、乙两种固体物质的溶解度曲线图。下列说法中,错误的是
A.甲物质的溶解度受温度影响变化比乙物质大
B.t1℃时,甲、乙两种物质的饱和溶液的溶质质量分数相等
C.可采用降温的方法使甲物质的不饱和溶液变为饱和溶液
D.t2℃时甲物质的饱和溶液的溶质质量分数为30%
8.一种抗生素为粉末状固体,每瓶含0.
5g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5mL
B.2mL
C.3mL
D.4mL
9.“配置一定溶质质量分数的氯化钠溶液”实验常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.称量时氯化钠放在右盘
B.称量好的氯化钠向烧杯加入中时洒出
C.量取时仰视量筒读数
D.配好的溶液装瓶时洒出
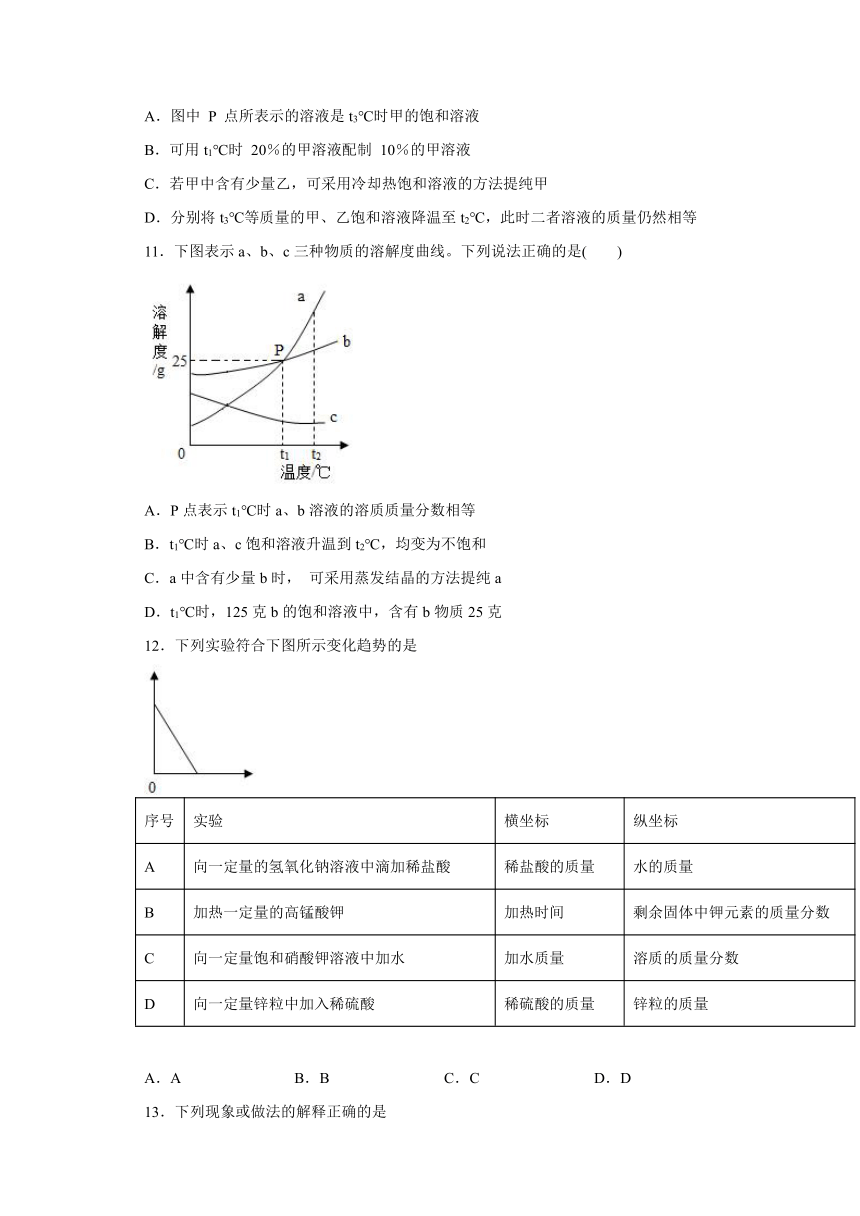
10.如图是甲、乙固体的溶解度曲线。下列说法正确的是(
)
A.图中
P
点所表示的溶液是t3℃时甲的饱和溶液
B.可用t1℃时
20%的甲溶液配制
10%的甲溶液
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,此时二者溶液的质量仍然相等
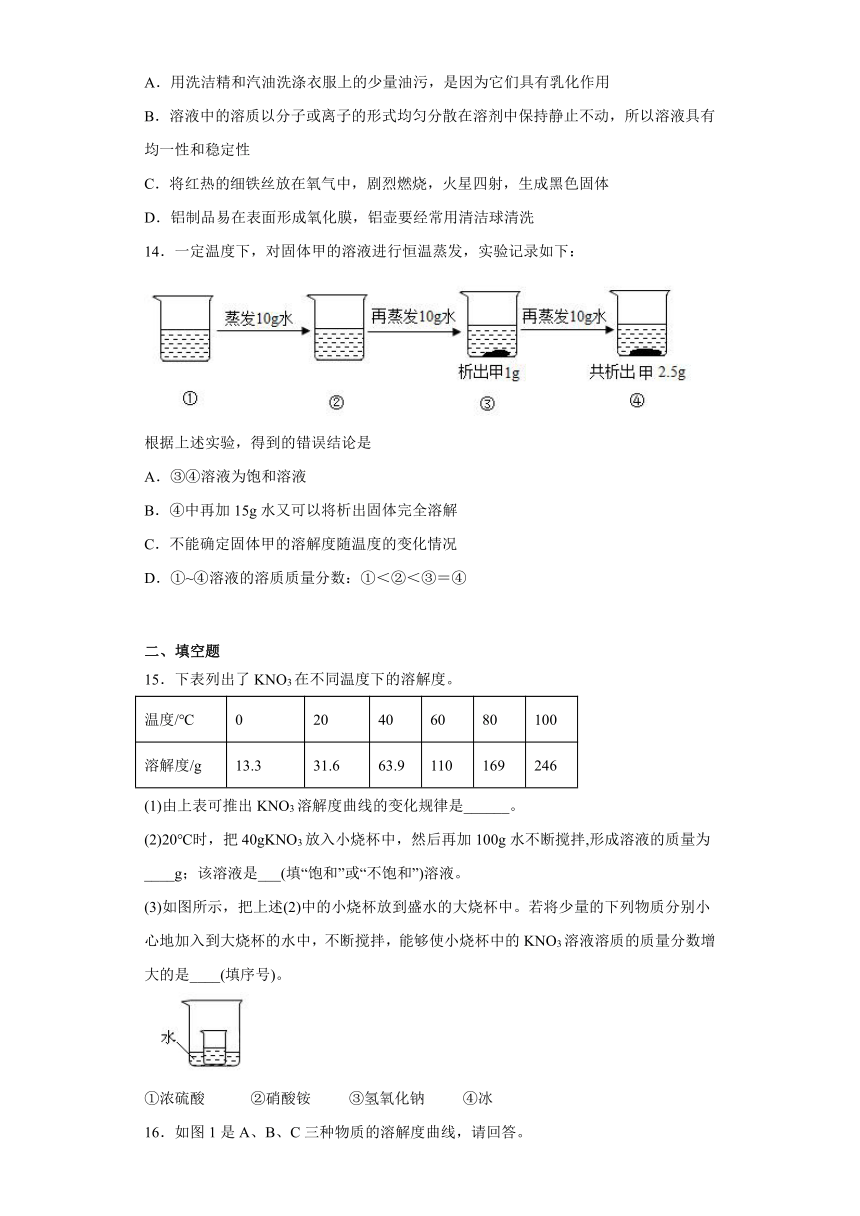
11.下图表示a、b、c三种物质的溶解度曲线。下列说法正确的是(
)
A.P点表示t1℃时a、b溶液的溶质质量分数相等
B.t1℃时a、c饱和溶液升温到t2℃,均变为不饱和
C.a中含有少量b时,
可采用蒸发结晶的方法提纯a
D.t1℃时,125克b的饱和溶液中,含有b物质25克
12.下列实验符合下图所示变化趋势的是
序号
实验
横坐标
纵坐标
A
向一定量的氢氧化钠溶液中滴加稀盐酸
稀盐酸的质量
水的质量
B
加热一定量的高锰酸钾
加热时间
剩余固体中钾元素的质量分数
C
向一定量饱和硝酸钾溶液中加水
加水质量
溶质的质量分数
D
向一定量锌粒中加入稀硫酸
稀硫酸的质量
锌粒的质量
A.A
B.B
C.C
D.D
13.下列现象或做法的解释正确的是
A.用洗洁精和汽油洗涤衣服上的少量油污,是因为它们具有乳化作用
B.溶液中的溶质以分子或离子的形式均匀分散在溶剂中保持静止不动,所以溶液具有均一性和稳定性
C.将红热的细铁丝放在氧气中,剧烈燃烧,火星四射,生成黑色固体
D.铝制品易在表面形成氧化膜,铝壶要经常用清洁球清洗
14.一定温度下,对固体甲的溶液进行恒温蒸发,实验记录如下:
根据上述实验,得到的错误结论是
A.③④溶液为饱和溶液
B.④中再加15g水又可以将析出固体完全溶解
C.不能确定固体甲的溶解度随温度的变化情况
D.①~④溶液的溶质质量分数:①<②<③=④
二、填空题
15.下表列出了KNO3在不同温度下的溶解度。
温度/℃
0
20
40
60
80
100
溶解度/g
13.3
31.6
63.9
110
169
246
(1)由上表可推出KNO3溶解度曲线的变化规律是______。
(2)20℃时,把40gKNO3放入小烧杯中,然后再加100g水不断搅拌,形成溶液的质量为____g;该溶液是___(填“饱和”或“不饱和”)溶液。
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是____(填序号)。
①浓硫酸
②硝酸铵
③氢氧化钠
④冰
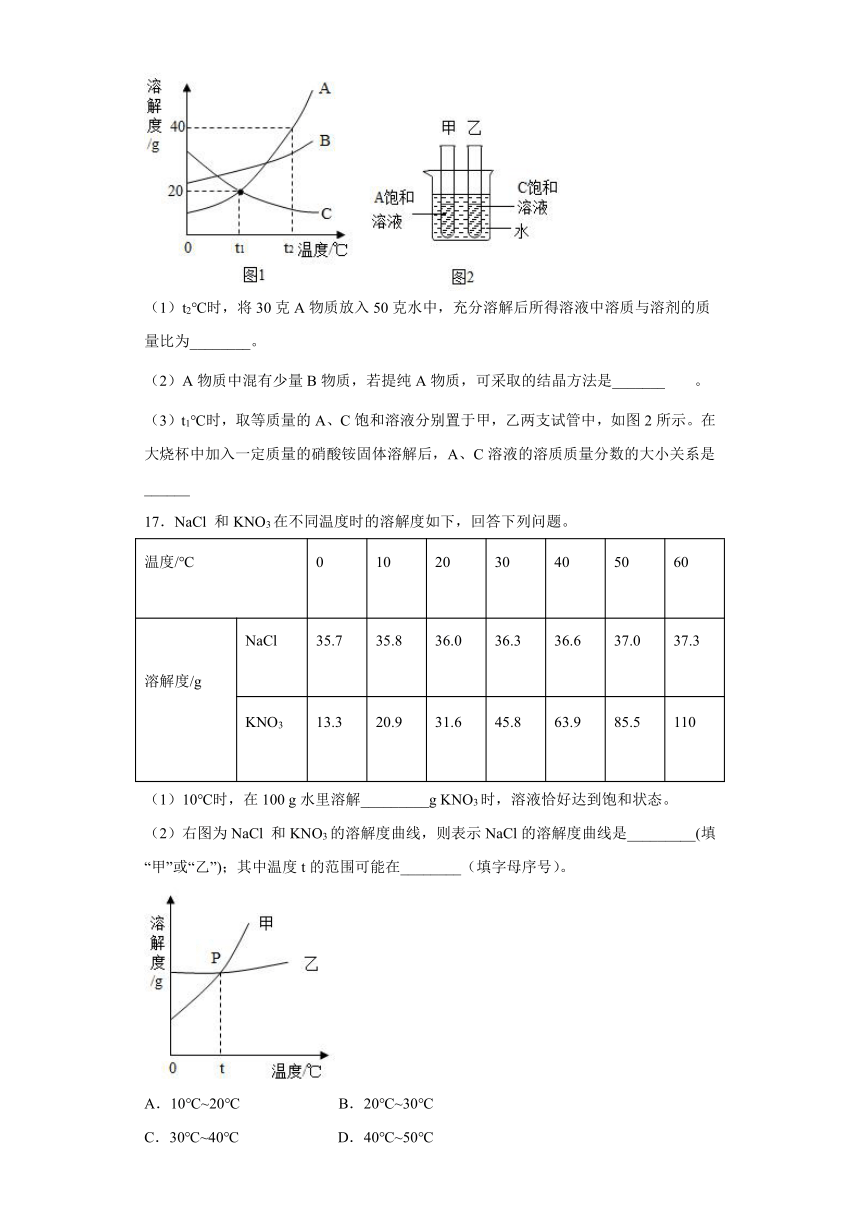
16.如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为________。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是_______。
(3)t1℃时,取等质量的A、C饱和溶液分别置于甲,乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是______
17.NaCl
和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃
0
10
20
30
40
50
60
溶解度/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
(1)10℃时,在100
g水里溶解_________g
KNO3时,溶液恰好达到饱和状态。
(2)右图为NaCl
和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
A.10℃~20℃
B.20℃~30℃
C.30℃~40℃
D.40℃~50℃
(3)10℃时,分别在100
g水中加入35
g
NaCl
和KNO3固体,加热到60℃时,NaCl溶液为__________(填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是____________(填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变
18.
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度
0℃
10℃
20℃
30℃
40℃
氯化钠溶解度/g
35
35.5
36
36.5
37
碳酸钠溶解度/g
6
10
18
36.5
50
(1)t1℃时,NaCl的溶解度是_____g。
(2)t2℃时,将40g
Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为_____。
(3)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是_____(填“降温结晶”或“蒸发结晶”)
19.水和溶液对人类的生产、生活具有重要的意义,请结合所学知识回答下列问题。
(1)如图1是电解水的装置,玻璃管a收集到的气体是_____,该实验说明水是由_____组成的。
(2)自来水厂净化水的过程中用到了大量的活性炭,活性炭的作用是_____,长期饮用硬度大的水不利于人体健康,生活中常用肥皂水来鉴别硬水和软水,并采用_____的方法来降低水的硬度,也能起到杀菌消毒的作用。
(3)如图2是甲、乙、丙三种固体物质(不含结晶水)在水中的溶解度曲线图。请结合图示回答下列问题。
①溶解度随温度升高而减小的是物质是_____;
②t3℃时将50g甲物质放到50g水中充分溶解后所得溶液的质量是_____g;
③某温度下,将丙的饱和溶液转化为不饱和溶液的方法之一是_____;
④将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由小到大的顺序_____。
三、推断题
20.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____
(填离子符号),
流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
21.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
四、实验题
22.请根据X、Y的溶解度曲线。
(1)t3℃时50克水中放入30克X充分溶解后溶液所处的状态_____(是否饱和)。
(2)X中混有少量的Y,你用什么方法除去Y。_____
23.食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料。医学上的生理盐水是用NaCl配置的。下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上图表示的序号表示配制溶液的正确操作顺序_____。
(2)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则需量取水质量为_____。
(3)称量NaCl质量完毕放回砝码时,发现有一个砝码生锈,若其他操作步骤正确,则所配溶液的溶质质量分数_____(填“大于”、“小于”或“等于”)10%。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是_____(填序号)。
A
食盐没有全部溶解即过滤
B
蒸发时食盐飞溅剧烈
C
蒸发后,所得精盐很潮湿
D
器皿上沾有的精盐没全部转移到称量纸上
(5)同学们用上述配制好的溶液再进行配制85g的2%氯化钠溶液:
①需要10%的氯化钠溶液_____g。
②配制过程中的操作步骤为:计算、_____、_____、装瓶。
(6)用氯化钠和碳酸氢铵()可制备碳酸氢钠和氯化铵(),该反应可表示为:。20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7gNaCl和15.8g。理论上从溶液中析出晶体的质量为_____g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
物质
NaCl
溶液度/g
36.0
21.6
37.2
9.6
五、计算题
24.向147g稀硫酸中加入黄铜(铜锌合金),所加黄铜的质量与产生气体的质量关系如图所示。求:
(1)此过程中产生气体的最大质量是________g。
(2)原稀硫酸中溶质的质量分数_______(写出计算过程)。
25.如图是装有浓硫酸的试剂瓶的标签。请计算:
(1)硫酸中硫元素和氧元素的质量比为___________(填最简整数比)。
(2)要把100g该浓硫酸稀释为溶质质量分数20%的硫酸,需要水的质量是_____g。
参考答案
1.D
2.C
3.B
4.D
5.D
6.A
7.D
8.B
9.D
10.C
11.D
12.D
13.C
14.B
15.KNO3的溶解度随温度升高而增大
131.6
饱和
①③
16.2:5
降温结晶
A17.20.9
乙
B
不饱和
BC
18.36.5
2:5
降温结晶
19.氧气
氢元素和氧元素
吸附色素和异味
煮沸
丙
75
增加溶剂
甲<丙<乙
20.过滤
此温度下碳酸氢钠的溶解度较小
氯化铵的溶解度受温度的影响较大
Na+、NH4+
CO2
温度高于60℃时,碳酸氢钠开始分解
21.Fe
+
H2SO4
=
Fe
SO4
+
H2↑
过滤
CO2
7
:
9
1290
22.饱和
降温结晶
23.②⑤①④③
163.8
大于
ABD
17
量取
混匀
7.2
24.(1)0.6(2)20%
25.(1)1:2;(2)390
一、单选题
1.厨房中的下列调味品与水混合不能得到溶液的是
A.食醋
B.食盐
C.蔗糖
D.香油
2.下列有关实验现象的描述正确的是
A.红磷在空气中燃烧产生白色烟雾
B.铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成四氧化三铁固体
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的深
D.硝酸铵固体溶于水放出大量的热
3.夏日里想随时喝到凉爽的饮料,可以自制化学“冰箱”,即把一种化学试剂放入一定量的水中,就可以形成低温小环境.这种试剂可以是下列物质中的
(
)
A.食盐
B.硝酸铵
C.蔗糖
D.氢氧化钠
4.把少量下列物质分别放入水中,充分搅拌,能得到溶液的是
A.面粉
B.泥土
C.花生油
D.氯化钠
5.下图是A、B、C三种物质的溶解度曲线,下列分析正确的是
A.A的溶解度比B大
B.50℃时把50g
A放入100g水中能得到A的饱和溶液,制得溶液的质量分数是50%
C.将A的饱和溶液变为不饱和溶液,可采用降温的方法
D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A>C
6.甲乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
A.50℃时,100g水中加入20g乙并降温至20℃,溶液中溶质的质量分数不变
B.20℃时,可配制溶质质量分数为30%的乙溶液
C.20℃时,50g水中加入20g乙可得到饱和溶液70g
D.20℃时,甲的某一溶液中的溶质质量分数一定小于乙的某一溶液的质量分数
7.右图是甲、乙两种固体物质的溶解度曲线图。下列说法中,错误的是
A.甲物质的溶解度受温度影响变化比乙物质大
B.t1℃时,甲、乙两种物质的饱和溶液的溶质质量分数相等
C.可采用降温的方法使甲物质的不饱和溶液变为饱和溶液
D.t2℃时甲物质的饱和溶液的溶质质量分数为30%
8.一种抗生素为粉末状固体,每瓶含0.
5g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5mL
B.2mL
C.3mL
D.4mL
9.“配置一定溶质质量分数的氯化钠溶液”实验常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.称量时氯化钠放在右盘
B.称量好的氯化钠向烧杯加入中时洒出
C.量取时仰视量筒读数
D.配好的溶液装瓶时洒出
10.如图是甲、乙固体的溶解度曲线。下列说法正确的是(
)
A.图中
P
点所表示的溶液是t3℃时甲的饱和溶液
B.可用t1℃时
20%的甲溶液配制
10%的甲溶液
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,此时二者溶液的质量仍然相等
11.下图表示a、b、c三种物质的溶解度曲线。下列说法正确的是(
)
A.P点表示t1℃时a、b溶液的溶质质量分数相等
B.t1℃时a、c饱和溶液升温到t2℃,均变为不饱和
C.a中含有少量b时,
可采用蒸发结晶的方法提纯a
D.t1℃时,125克b的饱和溶液中,含有b物质25克
12.下列实验符合下图所示变化趋势的是
序号
实验
横坐标
纵坐标
A
向一定量的氢氧化钠溶液中滴加稀盐酸
稀盐酸的质量
水的质量
B
加热一定量的高锰酸钾
加热时间
剩余固体中钾元素的质量分数
C
向一定量饱和硝酸钾溶液中加水
加水质量
溶质的质量分数
D
向一定量锌粒中加入稀硫酸
稀硫酸的质量
锌粒的质量
A.A
B.B
C.C
D.D
13.下列现象或做法的解释正确的是
A.用洗洁精和汽油洗涤衣服上的少量油污,是因为它们具有乳化作用
B.溶液中的溶质以分子或离子的形式均匀分散在溶剂中保持静止不动,所以溶液具有均一性和稳定性
C.将红热的细铁丝放在氧气中,剧烈燃烧,火星四射,生成黑色固体
D.铝制品易在表面形成氧化膜,铝壶要经常用清洁球清洗
14.一定温度下,对固体甲的溶液进行恒温蒸发,实验记录如下:
根据上述实验,得到的错误结论是
A.③④溶液为饱和溶液
B.④中再加15g水又可以将析出固体完全溶解
C.不能确定固体甲的溶解度随温度的变化情况
D.①~④溶液的溶质质量分数:①<②<③=④
二、填空题
15.下表列出了KNO3在不同温度下的溶解度。
温度/℃
0
20
40
60
80
100
溶解度/g
13.3
31.6
63.9
110
169
246
(1)由上表可推出KNO3溶解度曲线的变化规律是______。
(2)20℃时,把40gKNO3放入小烧杯中,然后再加100g水不断搅拌,形成溶液的质量为____g;该溶液是___(填“饱和”或“不饱和”)溶液。
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是____(填序号)。
①浓硫酸
②硝酸铵
③氢氧化钠
④冰
16.如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为________。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是_______。
(3)t1℃时,取等质量的A、C饱和溶液分别置于甲,乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是______
17.NaCl
和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃
0
10
20
30
40
50
60
溶解度/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
(1)10℃时,在100
g水里溶解_________g
KNO3时,溶液恰好达到饱和状态。
(2)右图为NaCl
和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
A.10℃~20℃
B.20℃~30℃
C.30℃~40℃
D.40℃~50℃
(3)10℃时,分别在100
g水中加入35
g
NaCl
和KNO3固体,加热到60℃时,NaCl溶液为__________(填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是____________(填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变
18.
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度
0℃
10℃
20℃
30℃
40℃
氯化钠溶解度/g
35
35.5
36
36.5
37
碳酸钠溶解度/g
6
10
18
36.5
50
(1)t1℃时,NaCl的溶解度是_____g。
(2)t2℃时,将40g
Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为_____。
(3)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是_____(填“降温结晶”或“蒸发结晶”)
19.水和溶液对人类的生产、生活具有重要的意义,请结合所学知识回答下列问题。
(1)如图1是电解水的装置,玻璃管a收集到的气体是_____,该实验说明水是由_____组成的。
(2)自来水厂净化水的过程中用到了大量的活性炭,活性炭的作用是_____,长期饮用硬度大的水不利于人体健康,生活中常用肥皂水来鉴别硬水和软水,并采用_____的方法来降低水的硬度,也能起到杀菌消毒的作用。
(3)如图2是甲、乙、丙三种固体物质(不含结晶水)在水中的溶解度曲线图。请结合图示回答下列问题。
①溶解度随温度升高而减小的是物质是_____;
②t3℃时将50g甲物质放到50g水中充分溶解后所得溶液的质量是_____g;
③某温度下,将丙的饱和溶液转化为不饱和溶液的方法之一是_____;
④将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由小到大的顺序_____。
三、推断题
20.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____
(填离子符号),
流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
21.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
四、实验题
22.请根据X、Y的溶解度曲线。
(1)t3℃时50克水中放入30克X充分溶解后溶液所处的状态_____(是否饱和)。
(2)X中混有少量的Y,你用什么方法除去Y。_____
23.食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料。医学上的生理盐水是用NaCl配置的。下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上图表示的序号表示配制溶液的正确操作顺序_____。
(2)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则需量取水质量为_____。
(3)称量NaCl质量完毕放回砝码时,发现有一个砝码生锈,若其他操作步骤正确,则所配溶液的溶质质量分数_____(填“大于”、“小于”或“等于”)10%。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是_____(填序号)。
A
食盐没有全部溶解即过滤
B
蒸发时食盐飞溅剧烈
C
蒸发后,所得精盐很潮湿
D
器皿上沾有的精盐没全部转移到称量纸上
(5)同学们用上述配制好的溶液再进行配制85g的2%氯化钠溶液:
①需要10%的氯化钠溶液_____g。
②配制过程中的操作步骤为:计算、_____、_____、装瓶。
(6)用氯化钠和碳酸氢铵()可制备碳酸氢钠和氯化铵(),该反应可表示为:。20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7gNaCl和15.8g。理论上从溶液中析出晶体的质量为_____g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
物质
NaCl
溶液度/g
36.0
21.6
37.2
9.6
五、计算题
24.向147g稀硫酸中加入黄铜(铜锌合金),所加黄铜的质量与产生气体的质量关系如图所示。求:
(1)此过程中产生气体的最大质量是________g。
(2)原稀硫酸中溶质的质量分数_______(写出计算过程)。
25.如图是装有浓硫酸的试剂瓶的标签。请计算:
(1)硫酸中硫元素和氧元素的质量比为___________(填最简整数比)。
(2)要把100g该浓硫酸稀释为溶质质量分数20%的硫酸,需要水的质量是_____g。
参考答案
1.D
2.C
3.B
4.D
5.D
6.A
7.D
8.B
9.D
10.C
11.D
12.D
13.C
14.B
15.KNO3的溶解度随温度升高而增大
131.6
饱和
①③
16.2:5
降温结晶
A
乙
B
不饱和
BC
18.36.5
2:5
降温结晶
19.氧气
氢元素和氧元素
吸附色素和异味
煮沸
丙
75
增加溶剂
甲<丙<乙
20.过滤
此温度下碳酸氢钠的溶解度较小
氯化铵的溶解度受温度的影响较大
Na+、NH4+
CO2
温度高于60℃时,碳酸氢钠开始分解
21.Fe
+
H2SO4
=
Fe
SO4
+
H2↑
过滤
CO2
7
:
9
1290
22.饱和
降温结晶
23.②⑤①④③
163.8
大于
ABD
17
量取
混匀
7.2
24.(1)0.6(2)20%
25.(1)1:2;(2)390
同课章节目录
