课题3 溶液的浓度课件(共38张PPT)
图片预览










文档简介
(共38张PPT)
课题3
溶液的浓度
溶质的质量分数
溶液质量
溶质质量
=
×
100%
_____
溶质质量
溶质的质量分数×
溶液质量
=
你知道下面瓶中标签是什么意思吗?
化学纯
500mL
浓盐酸(HCl)
含
HCl
37
%
密度为1.18
g/cm3
工业、农业生产中都会用到一定量浓度的溶液,我们用什么方法来表示一定量浓度的溶液呢?
这就是我们今天要学的内容
淡蓝
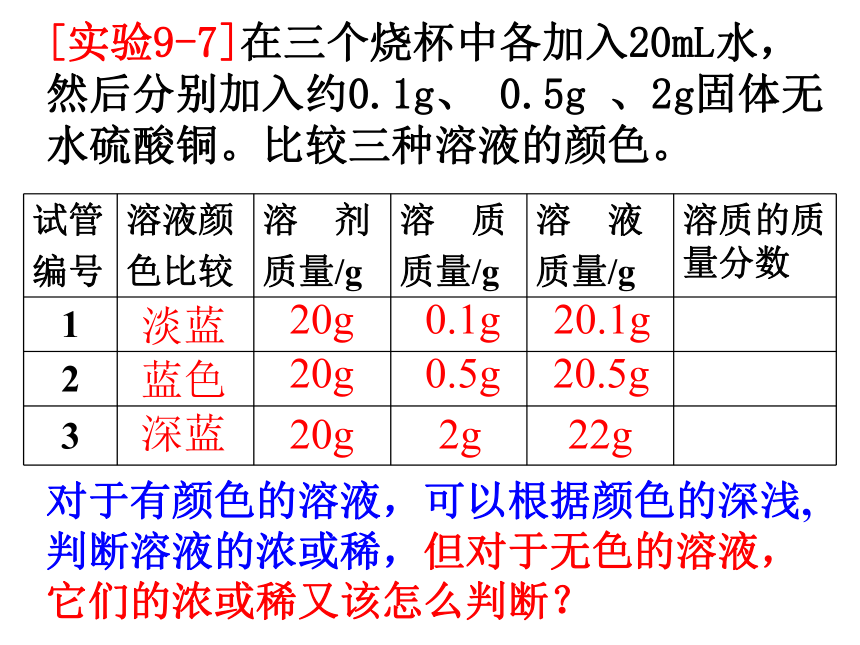
实验9-7
在三个烧杯中各加入20mL水,然后分别加入约0.1g、0.5g、2g
白色无水硫酸铜,比较三种溶液的颜色。
1
2
3
蓝色
深蓝
[实验9-7]在三个烧杯中各加入20mL水,然后分别加入约0.1g、
0.5g
、2g固体无水硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质的质量分数
1
2
3
淡蓝
蓝色
深蓝
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
对于有颜色的溶液,可以根据颜色的深浅,判断溶液的浓或稀,但对于无色的溶液,它们的浓或稀又该怎么判断?
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。因此药液的用量必须要精确,单单从颜色的观察能做到精确吗?
知识点一:溶质的质量分数
1、定义:
是溶质质量和溶液质量之比
2、公式:
溶质质量
溶液质量
×
100%
溶质的质量分数
=
(通常以百分数表示)
溶质质量
溶液质量
×100%
溶质的质量分数=
溶质的质量分数=
溶质质量
溶质质量
+
溶剂质量
×100%
注意:
①溶质质量:是指溶解在溶剂中的溶质,
不溶的不计算在内。
②计算时上下的质量单位要统一
③不要忘记
×100%
,最后得到百分数
因为:溶液质量
=
溶质质量
+
溶剂质量
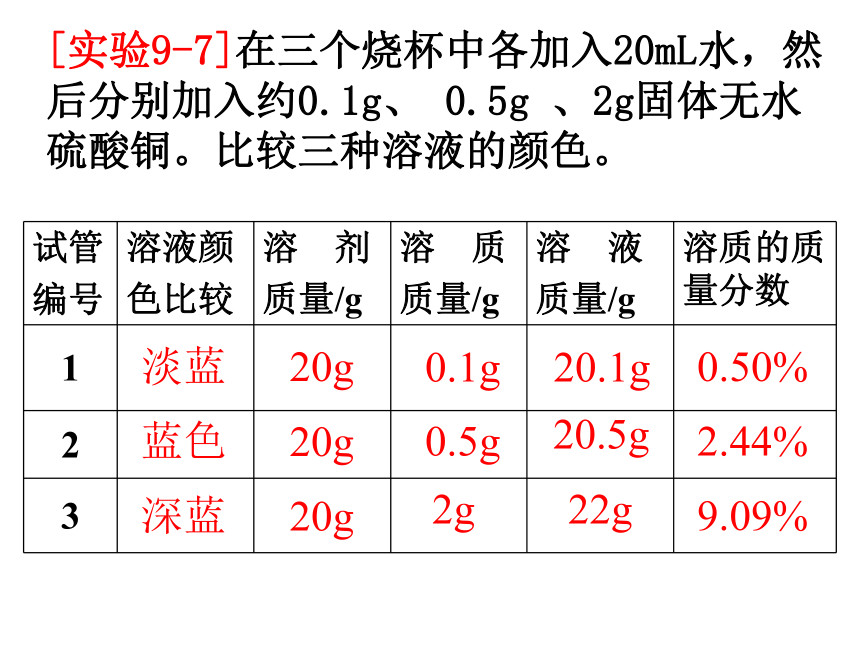
[实验9-7]在三个烧杯中各加入20mL水,然后分别加入约0.1g、
0.5g
、2g固体无水硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质的质量分数
1
2
3
淡蓝
蓝色
深蓝
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.50%
2.44%
9.09%
[实验9-8]
两杯溶液都是无色透明,
怎样比较溶液的稀浓?
溶质质量/g
溶剂(水)质量/g
现
象
溶液中溶质的质量分数
10
90
20
80
结论:同种物质的溶液,溶质的质量分数越大,则溶液浓度越大。
全部溶解
全部溶解
10%
20%
P43
[讨论]中的说法对吗?
不对,根据公式计算,溶质的质量分数应该为26.47%
在饱和溶液中:
溶质的质量分数=
溶解度
100g+溶解度
溶质的质量分数36%
是指:
溶质的质量分数与溶解度的比较
100g溶液中含有36g溶质
在t0C
时,100g水最多溶解该溶质36g
溶质在t0C时溶解度为36g是指:
知识点二:溶质的质量分数计算
溶质质量
溶液质量
×100%
溶质的质量分数=
溶液质量
=
溶质质量
+
溶剂质量
例题1:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶液质量
×溶质的质量分数
答:略。
溶剂质量
溶液质量
溶质质量
—
150kg
16%
24kg
150kg
24kg
126kg
转化:
练习:某温度时,蒸干35g氯化钾溶液,
得到7g氯化钾,求该溶液中溶质的质量
分数。
解:
溶质的质量分数
=
×100%
溶质质量
溶液质量
溶质的质量分数
=
×
100%
=
20%
7g
35g
答:该溶液中溶质的质量分数为20%
例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的稀硫酸溶液,需要水的质量是多少?
稀释前溶质质量
=
稀释后溶质质量
分析:
在稀释前后,溶质的质量是不变的
,所以我们可以抓住这个点来计算。
稀释前溶质质量
=
稀释后溶质质量
m浓溶液×ω浓
=
m稀溶液×ω稀
ω
读欧米伽
,表示溶质的质量分数
浓缩前溶质质量
=
浓缩后溶质质量
m稀溶液×ω稀
=
m浓溶液×ω浓
浓溶液稀释的计算方法:
稀溶液浓缩的计算方法:
例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要水的质量是多少?
解:设稀释后溶液的质量为X
50g
×98%
=
X
×
20%
X
=
答:需要水的质量195g
需要水的质量=
245g
–
50g
=
195g
解:设稀释后溶液的质量为X
100g
×
98%
=
X
×
10%
X
=
980g
需要水的质量
=
980g
-
100g
=
880g
答:需要水的质量为880g。
提高1、把100g质量分数为98%的浓硫酸
稀释成10%的稀硫酸,需要水的质量是多少?
解:
溶液质量
=
溶液密度×
溶液体积
=
1.1g/cm3
×
500mL
=
550g
溶质质量
=
550g
×10%
=
55g
溶剂质量
=
550g
—
55g
=
495g
答:需要氢氧化钠55g,水495g。
提高2:配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水的质量各是多少?
(提示:m
=ρv
)
例3、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质的质量分数。
解:
20℃时食盐饱和溶液的溶质的质量分数为:
=26.5%
36g
100g+36g
答:20℃时食盐饱和溶液的溶质的质量分数为26.5%
巩固1:
100C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数
解:50g水能溶解的NaCl质量为x
x
=
18g
<
20g
则:溶质在溶液中的质量分数为:
100g
36g
=
50g
x
或
×100%
≈
26.5%
36g
100g+36g
18g
50g+18g
×100%
巩固2:在20℃时,将40g硝酸钾固体加入
100g水中,充分搅拌后,仍有8.4g硝
酸钾固体未溶解。请填写下列空白:
①
所得溶液是20℃时硝酸钾的
溶液;
(填“饱和”或“不饱”)
②
20℃时硝酸钾的溶解度为
;
③
所得溶液中硝酸钾的质量分数为
。
24%
31.6g
饱和
巩固3:有气体产生的溶质的质量分数计算
100g某硫酸溶液恰好与13g锌完全反应,试
计算这种硫酸中溶质的质量分数。
解
:设这种硫酸中溶质的质量为X
Zn
+
H2SO4
=
ZnSO4
+
H2↑
65
98
13g
X
13g
X
65
98
X
=
=
19.6
g
98
×
13g
65
溶质的质量分数
=
×
100%
=19.6%
19.6g
100g
答:略
转化:100g某硫酸溶液恰好与13g锌完全反
应,计算反应后所得溶液中溶质的质量分数?
解
:设反应生成的硫酸锌的质量为X
,生成氢气的质量为y
Zn
+
H2SO4
=
ZnSO4
+
H2↑
65
161
2
13g
X
y
13g
X
65
161
13g
y
65
2
解得:
X
=32.2g
y=0.4g
ZnSO4
%
=
×
100%
=28.6%
32.2g
100g+13g-0.4g
4:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?精确到0.1%
解:设稀盐酸的质量为X
,生成的NaCl的质量为Y
NaOH
+
HCl
=
NaCl
+
H2O
40gX10%
10%
X
Y
40
36.5
58.5
X
=
36.5g
Y=5.85g
NaCl%
=
答:略
NaOH
+
HCl
=
NaCl
+
H2O
提高:烧杯中有Na2CO3和
NaCl的混合物共15克,往该烧杯中倒入100克稀盐酸,恰好完全反应生成4.4g气体(假设气体不溶于水也不与水反应),求反应后溶质的质量分数?
提示:Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
解:
设混合物中的
Na2CO3质量为x,反应生成的NaCl质量为y
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
106
x
44
4.4g
117
y
Na2CO3和
NaCl的混合物共15克,往该烧杯中倒入100克稀盐酸,恰好完全反应生成4.4g气体(假设气体不溶于水也不与水反应),求反应后溶质的质量分数?
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
106
x
44
4.4g
117
y
44
4.4g
117
y
=
4.4g
106
x
44
=
X=10.6g
y=11.7g
原混合物中NaCl的质量=15g
-10.6g
=
4.4g
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
106
x
44
4.4g
117
y
44
4.4g
117
y
=
4.4g
106
x
44
=
X=10.6g
y=11.7g
原混合物中NaCl的质量=15g
-10.6g
=
4.4g
反应后NaCl的总质量=
NaCl%=
16.1g
15g
+
100g
-
4.4g
×100%
=14.6%
4.4g
+
11.7g
=16.1g
巩固4:有沉淀生成的溶质的质量分数计算
例:80g硫酸铜与324g氢氧化钠溶液完全
反应,求反应后的溶质的质量分数。
Cu-64
S-32
Na-23
O-16
H-1
反应式:CuSO4+2NaOH
=
Cu(OH)2↓+Na2SO4
解:设反应生成的氢氧化铜的质量为X
,
生成的硫酸钠的质量为y
CuSO4
+
2NaOH
=
Cu(OH)2↓+
Na2SO4
160
98
142
80g
X
y
例:80g硫酸铜与324g氢氧化钠溶液完全
反应,求反应后的溶质的质量分数。
CuSO4+2NaOH
=
Cu(OH)2↓+Na2SO4
解:设反应生成的氢氧化铜的质量为X
,
生成的硫酸钠的质量为y
CuSO4
+
2NaOH
=
Cu(OH)2↓+
Na2SO4
160
98
142
80g
X
y
80g
X
160
98
=
80g
y
160
142
=
X=49g
y=71g
Na2SO4%
=
×100%
=
20%
71g
80g+324g-49g
根据上面的几道题目,你能得出反应后溶质的质量、反应后溶液的质量应该怎么求?
反应后溶液的质量
反应生成的气体质量、沉淀质量
=
进入溶液的物质的质量
原溶液的质量
+
-
反应后溶质的质量
=
原混合物中溶质的质量
+
反应生成的溶质的质量
巩固5:结晶水合物溶于水制得溶液,求溶质的质量分数计算
分析:所得的溶液中的溶质为不含结晶水的CuSO4
例:25g胆矾[CuSO4·5H2O]完全溶于100g水中,求所得溶液中溶质的质量分数。
Cu-64
S-32
O-16
CuSO4
的质量=25g×
×100%
=
16g
160
250
CuSO4
%
=
×100%=
12.8%
16g
125g
答:略
解:
综合:A、B、C三种物质
的溶解度曲线如图所示.
(1)P点表示t2℃时完
全溶解60g
A物质至少
需____?g水。
(2)t2℃时等质量的A、B、C
三种饱和溶液中所含溶剂质量最多的是____(填写物质序号,下同。
200
C
(3)现有A、B、C三
种物质的浓溶液,适
用于海水晒盐原理进
行结晶的是_____。
(4)将t1℃时A、B、C
三种物质的饱和溶液分别升温至t2℃时,
所得溶液的溶质质量分数由大到小的顺序是______________
B
B
>
C
>
A
在曲线图中判断溶质的质量分数的大小的方法:
状态一样时,找最低点;
状态不一样时,具体分析。
例如:请根据右图中甲、乙、丙三种固体的溶解度曲线回答问题。
(1)
T3
℃时,在各加有甲、乙、丙
30
克固体的三个烧杯中,分别倒入50
克水,充分搅拌后,形成饱和溶液的是_________;
当温度降低至
T1
℃时,
此三杯溶液中溶质的质
量分数由大到小的顺序
为______________。
乙、丙
乙=丙>甲
状态不同,不能用最低点的方法来判断。
(2)
在
T2
℃时(温度不变),将接近饱和的丙物质的溶液变为饱和溶液,下列有关分析正确的是_____(填序号)
①溶质的质量一定不变
②溶剂的质量可能不变
③溶液的质量一定增大
④溶液中溶质的质量分数一定增大
②④
请预习第十单元的内容
课题3
溶液的浓度
溶质的质量分数
溶液质量
溶质质量
=
×
100%
_____
溶质质量
溶质的质量分数×
溶液质量
=
你知道下面瓶中标签是什么意思吗?
化学纯
500mL
浓盐酸(HCl)
含
HCl
37
%
密度为1.18
g/cm3
工业、农业生产中都会用到一定量浓度的溶液,我们用什么方法来表示一定量浓度的溶液呢?
这就是我们今天要学的内容
淡蓝
实验9-7
在三个烧杯中各加入20mL水,然后分别加入约0.1g、0.5g、2g
白色无水硫酸铜,比较三种溶液的颜色。
1
2
3
蓝色
深蓝
[实验9-7]在三个烧杯中各加入20mL水,然后分别加入约0.1g、
0.5g
、2g固体无水硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质的质量分数
1
2
3
淡蓝
蓝色
深蓝
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
对于有颜色的溶液,可以根据颜色的深浅,判断溶液的浓或稀,但对于无色的溶液,它们的浓或稀又该怎么判断?
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。因此药液的用量必须要精确,单单从颜色的观察能做到精确吗?
知识点一:溶质的质量分数
1、定义:
是溶质质量和溶液质量之比
2、公式:
溶质质量
溶液质量
×
100%
溶质的质量分数
=
(通常以百分数表示)
溶质质量
溶液质量
×100%
溶质的质量分数=
溶质的质量分数=
溶质质量
溶质质量
+
溶剂质量
×100%
注意:
①溶质质量:是指溶解在溶剂中的溶质,
不溶的不计算在内。
②计算时上下的质量单位要统一
③不要忘记
×100%
,最后得到百分数
因为:溶液质量
=
溶质质量
+
溶剂质量
[实验9-7]在三个烧杯中各加入20mL水,然后分别加入约0.1g、
0.5g
、2g固体无水硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质的质量分数
1
2
3
淡蓝
蓝色
深蓝
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.50%
2.44%
9.09%
[实验9-8]
两杯溶液都是无色透明,
怎样比较溶液的稀浓?
溶质质量/g
溶剂(水)质量/g
现
象
溶液中溶质的质量分数
10
90
20
80
结论:同种物质的溶液,溶质的质量分数越大,则溶液浓度越大。
全部溶解
全部溶解
10%
20%
P43
[讨论]中的说法对吗?
不对,根据公式计算,溶质的质量分数应该为26.47%
在饱和溶液中:
溶质的质量分数=
溶解度
100g+溶解度
溶质的质量分数36%
是指:
溶质的质量分数与溶解度的比较
100g溶液中含有36g溶质
在t0C
时,100g水最多溶解该溶质36g
溶质在t0C时溶解度为36g是指:
知识点二:溶质的质量分数计算
溶质质量
溶液质量
×100%
溶质的质量分数=
溶液质量
=
溶质质量
+
溶剂质量
例题1:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶液质量
×溶质的质量分数
答:略。
溶剂质量
溶液质量
溶质质量
—
150kg
16%
24kg
150kg
24kg
126kg
转化:
练习:某温度时,蒸干35g氯化钾溶液,
得到7g氯化钾,求该溶液中溶质的质量
分数。
解:
溶质的质量分数
=
×100%
溶质质量
溶液质量
溶质的质量分数
=
×
100%
=
20%
7g
35g
答:该溶液中溶质的质量分数为20%
例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的稀硫酸溶液,需要水的质量是多少?
稀释前溶质质量
=
稀释后溶质质量
分析:
在稀释前后,溶质的质量是不变的
,所以我们可以抓住这个点来计算。
稀释前溶质质量
=
稀释后溶质质量
m浓溶液×ω浓
=
m稀溶液×ω稀
ω
读欧米伽
,表示溶质的质量分数
浓缩前溶质质量
=
浓缩后溶质质量
m稀溶液×ω稀
=
m浓溶液×ω浓
浓溶液稀释的计算方法:
稀溶液浓缩的计算方法:
例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要水的质量是多少?
解:设稀释后溶液的质量为X
50g
×98%
=
X
×
20%
X
=
答:需要水的质量195g
需要水的质量=
245g
–
50g
=
195g
解:设稀释后溶液的质量为X
100g
×
98%
=
X
×
10%
X
=
980g
需要水的质量
=
980g
-
100g
=
880g
答:需要水的质量为880g。
提高1、把100g质量分数为98%的浓硫酸
稀释成10%的稀硫酸,需要水的质量是多少?
解:
溶液质量
=
溶液密度×
溶液体积
=
1.1g/cm3
×
500mL
=
550g
溶质质量
=
550g
×10%
=
55g
溶剂质量
=
550g
—
55g
=
495g
答:需要氢氧化钠55g,水495g。
提高2:配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水的质量各是多少?
(提示:m
=ρv
)
例3、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质的质量分数。
解:
20℃时食盐饱和溶液的溶质的质量分数为:
=26.5%
36g
100g+36g
答:20℃时食盐饱和溶液的溶质的质量分数为26.5%
巩固1:
100C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数
解:50g水能溶解的NaCl质量为x
x
=
18g
<
20g
则:溶质在溶液中的质量分数为:
100g
36g
=
50g
x
或
×100%
≈
26.5%
36g
100g+36g
18g
50g+18g
×100%
巩固2:在20℃时,将40g硝酸钾固体加入
100g水中,充分搅拌后,仍有8.4g硝
酸钾固体未溶解。请填写下列空白:
①
所得溶液是20℃时硝酸钾的
溶液;
(填“饱和”或“不饱”)
②
20℃时硝酸钾的溶解度为
;
③
所得溶液中硝酸钾的质量分数为
。
24%
31.6g
饱和
巩固3:有气体产生的溶质的质量分数计算
100g某硫酸溶液恰好与13g锌完全反应,试
计算这种硫酸中溶质的质量分数。
解
:设这种硫酸中溶质的质量为X
Zn
+
H2SO4
=
ZnSO4
+
H2↑
65
98
13g
X
13g
X
65
98
X
=
=
19.6
g
98
×
13g
65
溶质的质量分数
=
×
100%
=19.6%
19.6g
100g
答:略
转化:100g某硫酸溶液恰好与13g锌完全反
应,计算反应后所得溶液中溶质的质量分数?
解
:设反应生成的硫酸锌的质量为X
,生成氢气的质量为y
Zn
+
H2SO4
=
ZnSO4
+
H2↑
65
161
2
13g
X
y
13g
X
65
161
13g
y
65
2
解得:
X
=32.2g
y=0.4g
ZnSO4
%
=
×
100%
=28.6%
32.2g
100g+13g-0.4g
4:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?精确到0.1%
解:设稀盐酸的质量为X
,生成的NaCl的质量为Y
NaOH
+
HCl
=
NaCl
+
H2O
40gX10%
10%
X
Y
40
36.5
58.5
X
=
36.5g
Y=5.85g
NaCl%
=
答:略
NaOH
+
HCl
=
NaCl
+
H2O
提高:烧杯中有Na2CO3和
NaCl的混合物共15克,往该烧杯中倒入100克稀盐酸,恰好完全反应生成4.4g气体(假设气体不溶于水也不与水反应),求反应后溶质的质量分数?
提示:Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
解:
设混合物中的
Na2CO3质量为x,反应生成的NaCl质量为y
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
106
x
44
4.4g
117
y
Na2CO3和
NaCl的混合物共15克,往该烧杯中倒入100克稀盐酸,恰好完全反应生成4.4g气体(假设气体不溶于水也不与水反应),求反应后溶质的质量分数?
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
106
x
44
4.4g
117
y
44
4.4g
117
y
=
4.4g
106
x
44
=
X=10.6g
y=11.7g
原混合物中NaCl的质量=15g
-10.6g
=
4.4g
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+
H2O
106
x
44
4.4g
117
y
44
4.4g
117
y
=
4.4g
106
x
44
=
X=10.6g
y=11.7g
原混合物中NaCl的质量=15g
-10.6g
=
4.4g
反应后NaCl的总质量=
NaCl%=
16.1g
15g
+
100g
-
4.4g
×100%
=14.6%
4.4g
+
11.7g
=16.1g
巩固4:有沉淀生成的溶质的质量分数计算
例:80g硫酸铜与324g氢氧化钠溶液完全
反应,求反应后的溶质的质量分数。
Cu-64
S-32
Na-23
O-16
H-1
反应式:CuSO4+2NaOH
=
Cu(OH)2↓+Na2SO4
解:设反应生成的氢氧化铜的质量为X
,
生成的硫酸钠的质量为y
CuSO4
+
2NaOH
=
Cu(OH)2↓+
Na2SO4
160
98
142
80g
X
y
例:80g硫酸铜与324g氢氧化钠溶液完全
反应,求反应后的溶质的质量分数。
CuSO4+2NaOH
=
Cu(OH)2↓+Na2SO4
解:设反应生成的氢氧化铜的质量为X
,
生成的硫酸钠的质量为y
CuSO4
+
2NaOH
=
Cu(OH)2↓+
Na2SO4
160
98
142
80g
X
y
80g
X
160
98
=
80g
y
160
142
=
X=49g
y=71g
Na2SO4%
=
×100%
=
20%
71g
80g+324g-49g
根据上面的几道题目,你能得出反应后溶质的质量、反应后溶液的质量应该怎么求?
反应后溶液的质量
反应生成的气体质量、沉淀质量
=
进入溶液的物质的质量
原溶液的质量
+
-
反应后溶质的质量
=
原混合物中溶质的质量
+
反应生成的溶质的质量
巩固5:结晶水合物溶于水制得溶液,求溶质的质量分数计算
分析:所得的溶液中的溶质为不含结晶水的CuSO4
例:25g胆矾[CuSO4·5H2O]完全溶于100g水中,求所得溶液中溶质的质量分数。
Cu-64
S-32
O-16
CuSO4
的质量=25g×
×100%
=
16g
160
250
CuSO4
%
=
×100%=
12.8%
16g
125g
答:略
解:
综合:A、B、C三种物质
的溶解度曲线如图所示.
(1)P点表示t2℃时完
全溶解60g
A物质至少
需____?g水。
(2)t2℃时等质量的A、B、C
三种饱和溶液中所含溶剂质量最多的是____(填写物质序号,下同。
200
C
(3)现有A、B、C三
种物质的浓溶液,适
用于海水晒盐原理进
行结晶的是_____。
(4)将t1℃时A、B、C
三种物质的饱和溶液分别升温至t2℃时,
所得溶液的溶质质量分数由大到小的顺序是______________
B
B
>
C
>
A
在曲线图中判断溶质的质量分数的大小的方法:
状态一样时,找最低点;
状态不一样时,具体分析。
例如:请根据右图中甲、乙、丙三种固体的溶解度曲线回答问题。
(1)
T3
℃时,在各加有甲、乙、丙
30
克固体的三个烧杯中,分别倒入50
克水,充分搅拌后,形成饱和溶液的是_________;
当温度降低至
T1
℃时,
此三杯溶液中溶质的质
量分数由大到小的顺序
为______________。
乙、丙
乙=丙>甲
状态不同,不能用最低点的方法来判断。
(2)
在
T2
℃时(温度不变),将接近饱和的丙物质的溶液变为饱和溶液,下列有关分析正确的是_____(填序号)
①溶质的质量一定不变
②溶剂的质量可能不变
③溶液的质量一定增大
④溶液中溶质的质量分数一定增大
②④
请预习第十单元的内容
同课章节目录
