课题1 常见的酸和碱(第 2 课时)课件(共30张PPT)
文档属性
| 名称 | 课题1 常见的酸和碱(第 2 课时)课件(共30张PPT) | 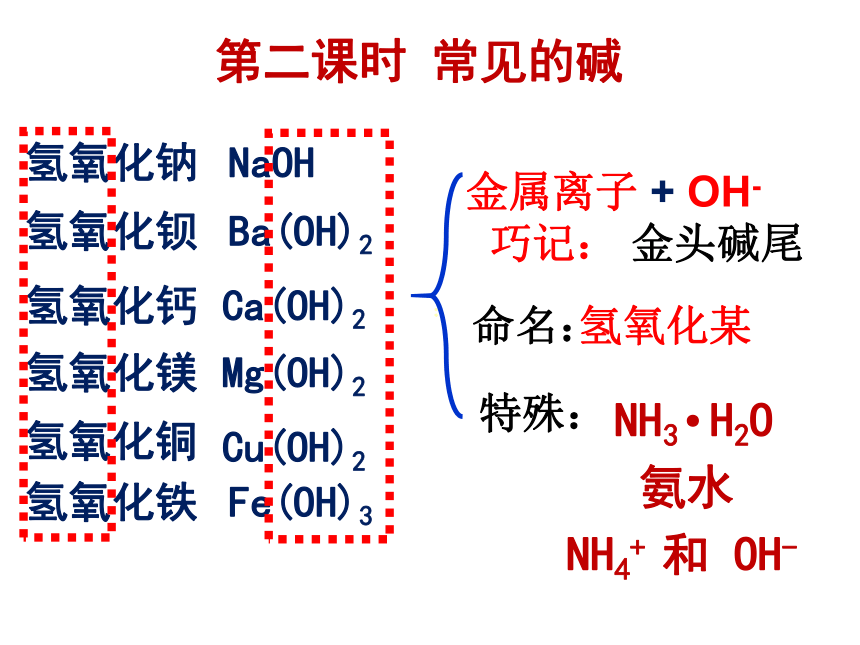 | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-15 11:10:16 | ||
图片预览







文档简介
(共30张PPT)
www.themegallery.com
Company
Logo
氢氧化钠
氢氧化钡
氢氧化钙
氢氧化镁
氢氧化铜
氢氧化铁
NaOH
Ba(OH)2
Ca(OH)2
Mg(OH)2
Cu(OH)2
Fe(OH)3
碱:
组成特点:
命名:
氢氧化某
金属离子
+
OH-
巧记:
金头碱尾
特殊:
第二课时
常见的碱
NH3
H2O
氨水
NH4+
和
OH-
·
氢氧化钠
NaOH
实
验
10-5
现
象
分
析
观察氢氧化钠的颜色、状态
将氢氧化钠放在表面皿上,放置一会儿
将氢氧化钠放在盛有少量水的试管里,并用手触摸试管外壁
白色固体
表面潮湿并逐渐溶解
NaOH能吸收水分
发烫
溶于水放出热量
NaOH固体在空气中易潮解,可用作某些气体(如:H2、O2、NH3)的干燥剂
NaOH吸收空气中的水分
思考:
1.
NaOH的俗名?
2.氢氧化钠的用途?
火碱、烧碱、苛性钠
[kē]
肥皂、造纸、纺织、印染等
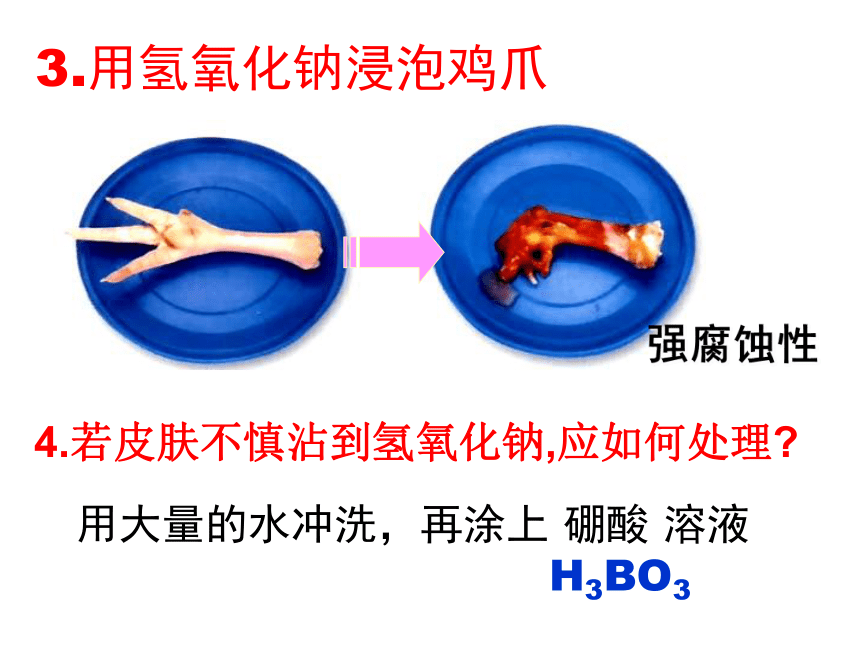
4.若皮肤不慎沾到氢氧化钠,应如何处理?
强腐蚀性
3.用氢氧化钠浸泡鸡爪
用大量的水冲洗,再涂上
硼酸
溶液
H3BO3
www.themegallery.com
Company
Logo
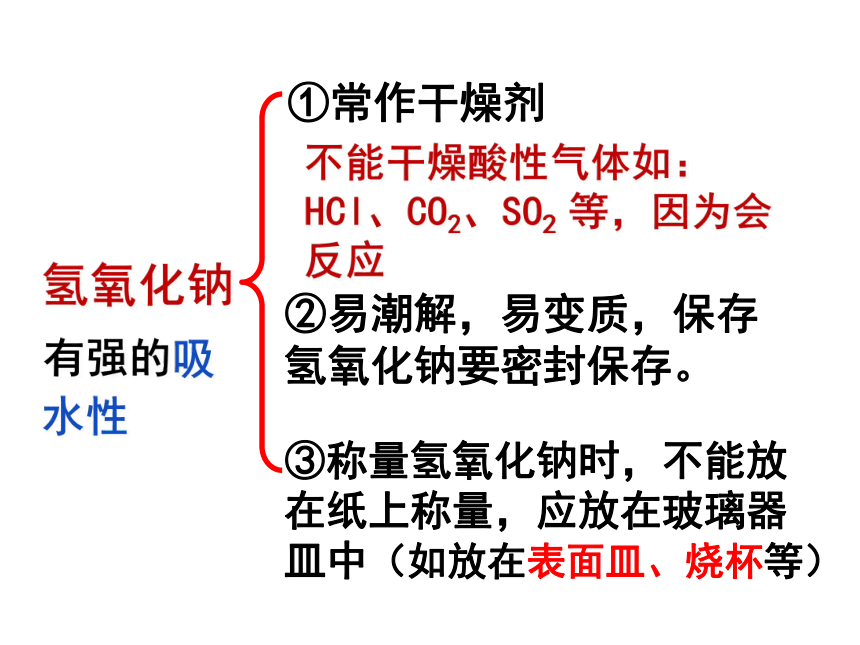
有强的吸水性
①常作干燥剂
不能干燥酸性气体如:
HCl、CO2、SO2
等,因为会反应
②易潮解,易变质,保存氢氧化钠要密封保存。
③称量氢氧化钠时,不能放在纸上称量,应放在玻璃器皿中(如放在表面皿、烧杯等)
氢氧化钠
www.themegallery.com
Company
Logo
拓展知识1
酸性气体:能与碱作用生成盐的气体
碱性气体:能与酸作用生成盐的气体
二氧化碳CO2、氯气Cl2、硫化氢H2S、
二氧化氮NO2
、氯化氢HCl、二氧化硫SO2
等
氨气NH3、联氨N2H4、磷化氢PH3
中性气体:不是酸性也不是碱性的气体
氮气N2、氧气O2
、氢气H2
、甲烷CH4、一氧化碳CO、惰性气体
等
www.themegallery.com
Company
Logo
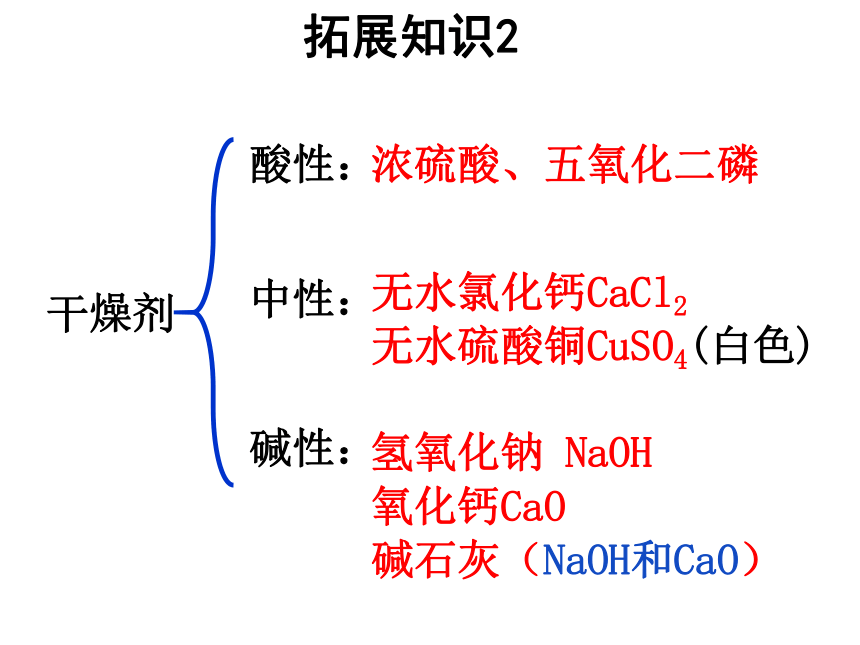
拓展知识2
干燥剂
酸性:
中性:
碱性:
浓硫酸、五氧化二磷
无水氯化钙CaCl2
无水硫酸铜CuSO4(白色)
氢氧化钠
NaOH
氧化钙CaO
碱石灰(NaOH和CaO)
现
象
颜色、状态
在水中的溶解情况
向澄清溶液中通入CO2
白色粉末状固体
微溶于水
澄清液体变白色浑浊
怎样制取“氢氧化钙”?
CaO
+
H2O
Ca(OH)2
氢氧化钙
俗称熟石灰
或消石灰
生石灰与水反应制得到氢氧化钙
实验10-6
石灰乳、石灰浆含有较多未溶解氢氧化钙
www.themegallery.com
CO
2
+
Ca(OH)2
=
CaCO3
↓+
H2O
思考:用所学的知识解答下列的问题?
1.园林工人用含有硫磺粉石灰浆将树干底部
刷白的好处是?
2.用石灰沙浆砌砖抹墙很牢固的原因?
3.装石灰水的试剂瓶用的时间长了,瓶壁
上有一层白色的膜。白色膜是什么?
4.检验二氧化碳,可用澄清石灰水。发生的
反应是?
好处有:
1、对新植树木起到防冻作用。
2、杀死病虫害越冬虫卵。
3、整洁美观。
4、减少了早春树体对太阳热能的吸收,
降低树温提升速度,使树体萌动推迟
2-3天左右,避免树体早春回寒的危害。
www.themegallery.com
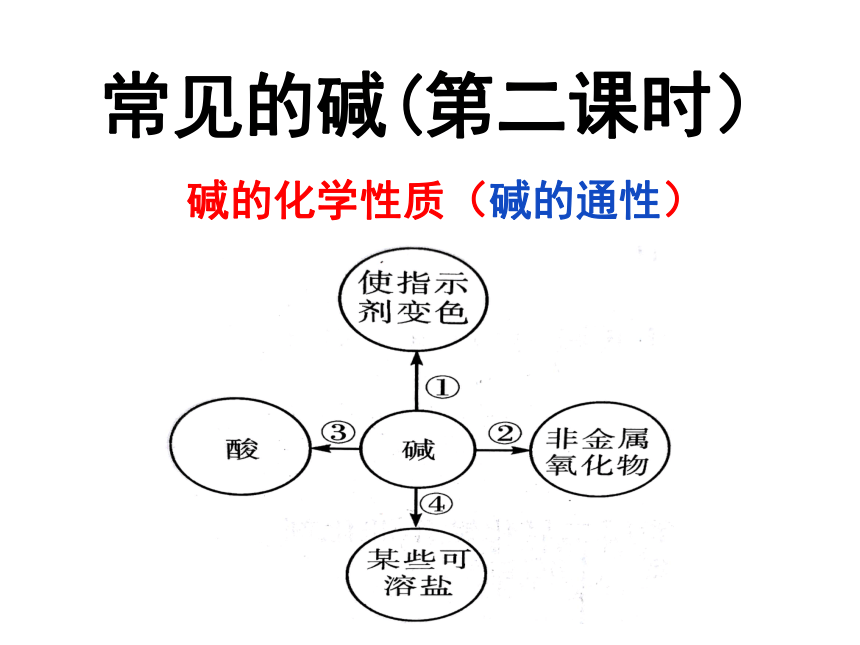
常见的碱(第二课时)
碱的化学性质(碱的通性)
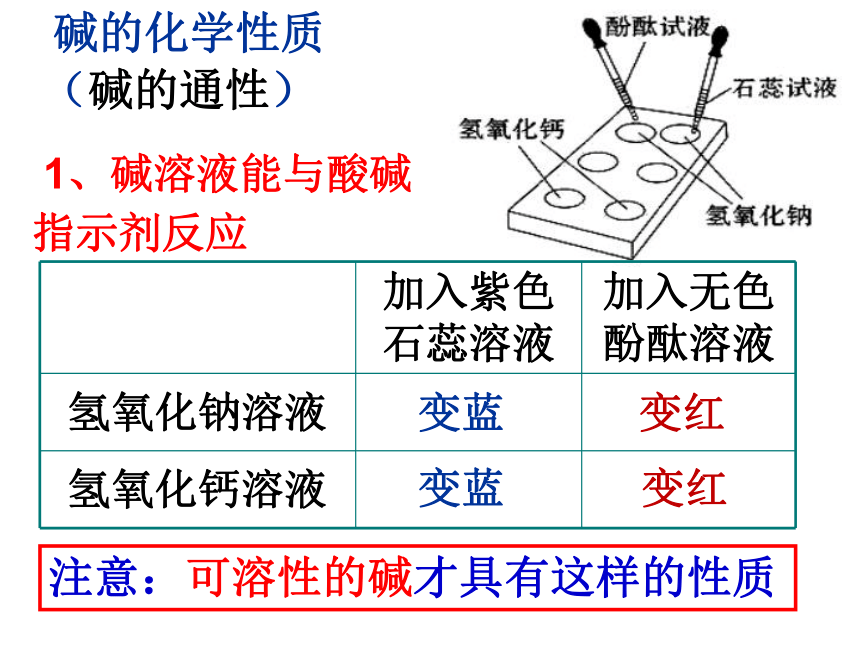
1、碱溶液能与酸碱
指示剂反应
加入紫色
石蕊溶液
加入无色
酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
变蓝
注意:可溶性的碱才具有这样的性质
变蓝
变红
变红
碱的化学性质
(碱的通性)
www.themegallery.com
Company
Logo
加入50mL水振荡
CO2
CO2
CO2
加入50mL饱和的氢氧化钙溶液振荡
加入50mL饱和的氢氧化钠溶液振荡
思考:除去二氧化碳用氢氧化钙溶液,还是用氢氧化钠溶液的效果好?
如何证明CO2和NaOH发生反应?
提示:可设计能显示压强变化的装置来证明
www.themegallery.com
Company
Logo
二氧化碳
+氢氧化钙的反应方程式
二氧化碳+氢氧化钠的反应方程式
CO2
+
Ca(OH)2
=
CaCO3↓
+
H2O
CO2
+
2NaOH
=
Na2CO3
+
H2O
2、非金属氧化物
+
碱
=
盐
+
水
(部分)
(可溶)
非金属氧化物
碱
盐
水
非金属氧化物
碱
盐
水
www.themegallery.com
Company
Logo
二氧化硫
+
氢氧化钠
的反应方程式
少量的二氧化硫+氢氧化钙
的反应方程式
三氧化硫+
氢氧化钠
的反应方程式
SO2
+
2NaOH
=
Na2SO3+H2O
SO2
+
Ca(OH)2
=
CaSO3↓+H2O
SO3
+
2NaOH
=
Na2SO4+H2O
练一练:
①在硫酸铜溶液中滴加氢氧化钠溶液
2
Cu(OH)2↓+
Na2SO4
3
Fe(OH)3↓+
3NaCl
结论:
3、碱能与某些盐反应(都可溶)
②在氯化铁溶液中滴加氢氧化钠溶液
盐
碱
新碱
新盐
盐
碱
新碱
新盐
碱
+
盐
=
新碱
+
新盐
(溶液)
(溶液)
NaOH
+
CuSO4
=
NaOH
+
FeCl3
=
向碳酸钠溶液中滴加氢氧化钙溶液,写出反应的化学方程式
练一练:
Ca(OH)2
+
Na2CO3
=
CaCO3↓+
2NaOH
上面的这个反应属于碱的通性吗?
答:不属于,因为碱的通性是指OH-参加反应变成水、气体或沉淀,但上面的反应,OH-一直以离子形式存在,没有变成水、气体或沉淀,它只是打酱油的。
碱
+
酸
=
盐
+
水
结论:
Ca(OH)
2
+
H2SO4
=
NaOH
+
HCl
=
请写出氢氧化钠和盐酸反应
请写出氢氧化钙和硫酸反应
4、碱与酸反应生成盐和水
NaCl
+
H2O
CaSO4
+
2H2O
www.themegallery.com
Company
Logo
小结:碱的化学性质(碱的通性)
1、碱与酸碱指示剂反应
(可溶性碱)
2、碱与某些非金属氧化物反应(可溶性碱)
可溶性碱+
某些非金属氧化物
=
盐
+
水
3、碱与某些盐溶液反应(都可溶)
可溶性碱
+
某些盐溶液
=
新盐
+
新碱
4、碱与酸反应
碱
+
酸
=
盐
+
水
物质
盐酸
硫酸
NaOH溶液
Ca(OH)2溶液
蒸馏水
乙醇
导电性
实验10-7试验物质的导电性
酸溶液、碱溶液为什么能导电?而蒸馏水、乙醇为什么不导电?
导电
导电
导电
导电
电
不导
电
不导
HCl
=
H+
+
Cl-
H2SO4
=
2H+
+
SO42-
NaOH
=
Na+
+
OH-
Ca(OH)2
=
Ca2+
+
2OH-
酸为什么具有相似的化学性质?
碱为什么具有相似的化学性质?
同样,碳酸钠、硫酸镁和氯化铵的溶液也能够导电,说明在水溶液中也能解离出能够自由离子。
Na2CO3
MgSO4
NH4+
+
Cl-
在水溶液中解离出金属离子(NH4+)和酸根离子的化合物叫做“盐”
2Na+
+
CO32-
Mg2+
+
SO42-
NH4Cl
课外知识
答:不一样。
溶液导电是因为有自由离子才导电;
金属导电是因为金属里含有大量的自由电子,电子的定向运动形成电流。
溶液导电和金属导电的原因一样吗?
拓展知识3
难溶性的碱受热时易分解为金属氧化物和水。
难溶性碱
金属氧化物+
H2O
△
Mg(OH)2
====
MgO
+
H2O
2Fe(OH)3
====
Fe2O3
+
3H2O
Cu(OH)
2
====
CuO
+
H2O
△
△
△
二、盐:
由金属离子(包括NH4+)和酸根离子构成的化合物。
盐
阳离子:金属离子、NH4+
阴离子:酸根离子
课题小结
一、碱的化学性质:
1.汞
2.
氖气
3.硫酸
4.干冰
5.氧化铁
6.铜
7.熟石灰
8.生石灰
9.烧碱
10.氯酸钾
11.氯化铁
12.硫酸钠
写出下列物质
的化学式并指出物质的类别
练习
Hg
Ne
H2SO4
CO2
Fe2O3
Cu
Ca(OH)2
CaO
NaOH
KClO3
FeCl3
Na2SO4
2、现有两瓶无色的石灰水和氢氧化钠
溶液,请用学过的方法鉴别?
方法一:
分别取1-2mL未知液于试管中,向试管中通入CO2
,出现白色沉淀的溶液为石灰水,无现象的是氢氧化钠溶液。
方法二:分别取1-2mL未知液于试管中,向试管中滴入几滴碳酸钠溶液,出现白色沉淀的为石灰水,无现象的是氢氧化钠溶液。
请预习下一节课的内容
www.themegallery.com
Company
Logo
氢氧化钠
氢氧化钡
氢氧化钙
氢氧化镁
氢氧化铜
氢氧化铁
NaOH
Ba(OH)2
Ca(OH)2
Mg(OH)2
Cu(OH)2
Fe(OH)3
碱:
组成特点:
命名:
氢氧化某
金属离子
+
OH-
巧记:
金头碱尾
特殊:
第二课时
常见的碱
NH3
H2O
氨水
NH4+
和
OH-
·
氢氧化钠
NaOH
实
验
10-5
现
象
分
析
观察氢氧化钠的颜色、状态
将氢氧化钠放在表面皿上,放置一会儿
将氢氧化钠放在盛有少量水的试管里,并用手触摸试管外壁
白色固体
表面潮湿并逐渐溶解
NaOH能吸收水分
发烫
溶于水放出热量
NaOH固体在空气中易潮解,可用作某些气体(如:H2、O2、NH3)的干燥剂
NaOH吸收空气中的水分
思考:
1.
NaOH的俗名?
2.氢氧化钠的用途?
火碱、烧碱、苛性钠
[kē]
肥皂、造纸、纺织、印染等
4.若皮肤不慎沾到氢氧化钠,应如何处理?
强腐蚀性
3.用氢氧化钠浸泡鸡爪
用大量的水冲洗,再涂上
硼酸
溶液
H3BO3
www.themegallery.com
Company
Logo
有强的吸水性
①常作干燥剂
不能干燥酸性气体如:
HCl、CO2、SO2
等,因为会反应
②易潮解,易变质,保存氢氧化钠要密封保存。
③称量氢氧化钠时,不能放在纸上称量,应放在玻璃器皿中(如放在表面皿、烧杯等)
氢氧化钠
www.themegallery.com
Company
Logo
拓展知识1
酸性气体:能与碱作用生成盐的气体
碱性气体:能与酸作用生成盐的气体
二氧化碳CO2、氯气Cl2、硫化氢H2S、
二氧化氮NO2
、氯化氢HCl、二氧化硫SO2
等
氨气NH3、联氨N2H4、磷化氢PH3
中性气体:不是酸性也不是碱性的气体
氮气N2、氧气O2
、氢气H2
、甲烷CH4、一氧化碳CO、惰性气体
等
www.themegallery.com
Company
Logo
拓展知识2
干燥剂
酸性:
中性:
碱性:
浓硫酸、五氧化二磷
无水氯化钙CaCl2
无水硫酸铜CuSO4(白色)
氢氧化钠
NaOH
氧化钙CaO
碱石灰(NaOH和CaO)
现
象
颜色、状态
在水中的溶解情况
向澄清溶液中通入CO2
白色粉末状固体
微溶于水
澄清液体变白色浑浊
怎样制取“氢氧化钙”?
CaO
+
H2O
Ca(OH)2
氢氧化钙
俗称熟石灰
或消石灰
生石灰与水反应制得到氢氧化钙
实验10-6
石灰乳、石灰浆含有较多未溶解氢氧化钙
www.themegallery.com
CO
2
+
Ca(OH)2
=
CaCO3
↓+
H2O
思考:用所学的知识解答下列的问题?
1.园林工人用含有硫磺粉石灰浆将树干底部
刷白的好处是?
2.用石灰沙浆砌砖抹墙很牢固的原因?
3.装石灰水的试剂瓶用的时间长了,瓶壁
上有一层白色的膜。白色膜是什么?
4.检验二氧化碳,可用澄清石灰水。发生的
反应是?
好处有:
1、对新植树木起到防冻作用。
2、杀死病虫害越冬虫卵。
3、整洁美观。
4、减少了早春树体对太阳热能的吸收,
降低树温提升速度,使树体萌动推迟
2-3天左右,避免树体早春回寒的危害。
www.themegallery.com
常见的碱(第二课时)
碱的化学性质(碱的通性)
1、碱溶液能与酸碱
指示剂反应
加入紫色
石蕊溶液
加入无色
酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
变蓝
注意:可溶性的碱才具有这样的性质
变蓝
变红
变红
碱的化学性质
(碱的通性)
www.themegallery.com
Company
Logo
加入50mL水振荡
CO2
CO2
CO2
加入50mL饱和的氢氧化钙溶液振荡
加入50mL饱和的氢氧化钠溶液振荡
思考:除去二氧化碳用氢氧化钙溶液,还是用氢氧化钠溶液的效果好?
如何证明CO2和NaOH发生反应?
提示:可设计能显示压强变化的装置来证明
www.themegallery.com
Company
Logo
二氧化碳
+氢氧化钙的反应方程式
二氧化碳+氢氧化钠的反应方程式
CO2
+
Ca(OH)2
=
CaCO3↓
+
H2O
CO2
+
2NaOH
=
Na2CO3
+
H2O
2、非金属氧化物
+
碱
=
盐
+
水
(部分)
(可溶)
非金属氧化物
碱
盐
水
非金属氧化物
碱
盐
水
www.themegallery.com
Company
Logo
二氧化硫
+
氢氧化钠
的反应方程式
少量的二氧化硫+氢氧化钙
的反应方程式
三氧化硫+
氢氧化钠
的反应方程式
SO2
+
2NaOH
=
Na2SO3+H2O
SO2
+
Ca(OH)2
=
CaSO3↓+H2O
SO3
+
2NaOH
=
Na2SO4+H2O
练一练:
①在硫酸铜溶液中滴加氢氧化钠溶液
2
Cu(OH)2↓+
Na2SO4
3
Fe(OH)3↓+
3NaCl
结论:
3、碱能与某些盐反应(都可溶)
②在氯化铁溶液中滴加氢氧化钠溶液
盐
碱
新碱
新盐
盐
碱
新碱
新盐
碱
+
盐
=
新碱
+
新盐
(溶液)
(溶液)
NaOH
+
CuSO4
=
NaOH
+
FeCl3
=
向碳酸钠溶液中滴加氢氧化钙溶液,写出反应的化学方程式
练一练:
Ca(OH)2
+
Na2CO3
=
CaCO3↓+
2NaOH
上面的这个反应属于碱的通性吗?
答:不属于,因为碱的通性是指OH-参加反应变成水、气体或沉淀,但上面的反应,OH-一直以离子形式存在,没有变成水、气体或沉淀,它只是打酱油的。
碱
+
酸
=
盐
+
水
结论:
Ca(OH)
2
+
H2SO4
=
NaOH
+
HCl
=
请写出氢氧化钠和盐酸反应
请写出氢氧化钙和硫酸反应
4、碱与酸反应生成盐和水
NaCl
+
H2O
CaSO4
+
2H2O
www.themegallery.com
Company
Logo
小结:碱的化学性质(碱的通性)
1、碱与酸碱指示剂反应
(可溶性碱)
2、碱与某些非金属氧化物反应(可溶性碱)
可溶性碱+
某些非金属氧化物
=
盐
+
水
3、碱与某些盐溶液反应(都可溶)
可溶性碱
+
某些盐溶液
=
新盐
+
新碱
4、碱与酸反应
碱
+
酸
=
盐
+
水
物质
盐酸
硫酸
NaOH溶液
Ca(OH)2溶液
蒸馏水
乙醇
导电性
实验10-7试验物质的导电性
酸溶液、碱溶液为什么能导电?而蒸馏水、乙醇为什么不导电?
导电
导电
导电
导电
电
不导
电
不导
HCl
=
H+
+
Cl-
H2SO4
=
2H+
+
SO42-
NaOH
=
Na+
+
OH-
Ca(OH)2
=
Ca2+
+
2OH-
酸为什么具有相似的化学性质?
碱为什么具有相似的化学性质?
同样,碳酸钠、硫酸镁和氯化铵的溶液也能够导电,说明在水溶液中也能解离出能够自由离子。
Na2CO3
MgSO4
NH4+
+
Cl-
在水溶液中解离出金属离子(NH4+)和酸根离子的化合物叫做“盐”
2Na+
+
CO32-
Mg2+
+
SO42-
NH4Cl
课外知识
答:不一样。
溶液导电是因为有自由离子才导电;
金属导电是因为金属里含有大量的自由电子,电子的定向运动形成电流。
溶液导电和金属导电的原因一样吗?
拓展知识3
难溶性的碱受热时易分解为金属氧化物和水。
难溶性碱
金属氧化物+
H2O
△
Mg(OH)2
====
MgO
+
H2O
2Fe(OH)3
====
Fe2O3
+
3H2O
Cu(OH)
2
====
CuO
+
H2O
△
△
△
二、盐:
由金属离子(包括NH4+)和酸根离子构成的化合物。
盐
阳离子:金属离子、NH4+
阴离子:酸根离子
课题小结
一、碱的化学性质:
1.汞
2.
氖气
3.硫酸
4.干冰
5.氧化铁
6.铜
7.熟石灰
8.生石灰
9.烧碱
10.氯酸钾
11.氯化铁
12.硫酸钠
写出下列物质
的化学式并指出物质的类别
练习
Hg
Ne
H2SO4
CO2
Fe2O3
Cu
Ca(OH)2
CaO
NaOH
KClO3
FeCl3
Na2SO4
2、现有两瓶无色的石灰水和氢氧化钠
溶液,请用学过的方法鉴别?
方法一:
分别取1-2mL未知液于试管中,向试管中通入CO2
,出现白色沉淀的溶液为石灰水,无现象的是氢氧化钠溶液。
方法二:分别取1-2mL未知液于试管中,向试管中滴入几滴碳酸钠溶液,出现白色沉淀的为石灰水,无现象的是氢氧化钠溶液。
请预习下一节课的内容
同课章节目录
