人教版高中化学必修1第四章第三节《实验室制备NO的条件探究》说课稿
文档属性
| 名称 | 人教版高中化学必修1第四章第三节《实验室制备NO的条件探究》说课稿 |  | |
| 格式 | zip | ||
| 文件大小 | 808.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-16 20:20:20 | ||
图片预览

文档简介
实验室制备NO的条件探究
选自人教版高中化学必修1第四章第三节
一.实验教学目标
1.掌握控制单一变量、半值法在化学学习中的应用
2.了解现代化学仪器--双排管、温度传感器、压强传感器等的使用
3.在NO制备的最佳制备条件探究的过程中,树立了严谨实事求是的科学态度。
二.实验方法设计
根据实验教学目标,我采取传统实验创新和现代数字化实验融合的教学方法,引导学生动手实验、观察思考、交流讨论,通过师生共同的探究活动,促进学生思维的发展。
三.实验教学过程
环节1问题情境
引出课题:知道了NO的反应原理,在这样的一个装置中
用4.0mol/l稀硝酸和铜丝反应,为什么在试管内会出现红色气体呢?
说明:实验所用铜丝直径为0.34mm,长度为50cm,下同。
同学们思考回答有可能是试管内有空气,生成的NO和空气中的O2反应生成NO2。
那如何实现一个无氧环境呢?有的同学想到用二氧化碳排除试管内的空气。
那有没有一个更快速更高效的创造无氧环境的方法呢?其他同学有没有更好的想法?
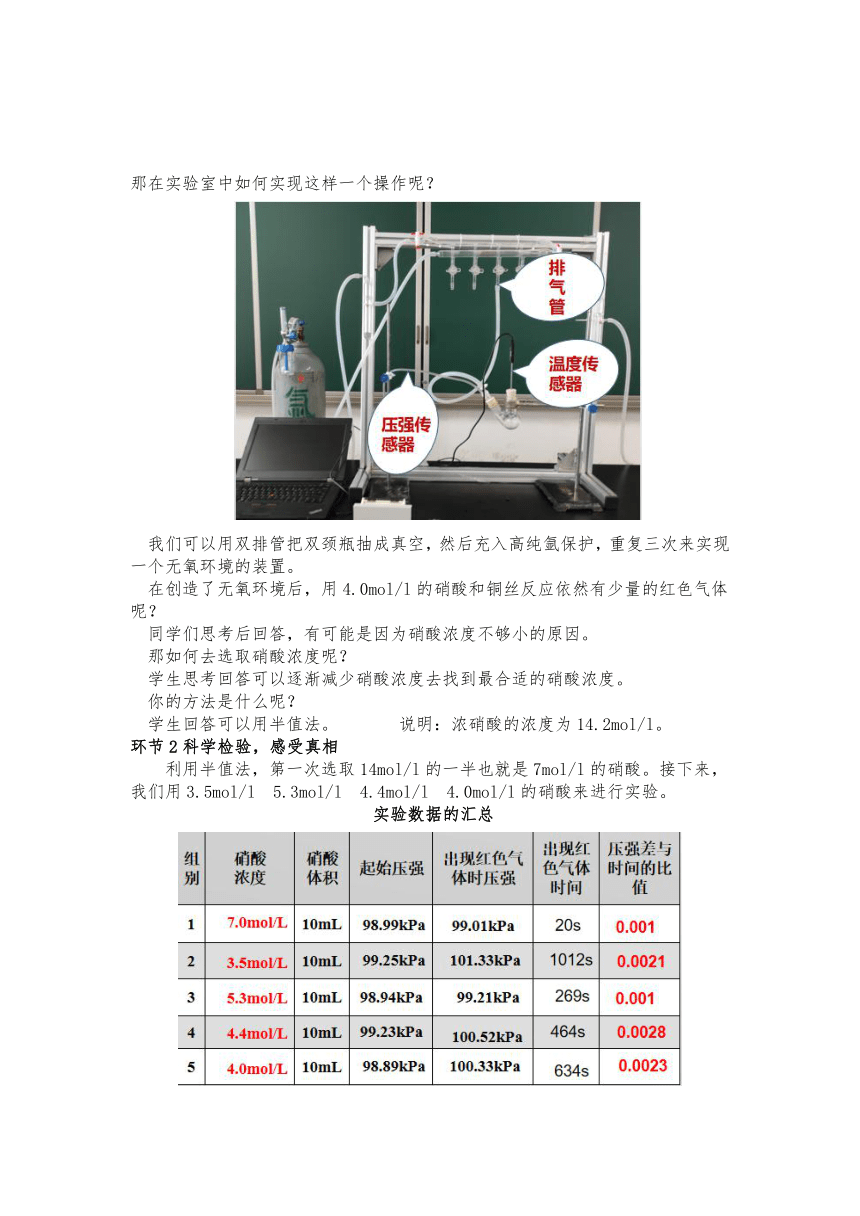
那在实验室中如何实现这样一个操作呢?
我们可以用双排管把双颈瓶抽成真空,然后充入高纯氩保护,重复三次来实现一个无氧环境的装置。
在创造了无氧环境后,用4.0mol/l的硝酸和铜丝反应依然有少量的红色气体呢?
同学们思考后回答,有可能是因为硝酸浓度不够小的原因。
那如何去选取硝酸浓度呢?
学生思考回答可以逐渐减少硝酸浓度去找到最合适的硝酸浓度。
你的方法是什么呢?
学生回答可以用半值法。
说明:浓硝酸的浓度为14.2mol/l。
环节2科学检验,感受真相
利用半值法,第一次选取14mol/l的一半也就是7mol/l的硝酸。接下来,我们用3.5mol/l
5.3mol/l
4.4mol/l
4.0mol/l的硝酸来进行实验。
实验数据的汇总
通过实验数据的分析,我们很容易发现4.4mol/l的硝酸更适合去制备NO,因为该硝酸浓度时制备NO的效率最高。同时得到结论,浓度越大,出现红棕色气体越快。
环节3提出观点,自主探究
2、3、4、5组低浓度硝酸与铜丝的反应中,随着反应的发生,硝酸浓度减小,理论上产生的气体应该是无色的NO,为什么一段时间后依然会产生NO2呢?其实本实验中我们还收集了溶液温度的变化,数据如下,请同学们从硝酸的性质和溶液温度变化方面思考原因。
学生思考回答,有可能是导致硝酸分解产生的NO2
接下来选取高浓度高温度也就是5.3mol/l
35℃的硝酸进行实验通过观察我们发现,该情况下15分钟后依然不出现红色。说明不是温度升高导致硝酸分解产生的NO2,既然不是温度升高导致硝酸分解产生的NO2,那还可能是什么原因呢?
学生思考回答,有可能是反应条件不同,导致反应产物种类不同。
接下来选取一个低浓度、高温度的硝酸和铜丝反应,也就是3.5mol/l,35℃的硝酸进行实验。发现150s就出现了红色气体,但前面的实验中3.5mol/l的硝酸和铜丝反应1012s才出现红色气体,温度为24.7℃。
得到结论:说明浓度相同时,温度确实对反应产物的种类有影响,且温度越高,出现红棕色气体越快。
通过以上探究,接下来我用4.4mol/l
20℃的硝酸和铜丝反应,
发现1200s产生气体依然是无色的。之前的实验中4.4mol/l的硝酸和铜丝反应,464s就出现红色,温度为21℃。
环节4优化实验
学以致用
得到结论:
1、在选取铜丝的粗细和长度确定的情况下,反应物的浓度和反应的温度是影响该反应产物种类的重要因素。
2、建议实验室制备NO所用硝酸浓度不超过4.4mol/l,温度控制在20℃或以下,且实验时间不宜过长。
四、反思与评价
本实验很好的创超了无氧环境,使学生深刻理解了半值法和控制单一变量在化学学习中的应用。在控制温度、浓度对产物的影响,协调反应速率、产物种类、气体总量三者关系的过程中,较好的体现了“科学探究与创新意识”、“科学精神与社会责任”等化学核心素养。
选自人教版高中化学必修1第四章第三节
一.实验教学目标
1.掌握控制单一变量、半值法在化学学习中的应用
2.了解现代化学仪器--双排管、温度传感器、压强传感器等的使用
3.在NO制备的最佳制备条件探究的过程中,树立了严谨实事求是的科学态度。
二.实验方法设计
根据实验教学目标,我采取传统实验创新和现代数字化实验融合的教学方法,引导学生动手实验、观察思考、交流讨论,通过师生共同的探究活动,促进学生思维的发展。
三.实验教学过程
环节1问题情境
引出课题:知道了NO的反应原理,在这样的一个装置中
用4.0mol/l稀硝酸和铜丝反应,为什么在试管内会出现红色气体呢?
说明:实验所用铜丝直径为0.34mm,长度为50cm,下同。
同学们思考回答有可能是试管内有空气,生成的NO和空气中的O2反应生成NO2。
那如何实现一个无氧环境呢?有的同学想到用二氧化碳排除试管内的空气。
那有没有一个更快速更高效的创造无氧环境的方法呢?其他同学有没有更好的想法?
那在实验室中如何实现这样一个操作呢?
我们可以用双排管把双颈瓶抽成真空,然后充入高纯氩保护,重复三次来实现一个无氧环境的装置。
在创造了无氧环境后,用4.0mol/l的硝酸和铜丝反应依然有少量的红色气体呢?
同学们思考后回答,有可能是因为硝酸浓度不够小的原因。
那如何去选取硝酸浓度呢?
学生思考回答可以逐渐减少硝酸浓度去找到最合适的硝酸浓度。
你的方法是什么呢?
学生回答可以用半值法。
说明:浓硝酸的浓度为14.2mol/l。
环节2科学检验,感受真相
利用半值法,第一次选取14mol/l的一半也就是7mol/l的硝酸。接下来,我们用3.5mol/l
5.3mol/l
4.4mol/l
4.0mol/l的硝酸来进行实验。
实验数据的汇总
通过实验数据的分析,我们很容易发现4.4mol/l的硝酸更适合去制备NO,因为该硝酸浓度时制备NO的效率最高。同时得到结论,浓度越大,出现红棕色气体越快。
环节3提出观点,自主探究
2、3、4、5组低浓度硝酸与铜丝的反应中,随着反应的发生,硝酸浓度减小,理论上产生的气体应该是无色的NO,为什么一段时间后依然会产生NO2呢?其实本实验中我们还收集了溶液温度的变化,数据如下,请同学们从硝酸的性质和溶液温度变化方面思考原因。
学生思考回答,有可能是导致硝酸分解产生的NO2
接下来选取高浓度高温度也就是5.3mol/l
35℃的硝酸进行实验通过观察我们发现,该情况下15分钟后依然不出现红色。说明不是温度升高导致硝酸分解产生的NO2,既然不是温度升高导致硝酸分解产生的NO2,那还可能是什么原因呢?
学生思考回答,有可能是反应条件不同,导致反应产物种类不同。
接下来选取一个低浓度、高温度的硝酸和铜丝反应,也就是3.5mol/l,35℃的硝酸进行实验。发现150s就出现了红色气体,但前面的实验中3.5mol/l的硝酸和铜丝反应1012s才出现红色气体,温度为24.7℃。
得到结论:说明浓度相同时,温度确实对反应产物的种类有影响,且温度越高,出现红棕色气体越快。
通过以上探究,接下来我用4.4mol/l
20℃的硝酸和铜丝反应,
发现1200s产生气体依然是无色的。之前的实验中4.4mol/l的硝酸和铜丝反应,464s就出现红色,温度为21℃。
环节4优化实验
学以致用
得到结论:
1、在选取铜丝的粗细和长度确定的情况下,反应物的浓度和反应的温度是影响该反应产物种类的重要因素。
2、建议实验室制备NO所用硝酸浓度不超过4.4mol/l,温度控制在20℃或以下,且实验时间不宜过长。
四、反思与评价
本实验很好的创超了无氧环境,使学生深刻理解了半值法和控制单一变量在化学学习中的应用。在控制温度、浓度对产物的影响,协调反应速率、产物种类、气体总量三者关系的过程中,较好的体现了“科学探究与创新意识”、“科学精神与社会责任”等化学核心素养。
