2021年鲁教版九年级第9单元《金属》9.2金属的化学性质基础训练
文档属性
| 名称 | 2021年鲁教版九年级第9单元《金属》9.2金属的化学性质基础训练 |
|
|
| 格式 | doc | ||
| 文件大小 | 223.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-15 21:48:06 | ||
图片预览


文档简介
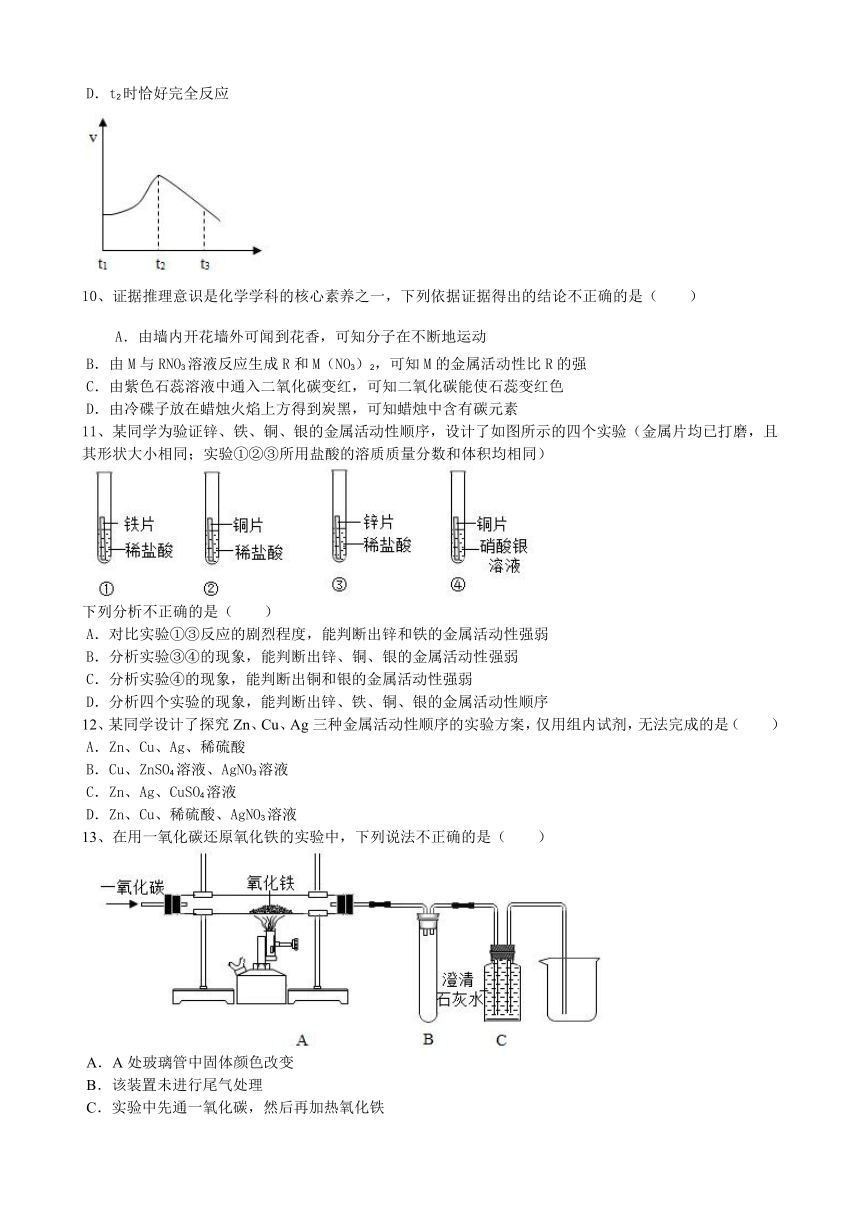
鲁教版第9单元9.2金属的化学性质基础训练
附相对原子质量:H-1;C-12;N-14;O-16;Fe-56;Zn-65;Cu-64
一、选择题:
1、从《中国成语大会》到《中国诗词大会》,中国诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理,下列叙述正确的是( )
A.“百炼成钢”与“沙里淘金”所涉及的变化相同
B.“一畦春韭绿,十里稻花香”是因为分子在不断地运动
C.“真金不怕火炼”的意思是说黄金的熔点高
D.“釜底抽薪”体现的灭火原理是隔绝氧气(或空气)
2、从化学的角度对下列成语进行解释,其中错误的是( )
A.釜底抽薪--燃烧的条件之一是需要可燃物
B.铜墙铁壁--铜、铁硬度较大,比较坚固
C.点石成金--化学反应改变了元素种类
D.烈火真金--金在高温下难与其他物质反应
3、如图所示,甲、乙、丙、丁四种常见金属在容器中与盐酸的反应情况,卡通人周围的小黑点表示反应中生成的气泡,反应结束后,金属乙有剩余。下列说法错误的是( )
A.四种金属的活动性顺序是甲>乙>丙>丁
B.完全反应后,杯中水里溶解有3种物质
C.烧杯中丙的质量没有发生改变
D.实验室不用丁与稀盐酸反应制取氢气
4、已知X、Y、Z三种金属能发生下列反应:X+H2SO4═XSO4+H2↑;Y+Z(NO3)2═Y(NO3)2+Z;Z+X(NO3)2═Z(NO3)2+X。则X、Y、Z三种金属的活动性由强到弱的顺序为( )
A.X>Y>Z B.Y>Z>X C.Z>Y>X D.X>Z>Y
5、晋葛洪《抱朴子内篇?黄白》记载“曾青涂铁,铁赤色如铜”(曾青指硫酸铜)。下列叙述错误的是( )
A.“曾青涂铁,铁赤色如铜”是物理变化
B.曾青属于化合物
C.由记载得出铜单质是赤色(红色)的
D.该记载所涉及的化学反应方程式为Fe+CuSO4═Cu+FeSO4
6、将只由铜、碳、镁、铝形成的合金放入过量的稀盐酸中,充分反应后过滤,以下说法正确的是( )
A.滤纸上只有铜和碳
B.滤纸上只有碳
C.滤液中只有氯化镁、氯化铝和氯化铜
D.滤液中只有氯化镁、氯化铝
7、按图进行实验,下列分析或结论正确的是( )
A.图1反应的化学方程式为:Al+CuSO4═AlSO4+Cu
B.图2实验的现象是:铜丝表面出现银白色的金属银
C.由图1、图2实验可知,金属的活动性顺序为:Al>Cu>Ag
D.由图1、图2实验无法判断Al、Cu、Ag的金属活动性强弱
8、将表面覆盖氧化铝的铝片和过量稀盐酸放入密闭容器中,用传感器测量反应过程中压强和温度的变化,所得数据图如图(已知:Al2O3+6HCl=2AlCl3+3H2O)。下列分析正确的是( )
A.50s后,才开始发生化学反应
B.80s时,溶液中溶质为AlCl3和HCl
C.100s时,稀盐酸已经反应完全
D.120s后,压强减小是因为无气体生成
9、已知升温、提高浓度、加大压强和使用催化剂均可以提高化学反应的速率。王瑞同学做化学实验时非常善于观察,他发现把除去氧化膜的镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况和反应进行的时间的关系如图所示,则下列关于速率变化的主要原因说法正确的是( )
A.t1~t2速率变化的主要原因是压强增大
B.t1~t2速率变化的主要原因是反应物的量较多
C.t2~t3速率变化的主要原因是盐酸的浓度逐渐减小
D.t2时恰好完全反应
10、证据推理意识是化学学科的核心素养之一,下列依据证据得出的结论不正确的是( )
A.由墙内开花墙外可闻到花香,可知分子在不断地运动
B.由M与RNO3溶液反应生成R和M(NO3)2,可知M的金属活动性比R的强
C.由紫色石蕊溶液中通入二氧化碳变红,可知二氧化碳能使石蕊变红色
D.由冷碟子放在蜡烛火焰上方得到炭黑,可知蜡烛中含有碳元素
11、某同学为验证锌、铁、铜、银的金属活动性顺序,设计了如图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)
下列分析不正确的是( )
A.对比实验①③反应的剧烈程度,能判断出锌和铁的金属活动性强弱
B.分析实验③④的现象,能判断出锌、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出锌、铁、铜、银的金属活动性顺序
12、某同学设计了探究Zn、Cu、Ag三种金属活动性顺序的实验方案,仅用组内试剂,无法完成的是( )
A.Zn、Cu、Ag、稀硫酸
B.Cu、ZnSO4溶液、AgNO3溶液
C.Zn、Ag、CuSO4溶液
D.Zn、Cu、稀硫酸、AgNO3溶液
13、在用一氧化碳还原氧化铁的实验中,下列说法不正确的是( )
A.A处玻璃管中固体颜色改变
B.该装置未进行尾气处理
C.实验中先通一氧化碳,然后再加热氧化铁
D.B处试管可以防止因液体倒吸,使玻璃管炸裂
二、填空题:
1、生活离不开化学。如图是一款燃气灶的示意图。
(1)烹饪时,用铸铁炉架将锅架高,其主要原因是 (填序号)。
A.避免锅被烤坏
B.避免食物被烤焦
C.使用外焰加热
(2)燃气灶常用天然气、液化石油气等燃气,天然气主要成分燃烧的化学方程式为 。
(3)燃气灶关火的方法是关闭燃气阀门,其灭火的原理是 。
(4)某家长经常用食醋(主要成分CH3COOH)擦洗燃气灶台面(成分Fe、Mn、Ni等),请你用所学知识判断 (填“合理”或“不合理”)。
2、某化工厂排出的废液中含有硝酸银、硝酸锌和硝酸铜三种物质。为了分离并回收金属银和铜,某校化学课外小组的同学准备运用刚学到的“金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)在空格中分别填入相应的化学式:K2O、CaO、Na2O、 ,Al2O3……
(2)设计方案分离并回收金属银和铜。
根据实验方案回答以下问题:
①固体X是 (填化学式)。
②滤液B中除了Zn(NO3)2外还含有的物质是 (填化学式)。
③操作a的名称是 ,实验室进行该操作时要用到的玻璃仪器有:烧杯、 和 。
④写出图中步骤①、步骤②中发生的化学方程式: ; 。
3、金属及金属材料具有广泛的应用。
Ⅰ.纽扣电池是生活中常用的电源。
(1)纽扣电池的金属外壳可以加工得很薄,说明金属具有 性。
(2)某纽扣电池中涉及到铜和银等金属,从所给试剂中选取合适药品设计实验方案比较铜和银的金属活动性强弱。试剂:铜丝、银丝、稀盐酸、硝酸银溶液、硫酸铝溶液。
实验方案 实验现象 结论
铜的金属活动性比银强,有关反应的化学方程式为
Ⅱ.运用手持技术探究金属与酸的反应。向250mL的烧瓶内注入25mL某浓度的稀盐酸(足量),分别剪取相同长度和宽度的镁、铝、锌、铁、铜金属片,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的变化曲线。
(1)曲线b对应的金属是铁,反应的化学方程式为 。
(2)曲线c在18s左右达到最高点后又略微下降的原因是 。
(3)下列说法不正确的是 (填字母)。
A.曲线a对应的金属是铜
B.曲线d对应的反应速率适中,适合实验室制取气体
C.曲线e在0~100s段几乎没有上升,可能是该金属打磨不彻底
D.曲线e在300s后迅速上升,是因为盐酸浓度变大
E.如延长横坐标时间,曲线c、d、e最终将交于一点
Ⅲ.氢气的储存是科学研究热点之一。某镁铜合金X是一种储存氢气的材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。制取X时不能在空气中熔炼的原因是 (任写一个有关反应的化学方程式)。
4、向盛有一定质量AgNO3和Cu(NO3)2的混合溶液中的烧杯中逐渐加入过量Zn粉,边加边搅拌,溶液质量与加入Zn的质量关系如图所示。
(1)写出b~c(不包括b点)段反应的化学方程式 ;
(2)写出d点所对应溶质的化学式 ;
(3)指出a~b段溶液质量变小的原因 。
参考答案
一、选择题:
1、B 2、C 3、C 4、B 5、A 6、A 7、C 8、B 9、C 10、C
11、B 12、A 13、B
二、填空题:
1、答案:(1)C;
(2)CH4+2O2CO2+2H2O;
(3)清除可燃物;
(4)不合理。
2、答案:(1)MgO。
(2)①Ag。
②Fe(NO3)2。
③过滤;漏斗;玻璃棒。
④Cu+2AgNO3=Cu(NO3)2+2Ag;Fe+Cu(NO3)2=Fe(NO3)2+Cu。
3、解:Ⅰ.(1)金属的延展性是金属能压成薄片和拉成细丝,纽扣电池的金属外壳可以加工得很薄,说明金属具有延展性,故填:延展;
(2)实验目的是比较铜和银的金属活动性强弱,提供的试剂:铜丝、银丝、稀盐酸、硝酸银溶液、硫酸铝溶液,则实验方案为取一定量的硝酸银溶液与试管中,插入一根洁净的铜丝;实验现象为铜丝表面有银白色物质析出,溶液由无色变为蓝色;实验结论为铜的金属活动性比银强,有关反应的化学方程式为Cu+2Ag(NO3)2=Cu(NO3)2+2Ag;故填:取一定量的硝酸银溶液与试管中,插入一根洁净的铜丝,观察现象;铜丝表面有银白色物质析出,溶液由无色变为蓝色;Cu+2Ag(NO3)2=Cu(NO3)2+2Ag;
Ⅱ.(1)曲线b对应的金属是铁,铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe+2HCl=FeCl2+H2↑,故填:Fe+2HCl=FeCl2+H2↑;
(2)镁、铝、锌、铁、铜金属活性顺序为镁>铝>锌>铁>铜,分析曲线图可知,曲线c为镁,镁与盐酸反应现象是迅速产生大量气泡,并放热,曲线c在18s左右达到最高点后又略微下降的原因是镁与稀盐酸反应放热,18s左右反应结束,温度恢复为室温,压强略下降,故填:镁与稀盐酸反应放热,18s左右反应结束,温度恢复为室温,压强略下降;
(3)A.金属铜在金属活动顺序表中,排在氢的后面,不与盐酸反应,则曲线a对应的金属是铜,故A正确;
B.分析曲线图可知,曲线d为锌,反应速率适中,适合实验室制取氢气,故B正确;
C.分析曲线图可知,曲线e为铝,铝在常温下,表面易生成氧化铝,氧化铝与盐酸反应没有气体生成,则在0~100s段几乎没有上升,可能是铝表面的氧化铝打磨不彻底,故C正确;
D.曲线e为铝,随着反应的进行,盐酸浓度只会减小,曲线e在300s后迅速上升的原因是铝表面氧化膜反应完,盐酸与铝反应生成了氢气,压强增大,故D错误;
E.分析曲线图可知,c为镁,d为锌,e为铝,分别剪取相同长度和宽度的镁、铝、锌金属片,不知道镁、锌、铝的质量,无法判断生成氢气的质量,则如延长横坐标时间,曲线c、d、e最终不一定能交一点,故E错误;
故填:DE;
Ⅲ.合金X为镁铜合金,制取X时不能在空气中熔炼的原因是2Mg+O22MgO(或2Cu+O22CuO),故填:2Mg+O22MgO(或2Cu+O22CuO);
4、答案:(1)Zn+Cu(NO3)2?═Zn(NO3)2?+Cu。
(2)Zn(NO3)2。
(3)消耗的AgNO3的质量大于生成Zn(NO3)2的质量。
附相对原子质量:H-1;C-12;N-14;O-16;Fe-56;Zn-65;Cu-64
一、选择题:
1、从《中国成语大会》到《中国诗词大会》,中国诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理,下列叙述正确的是( )
A.“百炼成钢”与“沙里淘金”所涉及的变化相同
B.“一畦春韭绿,十里稻花香”是因为分子在不断地运动
C.“真金不怕火炼”的意思是说黄金的熔点高
D.“釜底抽薪”体现的灭火原理是隔绝氧气(或空气)
2、从化学的角度对下列成语进行解释,其中错误的是( )
A.釜底抽薪--燃烧的条件之一是需要可燃物
B.铜墙铁壁--铜、铁硬度较大,比较坚固
C.点石成金--化学反应改变了元素种类
D.烈火真金--金在高温下难与其他物质反应
3、如图所示,甲、乙、丙、丁四种常见金属在容器中与盐酸的反应情况,卡通人周围的小黑点表示反应中生成的气泡,反应结束后,金属乙有剩余。下列说法错误的是( )
A.四种金属的活动性顺序是甲>乙>丙>丁
B.完全反应后,杯中水里溶解有3种物质
C.烧杯中丙的质量没有发生改变
D.实验室不用丁与稀盐酸反应制取氢气
4、已知X、Y、Z三种金属能发生下列反应:X+H2SO4═XSO4+H2↑;Y+Z(NO3)2═Y(NO3)2+Z;Z+X(NO3)2═Z(NO3)2+X。则X、Y、Z三种金属的活动性由强到弱的顺序为( )
A.X>Y>Z B.Y>Z>X C.Z>Y>X D.X>Z>Y
5、晋葛洪《抱朴子内篇?黄白》记载“曾青涂铁,铁赤色如铜”(曾青指硫酸铜)。下列叙述错误的是( )
A.“曾青涂铁,铁赤色如铜”是物理变化
B.曾青属于化合物
C.由记载得出铜单质是赤色(红色)的
D.该记载所涉及的化学反应方程式为Fe+CuSO4═Cu+FeSO4
6、将只由铜、碳、镁、铝形成的合金放入过量的稀盐酸中,充分反应后过滤,以下说法正确的是( )
A.滤纸上只有铜和碳
B.滤纸上只有碳
C.滤液中只有氯化镁、氯化铝和氯化铜
D.滤液中只有氯化镁、氯化铝
7、按图进行实验,下列分析或结论正确的是( )
A.图1反应的化学方程式为:Al+CuSO4═AlSO4+Cu
B.图2实验的现象是:铜丝表面出现银白色的金属银
C.由图1、图2实验可知,金属的活动性顺序为:Al>Cu>Ag
D.由图1、图2实验无法判断Al、Cu、Ag的金属活动性强弱
8、将表面覆盖氧化铝的铝片和过量稀盐酸放入密闭容器中,用传感器测量反应过程中压强和温度的变化,所得数据图如图(已知:Al2O3+6HCl=2AlCl3+3H2O)。下列分析正确的是( )
A.50s后,才开始发生化学反应
B.80s时,溶液中溶质为AlCl3和HCl
C.100s时,稀盐酸已经反应完全
D.120s后,压强减小是因为无气体生成
9、已知升温、提高浓度、加大压强和使用催化剂均可以提高化学反应的速率。王瑞同学做化学实验时非常善于观察,他发现把除去氧化膜的镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况和反应进行的时间的关系如图所示,则下列关于速率变化的主要原因说法正确的是( )
A.t1~t2速率变化的主要原因是压强增大
B.t1~t2速率变化的主要原因是反应物的量较多
C.t2~t3速率变化的主要原因是盐酸的浓度逐渐减小
D.t2时恰好完全反应
10、证据推理意识是化学学科的核心素养之一,下列依据证据得出的结论不正确的是( )
A.由墙内开花墙外可闻到花香,可知分子在不断地运动
B.由M与RNO3溶液反应生成R和M(NO3)2,可知M的金属活动性比R的强
C.由紫色石蕊溶液中通入二氧化碳变红,可知二氧化碳能使石蕊变红色
D.由冷碟子放在蜡烛火焰上方得到炭黑,可知蜡烛中含有碳元素
11、某同学为验证锌、铁、铜、银的金属活动性顺序,设计了如图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)
下列分析不正确的是( )
A.对比实验①③反应的剧烈程度,能判断出锌和铁的金属活动性强弱
B.分析实验③④的现象,能判断出锌、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出锌、铁、铜、银的金属活动性顺序
12、某同学设计了探究Zn、Cu、Ag三种金属活动性顺序的实验方案,仅用组内试剂,无法完成的是( )
A.Zn、Cu、Ag、稀硫酸
B.Cu、ZnSO4溶液、AgNO3溶液
C.Zn、Ag、CuSO4溶液
D.Zn、Cu、稀硫酸、AgNO3溶液
13、在用一氧化碳还原氧化铁的实验中,下列说法不正确的是( )
A.A处玻璃管中固体颜色改变
B.该装置未进行尾气处理
C.实验中先通一氧化碳,然后再加热氧化铁
D.B处试管可以防止因液体倒吸,使玻璃管炸裂
二、填空题:
1、生活离不开化学。如图是一款燃气灶的示意图。
(1)烹饪时,用铸铁炉架将锅架高,其主要原因是 (填序号)。
A.避免锅被烤坏
B.避免食物被烤焦
C.使用外焰加热
(2)燃气灶常用天然气、液化石油气等燃气,天然气主要成分燃烧的化学方程式为 。
(3)燃气灶关火的方法是关闭燃气阀门,其灭火的原理是 。
(4)某家长经常用食醋(主要成分CH3COOH)擦洗燃气灶台面(成分Fe、Mn、Ni等),请你用所学知识判断 (填“合理”或“不合理”)。
2、某化工厂排出的废液中含有硝酸银、硝酸锌和硝酸铜三种物质。为了分离并回收金属银和铜,某校化学课外小组的同学准备运用刚学到的“金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)在空格中分别填入相应的化学式:K2O、CaO、Na2O、 ,Al2O3……
(2)设计方案分离并回收金属银和铜。
根据实验方案回答以下问题:
①固体X是 (填化学式)。
②滤液B中除了Zn(NO3)2外还含有的物质是 (填化学式)。
③操作a的名称是 ,实验室进行该操作时要用到的玻璃仪器有:烧杯、 和 。
④写出图中步骤①、步骤②中发生的化学方程式: ; 。
3、金属及金属材料具有广泛的应用。
Ⅰ.纽扣电池是生活中常用的电源。
(1)纽扣电池的金属外壳可以加工得很薄,说明金属具有 性。
(2)某纽扣电池中涉及到铜和银等金属,从所给试剂中选取合适药品设计实验方案比较铜和银的金属活动性强弱。试剂:铜丝、银丝、稀盐酸、硝酸银溶液、硫酸铝溶液。
实验方案 实验现象 结论
铜的金属活动性比银强,有关反应的化学方程式为
Ⅱ.运用手持技术探究金属与酸的反应。向250mL的烧瓶内注入25mL某浓度的稀盐酸(足量),分别剪取相同长度和宽度的镁、铝、锌、铁、铜金属片,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的变化曲线。
(1)曲线b对应的金属是铁,反应的化学方程式为 。
(2)曲线c在18s左右达到最高点后又略微下降的原因是 。
(3)下列说法不正确的是 (填字母)。
A.曲线a对应的金属是铜
B.曲线d对应的反应速率适中,适合实验室制取气体
C.曲线e在0~100s段几乎没有上升,可能是该金属打磨不彻底
D.曲线e在300s后迅速上升,是因为盐酸浓度变大
E.如延长横坐标时间,曲线c、d、e最终将交于一点
Ⅲ.氢气的储存是科学研究热点之一。某镁铜合金X是一种储存氢气的材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。制取X时不能在空气中熔炼的原因是 (任写一个有关反应的化学方程式)。
4、向盛有一定质量AgNO3和Cu(NO3)2的混合溶液中的烧杯中逐渐加入过量Zn粉,边加边搅拌,溶液质量与加入Zn的质量关系如图所示。
(1)写出b~c(不包括b点)段反应的化学方程式 ;
(2)写出d点所对应溶质的化学式 ;
(3)指出a~b段溶液质量变小的原因 。
参考答案
一、选择题:
1、B 2、C 3、C 4、B 5、A 6、A 7、C 8、B 9、C 10、C
11、B 12、A 13、B
二、填空题:
1、答案:(1)C;
(2)CH4+2O2CO2+2H2O;
(3)清除可燃物;
(4)不合理。
2、答案:(1)MgO。
(2)①Ag。
②Fe(NO3)2。
③过滤;漏斗;玻璃棒。
④Cu+2AgNO3=Cu(NO3)2+2Ag;Fe+Cu(NO3)2=Fe(NO3)2+Cu。
3、解:Ⅰ.(1)金属的延展性是金属能压成薄片和拉成细丝,纽扣电池的金属外壳可以加工得很薄,说明金属具有延展性,故填:延展;
(2)实验目的是比较铜和银的金属活动性强弱,提供的试剂:铜丝、银丝、稀盐酸、硝酸银溶液、硫酸铝溶液,则实验方案为取一定量的硝酸银溶液与试管中,插入一根洁净的铜丝;实验现象为铜丝表面有银白色物质析出,溶液由无色变为蓝色;实验结论为铜的金属活动性比银强,有关反应的化学方程式为Cu+2Ag(NO3)2=Cu(NO3)2+2Ag;故填:取一定量的硝酸银溶液与试管中,插入一根洁净的铜丝,观察现象;铜丝表面有银白色物质析出,溶液由无色变为蓝色;Cu+2Ag(NO3)2=Cu(NO3)2+2Ag;
Ⅱ.(1)曲线b对应的金属是铁,铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe+2HCl=FeCl2+H2↑,故填:Fe+2HCl=FeCl2+H2↑;
(2)镁、铝、锌、铁、铜金属活性顺序为镁>铝>锌>铁>铜,分析曲线图可知,曲线c为镁,镁与盐酸反应现象是迅速产生大量气泡,并放热,曲线c在18s左右达到最高点后又略微下降的原因是镁与稀盐酸反应放热,18s左右反应结束,温度恢复为室温,压强略下降,故填:镁与稀盐酸反应放热,18s左右反应结束,温度恢复为室温,压强略下降;
(3)A.金属铜在金属活动顺序表中,排在氢的后面,不与盐酸反应,则曲线a对应的金属是铜,故A正确;
B.分析曲线图可知,曲线d为锌,反应速率适中,适合实验室制取氢气,故B正确;
C.分析曲线图可知,曲线e为铝,铝在常温下,表面易生成氧化铝,氧化铝与盐酸反应没有气体生成,则在0~100s段几乎没有上升,可能是铝表面的氧化铝打磨不彻底,故C正确;
D.曲线e为铝,随着反应的进行,盐酸浓度只会减小,曲线e在300s后迅速上升的原因是铝表面氧化膜反应完,盐酸与铝反应生成了氢气,压强增大,故D错误;
E.分析曲线图可知,c为镁,d为锌,e为铝,分别剪取相同长度和宽度的镁、铝、锌金属片,不知道镁、锌、铝的质量,无法判断生成氢气的质量,则如延长横坐标时间,曲线c、d、e最终不一定能交一点,故E错误;
故填:DE;
Ⅲ.合金X为镁铜合金,制取X时不能在空气中熔炼的原因是2Mg+O22MgO(或2Cu+O22CuO),故填:2Mg+O22MgO(或2Cu+O22CuO);
4、答案:(1)Zn+Cu(NO3)2?═Zn(NO3)2?+Cu。
(2)Zn(NO3)2。
(3)消耗的AgNO3的质量大于生成Zn(NO3)2的质量。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
