2020-2021学年高一化学人教版(2019)必修第二册第五章第一节 硫及其化合物课件(27张pt)
文档属性
| 名称 | 2020-2021学年高一化学人教版(2019)必修第二册第五章第一节 硫及其化合物课件(27张pt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-17 15:28:33 | ||
图片预览








文档简介
(共27张PPT)
第五章 化工生产中的重要非金属元素
第1课时 硫和硫的氧化物
第一节 硫及其化合物
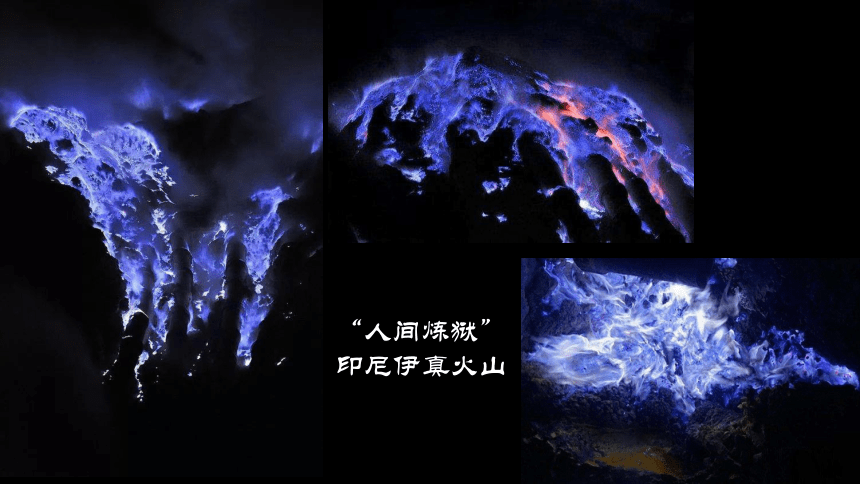
“人间炼狱”
印尼伊真火山
俗称:硫磺
为什么火山会有这样颜色的火焰?
这种颜色的火焰是由什么引起的呢?
+16
2
8
6
1、原子结构示意图:
问题一:硫元素有哪些化合价?
一、单质硫
S2-
S
SO32-
SO42-
化合价
-2
0
+4
+6
SO2
SO3
H2SO4
H2SO3
H2S
物质类别
单质
氧化物
酸
盐
还原性
既有氧化性又有还原性还原性
氧化性
(存在于火山口附近或地壳的岩层里)
+16
2
8
6
1、原子结构示意图:
问题二:硫在元素周期表中什么位置?氧和硫的得电子能力谁强?
第三周期第VIA族
---这也是在富含氧气的地表附近找到的含硫化合物中,硫常常为+4价或+6价,而氧为-2价的原因。
一、单质硫
氧化性:O>S
(存在于火山口附近或地壳的岩层里)
一、单质硫
2、物理性质
黄色晶体,质脆,易研成粉末
难溶于水,微溶于酒精,易溶于CS2。
硫磺
(存在于火山口附近或地壳的岩层里)
硫在水中的硫结晶
可用二硫化碳作为洗涤剂清洗附着在试管壁上的硫
熔点:113℃
沸点:445℃
密度:2.06g/cm3
加热熔化
-2
0
+4
+6
S
从化合价的角度分析,
硫单质的化学性质如何体现呢?
氧化性
还原性
3、硫的化学性质
①与非金属反应:
H2+S == H2S(臭鸡蛋气味)
S+O2 == SO2 (空气:淡蓝色火焰)
注意:硫与氧气在点燃的情况下生成SO2,不生成SO3
②与金属反应:
2Na+S== Na2S
2Cu+S== Cu2S (硫化亚铜,灰黑色)
Fe + S== FeS(硫化亚铁,黑色)
注意:因为硫的氧化性较弱,所以硫与金属反应通常不能反应到最高价
△
点燃
△
△
结论 :
氧化性:Cl2>S
③跟其他物质反应
S与碱反应
3S+6KOH = 2K2S+K2SO3+3H2O
S与强氧化剂反应
歧化反应
归中反应
S+2H2SO4(浓)=3SO2↑+2H2O
△
也可用于清洗附着在试管壁上的硫
1、除去试管壁上附着的硫,可采用的方法是( )
A.通入氢气后加热 B.伸入灼热的铁丝
C.用水洗涤 D.用二硫化碳洗涤后再用水洗
【课堂小练】
D
2、如何判断S和Cl2的氧化性强弱
①Fe、Cu与S反应生成低价的化合物,Fe、Cu与Cl2反应生成高价的化合物,故Cl2的氧化性大于S;
②与H2化合,S与H2化合比Cl2与H2化合难,H2S稳定性比HCl弱。元素的非金属性:Cl>S。
二氧化硫
是常见的硫的氧化物
但是二氧化硫有毒。无论是化学实验还是工业生产都不能向空气中排放SO2
二氧化硫检测仪
二、二氧化硫
1.物理性质:
颜色 状态 气味 毒性 密度 水溶性
____ ____ _______气味 ____ 比空气___ 易溶于水
无色
气态
刺激性
有毒
大
1:40
2.化学性质:
SO2+H2O H2SO3
①能与水反应
可逆反应: 1、双向性 2、同时性
3、共存性(各反应物、生成物共存)
3、下列反应是否为可逆反应?
不是可逆反应
是可逆反应
(1) CO2+H2O = H2CO3,H2CO3=H2O+CO2↑
(2) 2H2+O2 == 2H2O,2H2O == 2H2↑+O2↑
点燃
通电
【课堂小练】
2.化学性质:
CaO+SO2===CaSO3
Na2CO3+SO2===Na2SO3+CO2
SO2+2NaOH(过量)===Na2SO3+H2O
SO2+NaOH(少量)===NaHSO3
SO2+H2O H2SO3
酸性
①能与水反应
②能与碱性氧化物反应
③能与碱反应
④能与某些盐反应
(1) 氧化物的通性(硫化合价不变,均为+4价)
可逆反应: 1、双向性 2、同时性
3、共存性(各反应物、生成物共存)
(燃煤污染的治理,钙基固硫)
SO2+Ca(OH)2==CaSO3↓+H2O
使石灰水变浑浊的不一定是CO2
葡萄酒的酿造,可以看作葡萄糖被O2氧化转变为酒精和二氧化碳的过程。在葡萄酒的储存过程中,为了保证葡萄酒的甘甜,需要一些物质来防止其中的糖类被继续氧化, SO2可以起到这样的作用。
阅读材料:这里SO2体现了什么性质?
从化合价的角度分析SO2有什么性质?
既有氧化性又有还原性
-2
0
+4
+6
氧化性
还原性
(2)强还原性
①催化氧化的化学方程式:___________________。
②与酸性高锰酸钾溶液反应的现象:溶液_________。
化学方程式:_______________________________。
③与溴水反应的现象:溴水_________;
化学方程式:_______________________________。
④与氯化铁反应离子方程式
_________________________________。
褪色
褪色
Br2+SO2+2H2O===2HBr+H2SO4
2SO2+O2 2SO3
催化剂
△
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
(3)弱氧化性。
与H2S反应化学方程式为_________________________。
2H2S+SO2===3S↓+2H2O
有黄色沉淀
有黄色固体附于瓶壁
氢硫酸(H2S)
H2S气体
SO2气体
实验【5-2】
用试管取2ml在实验5-1中得到的溶液,向其中滴入1-2滴品红溶液,振荡,观察溶液的颜色变化;然后加热试管,注意通风,再观察溶液的变化。
现象: 品红褪色,加热恢复红色
(4)漂白性
原理:与某些有色物质化合生成不稳定的无色物质。
特点:生成的无色物质不稳定容易分解,而使有色物质恢复原来的颜色
注意:SO2还原KMnO4等无机物不能称为漂白性。
北京市场黄白两种银耳对比 中央电视台《生活》栏目
丑小鸭
白天鹅
不可使用于食品漂白
但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
名称
原理
范围
SO2
次氯酸、过氧化钠
活性炭
化合漂白
氧化漂白
吸附漂白
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
漂白某些有色物质,不能使酸碱指示剂褪色(石蕊变红)
可漂白大多数有色物质
效果
暂时
永久
永久
漂白剂的种类
制硫酸
制漂白剂
消毒剂
防腐剂
三、三氧化硫
1.物理性质:
色易 的 体,熔点为16.8℃,沸点为44.8℃。
无
挥发
晶
判断:标况下1molSO3的体积大约为22.4L吗
2.化学性质 酸性氧化物的通性
4.SO2可用作红酒的防腐剂。下列关于SO2的叙述错误的是( )
A. 无色无味气体 B. 能与氢氧化钠溶液反应
C. 能使品红溶液褪色 D. 一定条件下,能与氧气反应
A
5.将 SO2 气体通入 BaCl2 溶液,无明显现象,然后再通人 X 气体或加入 X 溶液,有白色沉淀生成,X 不可能是( )
A. Cl2 B.CO2 C.氨水 D.H2O2
B
【课堂小练】
实验 记录 A 无色 无色 无现象 无色溶液
B 红色 无色 白色沉淀 白色沉淀
C 红色 红色 白色沉淀 白色溶液
D 无色 无色 白色沉淀 无色溶液
6.下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
D
第五章 化工生产中的重要非金属元素
第1课时 硫和硫的氧化物
第一节 硫及其化合物
“人间炼狱”
印尼伊真火山
俗称:硫磺
为什么火山会有这样颜色的火焰?
这种颜色的火焰是由什么引起的呢?
+16
2
8
6
1、原子结构示意图:
问题一:硫元素有哪些化合价?
一、单质硫
S2-
S
SO32-
SO42-
化合价
-2
0
+4
+6
SO2
SO3
H2SO4
H2SO3
H2S
物质类别
单质
氧化物
酸
盐
还原性
既有氧化性又有还原性还原性
氧化性
(存在于火山口附近或地壳的岩层里)
+16
2
8
6
1、原子结构示意图:
问题二:硫在元素周期表中什么位置?氧和硫的得电子能力谁强?
第三周期第VIA族
---这也是在富含氧气的地表附近找到的含硫化合物中,硫常常为+4价或+6价,而氧为-2价的原因。
一、单质硫
氧化性:O>S
(存在于火山口附近或地壳的岩层里)
一、单质硫
2、物理性质
黄色晶体,质脆,易研成粉末
难溶于水,微溶于酒精,易溶于CS2。
硫磺
(存在于火山口附近或地壳的岩层里)
硫在水中的硫结晶
可用二硫化碳作为洗涤剂清洗附着在试管壁上的硫
熔点:113℃
沸点:445℃
密度:2.06g/cm3
加热熔化
-2
0
+4
+6
S
从化合价的角度分析,
硫单质的化学性质如何体现呢?
氧化性
还原性
3、硫的化学性质
①与非金属反应:
H2+S == H2S(臭鸡蛋气味)
S+O2 == SO2 (空气:淡蓝色火焰)
注意:硫与氧气在点燃的情况下生成SO2,不生成SO3
②与金属反应:
2Na+S== Na2S
2Cu+S== Cu2S (硫化亚铜,灰黑色)
Fe + S== FeS(硫化亚铁,黑色)
注意:因为硫的氧化性较弱,所以硫与金属反应通常不能反应到最高价
△
点燃
△
△
结论 :
氧化性:Cl2>S
③跟其他物质反应
S与碱反应
3S+6KOH = 2K2S+K2SO3+3H2O
S与强氧化剂反应
歧化反应
归中反应
S+2H2SO4(浓)=3SO2↑+2H2O
△
也可用于清洗附着在试管壁上的硫
1、除去试管壁上附着的硫,可采用的方法是( )
A.通入氢气后加热 B.伸入灼热的铁丝
C.用水洗涤 D.用二硫化碳洗涤后再用水洗
【课堂小练】
D
2、如何判断S和Cl2的氧化性强弱
①Fe、Cu与S反应生成低价的化合物,Fe、Cu与Cl2反应生成高价的化合物,故Cl2的氧化性大于S;
②与H2化合,S与H2化合比Cl2与H2化合难,H2S稳定性比HCl弱。元素的非金属性:Cl>S。
二氧化硫
是常见的硫的氧化物
但是二氧化硫有毒。无论是化学实验还是工业生产都不能向空气中排放SO2
二氧化硫检测仪
二、二氧化硫
1.物理性质:
颜色 状态 气味 毒性 密度 水溶性
____ ____ _______气味 ____ 比空气___ 易溶于水
无色
气态
刺激性
有毒
大
1:40
2.化学性质:
SO2+H2O H2SO3
①能与水反应
可逆反应: 1、双向性 2、同时性
3、共存性(各反应物、生成物共存)
3、下列反应是否为可逆反应?
不是可逆反应
是可逆反应
(1) CO2+H2O = H2CO3,H2CO3=H2O+CO2↑
(2) 2H2+O2 == 2H2O,2H2O == 2H2↑+O2↑
点燃
通电
【课堂小练】
2.化学性质:
CaO+SO2===CaSO3
Na2CO3+SO2===Na2SO3+CO2
SO2+2NaOH(过量)===Na2SO3+H2O
SO2+NaOH(少量)===NaHSO3
SO2+H2O H2SO3
酸性
①能与水反应
②能与碱性氧化物反应
③能与碱反应
④能与某些盐反应
(1) 氧化物的通性(硫化合价不变,均为+4价)
可逆反应: 1、双向性 2、同时性
3、共存性(各反应物、生成物共存)
(燃煤污染的治理,钙基固硫)
SO2+Ca(OH)2==CaSO3↓+H2O
使石灰水变浑浊的不一定是CO2
葡萄酒的酿造,可以看作葡萄糖被O2氧化转变为酒精和二氧化碳的过程。在葡萄酒的储存过程中,为了保证葡萄酒的甘甜,需要一些物质来防止其中的糖类被继续氧化, SO2可以起到这样的作用。
阅读材料:这里SO2体现了什么性质?
从化合价的角度分析SO2有什么性质?
既有氧化性又有还原性
-2
0
+4
+6
氧化性
还原性
(2)强还原性
①催化氧化的化学方程式:___________________。
②与酸性高锰酸钾溶液反应的现象:溶液_________。
化学方程式:_______________________________。
③与溴水反应的现象:溴水_________;
化学方程式:_______________________________。
④与氯化铁反应离子方程式
_________________________________。
褪色
褪色
Br2+SO2+2H2O===2HBr+H2SO4
2SO2+O2 2SO3
催化剂
△
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
(3)弱氧化性。
与H2S反应化学方程式为_________________________。
2H2S+SO2===3S↓+2H2O
有黄色沉淀
有黄色固体附于瓶壁
氢硫酸(H2S)
H2S气体
SO2气体
实验【5-2】
用试管取2ml在实验5-1中得到的溶液,向其中滴入1-2滴品红溶液,振荡,观察溶液的颜色变化;然后加热试管,注意通风,再观察溶液的变化。
现象: 品红褪色,加热恢复红色
(4)漂白性
原理:与某些有色物质化合生成不稳定的无色物质。
特点:生成的无色物质不稳定容易分解,而使有色物质恢复原来的颜色
注意:SO2还原KMnO4等无机物不能称为漂白性。
北京市场黄白两种银耳对比 中央电视台《生活》栏目
丑小鸭
白天鹅
不可使用于食品漂白
但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
名称
原理
范围
SO2
次氯酸、过氧化钠
活性炭
化合漂白
氧化漂白
吸附漂白
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
漂白某些有色物质,不能使酸碱指示剂褪色(石蕊变红)
可漂白大多数有色物质
效果
暂时
永久
永久
漂白剂的种类
制硫酸
制漂白剂
消毒剂
防腐剂
三、三氧化硫
1.物理性质:
色易 的 体,熔点为16.8℃,沸点为44.8℃。
无
挥发
晶
判断:标况下1molSO3的体积大约为22.4L吗
2.化学性质 酸性氧化物的通性
4.SO2可用作红酒的防腐剂。下列关于SO2的叙述错误的是( )
A. 无色无味气体 B. 能与氢氧化钠溶液反应
C. 能使品红溶液褪色 D. 一定条件下,能与氧气反应
A
5.将 SO2 气体通入 BaCl2 溶液,无明显现象,然后再通人 X 气体或加入 X 溶液,有白色沉淀生成,X 不可能是( )
A. Cl2 B.CO2 C.氨水 D.H2O2
B
【课堂小练】
实验 记录 A 无色 无色 无现象 无色溶液
B 红色 无色 白色沉淀 白色沉淀
C 红色 红色 白色沉淀 白色溶液
D 无色 无色 白色沉淀 无色溶液
6.下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
