2020-2021学年高二下学期物理人教版(2019)选择性必修第三册课件:2.3气体的等压变化和等容变化25张PPT
文档属性
| 名称 | 2020-2021学年高二下学期物理人教版(2019)选择性必修第三册课件:2.3气体的等压变化和等容变化25张PPT |  | |
| 格式 | pptx | ||
| 文件大小 | 806.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2021-03-19 00:24:50 | ||
图片预览







文档简介
3 气体的等压变化和等容变化
1.知道什么是等压变化,理解V-T图像,掌握盖-吕萨克定律。
2.知道什么是等容变化,理解p-T图像,掌握查理定律。
3.知道什么是理想气体,掌握理想气体状态方程。
4.能用气体分子动理论解释三个气体实验定律。
1.等压变化:一定质量的某种气体,在① 压强????不变时,体积随温度变化的过程叫
作气体的等压变化。
2.盖-吕萨克定律
(1)内容:一定质量的某种气体,在压强不变的情况下,其体积V与② 热力学温度T????
成③ 正????比。
(2)表达式:④????V=CT????,其中C是常量;或者?=?,其中V1、T1和V2、T2分别表示气
体在不同状态下的体积和热力学温度。
(3)推论式:一定质量的气体从初状态(V、T)开始发生等压变化,其体积的变化量ΔV
与热力学温度的变化量ΔT之间的关系为?=⑤ ?????。
1 | 气体的等压变化
(4)适用条件:气体的⑥ 质量????和压强不变。
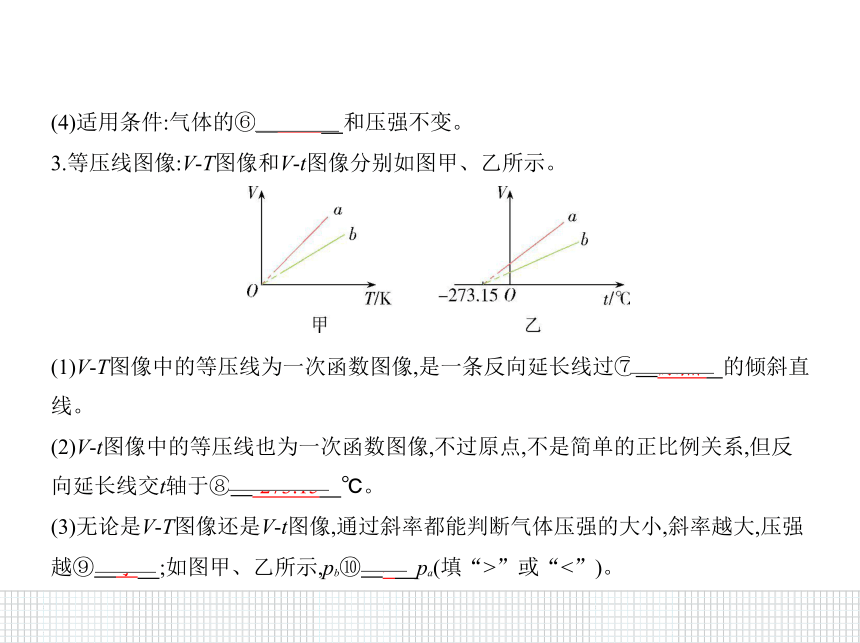
3.等压线图像:V-T图像和V-t图像分别如图甲、乙所示。
(1)V-T图像中的等压线为一次函数图像,是一条反向延长线过⑦ 原点????的倾斜直
线。
(2)V-t图像中的等压线也为一次函数图像,不过原点,不是简单的正比例关系,但反
向延长线交t轴于⑧ -273.15????℃。
(3)无论是V-T图像还是V-t图像,通过斜率都能判断气体压强的大小,斜率越大,压强
越⑨ 小????;如图甲、乙所示,pb⑩ >????pa(填“>”或“<”)。
1.等容变化:一定质量的某种气体,在? 体积????不变时,压强随温度变化的过程叫
作气体的等容变化。
2.查理定律
(1)内容:一定质量的某种气体,在体积不变的情况下,压强p与? 热力学温度T????成
? 正????比。
(2)表达式:?????p=CT????,其中C是常量;或者?=?,其中p1、T1和p2、T2分别表示气
体在不同状态下的压强和热力学温度。
(3)推论式:一定质量的气体,从初状态(p、T)开始发生等容变化,其压强的变化量Δp
与热力学温度的变化量ΔT之间的关系为?=??????????。
2 | 气体的等容变化
(4)适用条件:气体的? 质量????和体积不变。
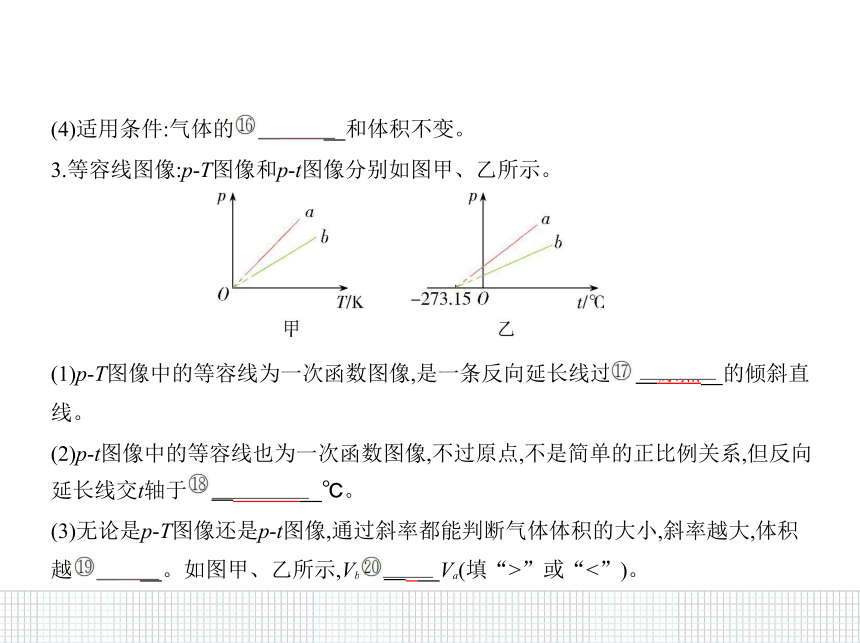
3.等容线图像:p-T图像和p-t图像分别如图甲、乙所示。
(1)p-T图像中的等容线为一次函数图像,是一条反向延长线过? 原点????的倾斜直
线。
(2)p-t图像中的等容线也为一次函数图像,不过原点,不是简单的正比例关系,但反向
延长线交t轴于? -273.15????℃。
(3)无论是p-T图像还是p-t图像,通过斜率都能判断气体体积的大小,斜率越大,体积
越? 小????。如图甲、乙所示,Vb? >????Va(填“>”或“<”)。
1.理想气体
(1)理想气体:在任何? 温度????、任何? 压强????下都遵从气体实验定律的气体,
我们把它叫作理想气体。
(2)理想气体的特点:气体分子? 大小????和? 相互作用力????可以忽略不计,也可
以不计气体分子与器壁碰撞的动能损失。理想气体分子除碰撞外,无相互作用的
引力和斥力,所以无分子势能,一定质量的理想气体内能只与温度有关。
(3)理想模型:理想气体在现实中并不存在,但是通过它可以对实际问题进行本质探
讨,并得到有价值的结论。实际气体在压强? 不太大????(相对大气压)、温度?????
不太低????(相对室温)的条件下,可以视为理想气体。或者说,在温度不低于零下几
十摄氏度、压强不超过大气压的几倍时,把实际气体当成理想气体来处理,误差很
小。
3 | 理想气体与理想气体的状态方程
2.理想气体的状态方程
(1)内容:一定质量的某种理想气体,在从某一状态变化到另一状态时,尽管其压
强p、体积V和温度T都可能改变,但是? 压强p????跟? 体积V????的乘积与?????
热力学温度T????的比值却保持不变。
(2)表达式:??????????=C,式中C是与压强p、体积V、温度T无关的常量,它与气体
的质量、种类有关;或者?=?。
1.玻意耳定律的微观解释
一定质量的某种理想气体,温度保持不变时,分子的? 平均动能????是一定的。在
这种情况下,体积减小时,分子的? 数密度????增大,单位时间内、单位面积上碰撞
器壁的分子数就多,气体的? 压强????就增大。
4 | 气体实验定律的微观解释
?
一定质量的某种理想气体,温度升高时,分子的? 平均动能????增大;只有气体的体
积同时增大,使分子的? 数密度????减小,才能保持压强不变。
2.盖-吕萨克定律的微观解释
?
一定质量的某种理想气体,体积保持不变时,分子的? 数密度????保持不变。在这
种情况下,温度升高时,分子的? 平均动能????增大,气体的压强就增大。
3.查理定律的微观解释
1.一定质量的气体,在体积不变的情况下,压强与摄氏温度成正比。?(????? )
2.一定质量的气体,若体积变大,则温度一定升高。?(????? )
3.一定质量的理想气体从状态1变化到状态2,经历的过程不同,状态参量的变化不
同。?(????? )
4.一定质量的某种气体,在压强不变时,无论是V-t图像还是V-T图像,其斜率都能表
示气体压强的大小,斜率越大,压强越大。?(????? )
提示:一定质量的某种气体,在压强不变时,无论是V-t图像还是V-T图像,其斜率越大,
压强越小。
5.实际气体在常温常压下可看作理想气体。?( √ )
提示:在温度不低于零下几十摄氏度、压强不超过大气压的几倍时,把实际气体当
成理想气体来处理。
判断正误,正确的画“ √” ,错误的画“ ?” 。
6.对于理想气体,在超低温和超高压时,气体的实验定律不适用了。?(????? )
提示:理想气体在任何温度、任何压强下都遵从气体实验定律。
7.能用气体实验定律来解决的问题不一定能用理想气体状态方程来求解。?(????? )
提示:能用气体实验定律来解决的问题一定能用理想气体状态方程来求解。
8.对于不同的理想气体,其状态方程?=C(恒量)中的恒量C相同。?(????? )
提示:理想气体状态方程?=C(恒量)中的恒量C与气体的质量、种类有关,对于不
同的理想气体恒量C是不同的。
9.一定质量的理想气体,体积保持不变,压强增大,气体分子热运动的平均速率也一
定增大。?( √ )
提示:根据查理定律,一定质量的理想气体,体积保持不变,压强增大,则温度升高,气
体分子的平均动能增大。
10.一定质量的某种理想气体,若p不变,V增大,则T增大,是由于分子密集程度减小,
要使压强不变,需使分子的平均动能增大。?( √ )
1 | 等压变化与盖-吕萨克定律
情境????全国热气球锦标赛是国内规模最大、竞赛水平最高、参与人数最多的热气
球赛事,也是国内热气球界最具吸引力和影响力并受新闻媒体关注的重要赛事。
问题
1.热气球的内部与外部是相通的,那么,热气球的内部气体压强与外部大气压强有
什么关系?
提示:相等。
2.在热气球的内部加热空气,内部气体的体积、密度如何变化?
提示:体积增大,密度减小。
3.热气球能够升空的力学原理是什么?
提示:热气球内部的空气被加热而等压膨胀,部分气体从内部溢出,相对于外部冷空
气具有更低的密度,外部空气的浮力使之升空。
研究对象
一定质量的某种气体,而且压强保持不变
适用条件
压强不太大,温度不太低
恒量C
在?=C中,C与气体的种类、质量、压强有关
比例关系
一定质量的某种气体在等压变化过程中,V与热
力学温度T成正比,不与摄氏温度t成正比,但体积
的变化ΔV与摄氏温度的变化Δt成正比
变量关系
一定质量的某种气体发生等压变化时,升高(或降
低)相同的温度,增加(或减小)的体积是相同的
对盖-吕萨克定律的理解
微观解释
一定质量(m)的某种理想气体的总分子数(N)是一
定的,要保持压强(p)不变,当温度(T)升高时,分子
运动的平均速率v会增加,那么单位体积内的分子
数(n)一定要减小(否则压强不可能不变),因此气
体体积(V)一定增大;反之,当温度降低时,气体体
积一定减小
公式变式
由?=?得?=?,所以ΔV=?V1,ΔT=?
T1
推导另
一种表述
气体做等压变化时,满足?=?,如果用V0表示温
度为0 ℃时气体的体积,则有?=?,所以Vt=
V0·?=V0·?=V0(1+?)
对查理定律的理解
2 | 等容变化与查理定律
研究对象
一定质量的某种气体,而且体积保持不变
适用条件
压强不太大,温度不太低的情况。当温度较低,压
强较大时,气体会液化,定律不再适用
恒量C
在?=C中,C与气体的种类、质量、体积有关
比例关系
一定质量的某种气体在等容变化过程中,压强p
跟热力学温度T成正比例关系,但是p不与摄氏温
度t成正比,压强的变化Δp与摄氏温度的变化Δt成
正比
变量关系
一定质量的某种气体发生等容变化时,升高(或降
低)相同的温度,增加(或减小)的压强是相同的
微观解释
一定质量(m)的某种理想气体的总分子数(N)是一
定的,体积(V)保持不变时,若温度(T)升高,分子运
动的平均速率(v)增大,则气体压强(p)增大;反之,
若温度(T)降低,气体压强(p)减小
公式变式
由?=?得?=?,所以Δp=?p1,ΔT=?T1
推导另
一种表述
气体做等容变化时,满足?=?,如果用p0表示温
度为0 ℃时气体的压强,则有?=?,所以pt=p0
·?=p0·?=p0(1+?)
对“理想气体”的理解
(1)宏观特点
①理想气体是为了方便研究问题提出的一种理想模型,是实际气体的一种科学抽
象,就像力学中的质点、电学中的点电荷模型一样。
②宏观上,理想气体严格遵从气体实验定律及理想气体状态方程。
(2)微观特点
①理想气体分子本身的大小与分子间的距离相比可以忽略不计。
②理想气体分子之间的相互作用力可以忽略不计,故无分子势能,理想气体的内能
等于所有分子热运动的动能之和,理想气体的内能仅由温度和分子总数决定,与气
体的体积无关。
3 | 理想气体及理想气体状态方程
③分子之间和分子与器壁之间的碰撞,都是完全弹性碰撞。除碰撞以外,分子向各
个方向的运动机会均等。
(3)实际处理
①理想气体是不存在的。在常温常压下,大多数实际气体,尤其是那些不易液化的
气体(氢气、氧气、氮气、氦气、空气等)都可以看成理想气体。
②在温度不低于零下几十摄氏度,压强不超过大气压的几倍时,很多气体都可当成
理想气体来处理。
对理想气体状态方程的理解
(1)成立条件:一定质量的理想气体。
(2)该方程表示的是气体三个状态参量的关系,与中间的变化过程无关。
(3)在?=C(恒量)中,恒量C与气体的种类、质量有关,与状态参量(p、V、T)无关。
(4)方程应用时单位方面应注意:温度T必须是热力学温度,公式两边中压强p和体积
V单位必须统一,但不一定是国际单位制中的单位。
(5)理想气体状态方程与气体实验定律
?=???
理想气体状态变化的图像
(1)一定质量理想气体的状态变化图像与特点
(2)一般状态变化图像的处理方法
基本方法是化“一般”为“特殊”。举例说明,如图是一定质量的某种气体的状
态变化过程A→B→C→A。在V-T图线上,等压线是一簇延长线过原点的直线,
过A、B、C三点作三条等压线分别表示三个过程,则有pA‘→B压强增大,温度降低,体积减小,B→C温度升高,体积减小,压强增大,C→A温度降
低,体积增大,压强减小。
理想气体状态方程的推广
(1)气体密度方程:?=?
对于一定质量的理想气体,在初状态(p1,V1,T1)时密度为ρ1,在末状态(p2,V2,T2)时密度
为ρ2,则联立ρ1=?、ρ2=?和理想气体状态方程?=?可得?=?。
适用条件:温度不太低(与常温比较)、压强不太大(与标准大气压比较)。
(2)分态式理想气体状态方程:?=?+?+…+?,此方程等号两边所取气体
质量必须相等。
证明:设有一定质量的理想气体,其压强为p0,体积为V0,热力学温度为T0,将该气体分
装于体积分别为V1、V2、…、Vn的n个容器内,则有?=?=?+
?+…+?。对于每一个容器内的气体来说,状态分别变为(p1,V1,T1)、(p2,V2,T
2)、…、(pn,Vn,Tn),则对每部分气体应用理想气体状态方程有?=?、?=
?、…、?=?,所以有?=?+?+?+…+?。
1.知道什么是等压变化,理解V-T图像,掌握盖-吕萨克定律。
2.知道什么是等容变化,理解p-T图像,掌握查理定律。
3.知道什么是理想气体,掌握理想气体状态方程。
4.能用气体分子动理论解释三个气体实验定律。
1.等压变化:一定质量的某种气体,在① 压强????不变时,体积随温度变化的过程叫
作气体的等压变化。
2.盖-吕萨克定律
(1)内容:一定质量的某种气体,在压强不变的情况下,其体积V与② 热力学温度T????
成③ 正????比。
(2)表达式:④????V=CT????,其中C是常量;或者?=?,其中V1、T1和V2、T2分别表示气
体在不同状态下的体积和热力学温度。
(3)推论式:一定质量的气体从初状态(V、T)开始发生等压变化,其体积的变化量ΔV
与热力学温度的变化量ΔT之间的关系为?=⑤ ?????。
1 | 气体的等压变化
(4)适用条件:气体的⑥ 质量????和压强不变。
3.等压线图像:V-T图像和V-t图像分别如图甲、乙所示。
(1)V-T图像中的等压线为一次函数图像,是一条反向延长线过⑦ 原点????的倾斜直
线。
(2)V-t图像中的等压线也为一次函数图像,不过原点,不是简单的正比例关系,但反
向延长线交t轴于⑧ -273.15????℃。
(3)无论是V-T图像还是V-t图像,通过斜率都能判断气体压强的大小,斜率越大,压强
越⑨ 小????;如图甲、乙所示,pb⑩ >????pa(填“>”或“<”)。
1.等容变化:一定质量的某种气体,在? 体积????不变时,压强随温度变化的过程叫
作气体的等容变化。
2.查理定律
(1)内容:一定质量的某种气体,在体积不变的情况下,压强p与? 热力学温度T????成
? 正????比。
(2)表达式:?????p=CT????,其中C是常量;或者?=?,其中p1、T1和p2、T2分别表示气
体在不同状态下的压强和热力学温度。
(3)推论式:一定质量的气体,从初状态(p、T)开始发生等容变化,其压强的变化量Δp
与热力学温度的变化量ΔT之间的关系为?=??????????。
2 | 气体的等容变化
(4)适用条件:气体的? 质量????和体积不变。
3.等容线图像:p-T图像和p-t图像分别如图甲、乙所示。
(1)p-T图像中的等容线为一次函数图像,是一条反向延长线过? 原点????的倾斜直
线。
(2)p-t图像中的等容线也为一次函数图像,不过原点,不是简单的正比例关系,但反向
延长线交t轴于? -273.15????℃。
(3)无论是p-T图像还是p-t图像,通过斜率都能判断气体体积的大小,斜率越大,体积
越? 小????。如图甲、乙所示,Vb? >????Va(填“>”或“<”)。
1.理想气体
(1)理想气体:在任何? 温度????、任何? 压强????下都遵从气体实验定律的气体,
我们把它叫作理想气体。
(2)理想气体的特点:气体分子? 大小????和? 相互作用力????可以忽略不计,也可
以不计气体分子与器壁碰撞的动能损失。理想气体分子除碰撞外,无相互作用的
引力和斥力,所以无分子势能,一定质量的理想气体内能只与温度有关。
(3)理想模型:理想气体在现实中并不存在,但是通过它可以对实际问题进行本质探
讨,并得到有价值的结论。实际气体在压强? 不太大????(相对大气压)、温度?????
不太低????(相对室温)的条件下,可以视为理想气体。或者说,在温度不低于零下几
十摄氏度、压强不超过大气压的几倍时,把实际气体当成理想气体来处理,误差很
小。
3 | 理想气体与理想气体的状态方程
2.理想气体的状态方程
(1)内容:一定质量的某种理想气体,在从某一状态变化到另一状态时,尽管其压
强p、体积V和温度T都可能改变,但是? 压强p????跟? 体积V????的乘积与?????
热力学温度T????的比值却保持不变。
(2)表达式:??????????=C,式中C是与压强p、体积V、温度T无关的常量,它与气体
的质量、种类有关;或者?=?。
1.玻意耳定律的微观解释
一定质量的某种理想气体,温度保持不变时,分子的? 平均动能????是一定的。在
这种情况下,体积减小时,分子的? 数密度????增大,单位时间内、单位面积上碰撞
器壁的分子数就多,气体的? 压强????就增大。
4 | 气体实验定律的微观解释
?
一定质量的某种理想气体,温度升高时,分子的? 平均动能????增大;只有气体的体
积同时增大,使分子的? 数密度????减小,才能保持压强不变。
2.盖-吕萨克定律的微观解释
?
一定质量的某种理想气体,体积保持不变时,分子的? 数密度????保持不变。在这
种情况下,温度升高时,分子的? 平均动能????增大,气体的压强就增大。
3.查理定律的微观解释
1.一定质量的气体,在体积不变的情况下,压强与摄氏温度成正比。?(????? )
2.一定质量的气体,若体积变大,则温度一定升高。?(????? )
3.一定质量的理想气体从状态1变化到状态2,经历的过程不同,状态参量的变化不
同。?(????? )
4.一定质量的某种气体,在压强不变时,无论是V-t图像还是V-T图像,其斜率都能表
示气体压强的大小,斜率越大,压强越大。?(????? )
提示:一定质量的某种气体,在压强不变时,无论是V-t图像还是V-T图像,其斜率越大,
压强越小。
5.实际气体在常温常压下可看作理想气体。?( √ )
提示:在温度不低于零下几十摄氏度、压强不超过大气压的几倍时,把实际气体当
成理想气体来处理。
判断正误,正确的画“ √” ,错误的画“ ?” 。
6.对于理想气体,在超低温和超高压时,气体的实验定律不适用了。?(????? )
提示:理想气体在任何温度、任何压强下都遵从气体实验定律。
7.能用气体实验定律来解决的问题不一定能用理想气体状态方程来求解。?(????? )
提示:能用气体实验定律来解决的问题一定能用理想气体状态方程来求解。
8.对于不同的理想气体,其状态方程?=C(恒量)中的恒量C相同。?(????? )
提示:理想气体状态方程?=C(恒量)中的恒量C与气体的质量、种类有关,对于不
同的理想气体恒量C是不同的。
9.一定质量的理想气体,体积保持不变,压强增大,气体分子热运动的平均速率也一
定增大。?( √ )
提示:根据查理定律,一定质量的理想气体,体积保持不变,压强增大,则温度升高,气
体分子的平均动能增大。
10.一定质量的某种理想气体,若p不变,V增大,则T增大,是由于分子密集程度减小,
要使压强不变,需使分子的平均动能增大。?( √ )
1 | 等压变化与盖-吕萨克定律
情境????全国热气球锦标赛是国内规模最大、竞赛水平最高、参与人数最多的热气
球赛事,也是国内热气球界最具吸引力和影响力并受新闻媒体关注的重要赛事。
问题
1.热气球的内部与外部是相通的,那么,热气球的内部气体压强与外部大气压强有
什么关系?
提示:相等。
2.在热气球的内部加热空气,内部气体的体积、密度如何变化?
提示:体积增大,密度减小。
3.热气球能够升空的力学原理是什么?
提示:热气球内部的空气被加热而等压膨胀,部分气体从内部溢出,相对于外部冷空
气具有更低的密度,外部空气的浮力使之升空。
研究对象
一定质量的某种气体,而且压强保持不变
适用条件
压强不太大,温度不太低
恒量C
在?=C中,C与气体的种类、质量、压强有关
比例关系
一定质量的某种气体在等压变化过程中,V与热
力学温度T成正比,不与摄氏温度t成正比,但体积
的变化ΔV与摄氏温度的变化Δt成正比
变量关系
一定质量的某种气体发生等压变化时,升高(或降
低)相同的温度,增加(或减小)的体积是相同的
对盖-吕萨克定律的理解
微观解释
一定质量(m)的某种理想气体的总分子数(N)是一
定的,要保持压强(p)不变,当温度(T)升高时,分子
运动的平均速率v会增加,那么单位体积内的分子
数(n)一定要减小(否则压强不可能不变),因此气
体体积(V)一定增大;反之,当温度降低时,气体体
积一定减小
公式变式
由?=?得?=?,所以ΔV=?V1,ΔT=?
T1
推导另
一种表述
气体做等压变化时,满足?=?,如果用V0表示温
度为0 ℃时气体的体积,则有?=?,所以Vt=
V0·?=V0·?=V0(1+?)
对查理定律的理解
2 | 等容变化与查理定律
研究对象
一定质量的某种气体,而且体积保持不变
适用条件
压强不太大,温度不太低的情况。当温度较低,压
强较大时,气体会液化,定律不再适用
恒量C
在?=C中,C与气体的种类、质量、体积有关
比例关系
一定质量的某种气体在等容变化过程中,压强p
跟热力学温度T成正比例关系,但是p不与摄氏温
度t成正比,压强的变化Δp与摄氏温度的变化Δt成
正比
变量关系
一定质量的某种气体发生等容变化时,升高(或降
低)相同的温度,增加(或减小)的压强是相同的
微观解释
一定质量(m)的某种理想气体的总分子数(N)是一
定的,体积(V)保持不变时,若温度(T)升高,分子运
动的平均速率(v)增大,则气体压强(p)增大;反之,
若温度(T)降低,气体压强(p)减小
公式变式
由?=?得?=?,所以Δp=?p1,ΔT=?T1
推导另
一种表述
气体做等容变化时,满足?=?,如果用p0表示温
度为0 ℃时气体的压强,则有?=?,所以pt=p0
·?=p0·?=p0(1+?)
对“理想气体”的理解
(1)宏观特点
①理想气体是为了方便研究问题提出的一种理想模型,是实际气体的一种科学抽
象,就像力学中的质点、电学中的点电荷模型一样。
②宏观上,理想气体严格遵从气体实验定律及理想气体状态方程。
(2)微观特点
①理想气体分子本身的大小与分子间的距离相比可以忽略不计。
②理想气体分子之间的相互作用力可以忽略不计,故无分子势能,理想气体的内能
等于所有分子热运动的动能之和,理想气体的内能仅由温度和分子总数决定,与气
体的体积无关。
3 | 理想气体及理想气体状态方程
③分子之间和分子与器壁之间的碰撞,都是完全弹性碰撞。除碰撞以外,分子向各
个方向的运动机会均等。
(3)实际处理
①理想气体是不存在的。在常温常压下,大多数实际气体,尤其是那些不易液化的
气体(氢气、氧气、氮气、氦气、空气等)都可以看成理想气体。
②在温度不低于零下几十摄氏度,压强不超过大气压的几倍时,很多气体都可当成
理想气体来处理。
对理想气体状态方程的理解
(1)成立条件:一定质量的理想气体。
(2)该方程表示的是气体三个状态参量的关系,与中间的变化过程无关。
(3)在?=C(恒量)中,恒量C与气体的种类、质量有关,与状态参量(p、V、T)无关。
(4)方程应用时单位方面应注意:温度T必须是热力学温度,公式两边中压强p和体积
V单位必须统一,但不一定是国际单位制中的单位。
(5)理想气体状态方程与气体实验定律
?=???
理想气体状态变化的图像
(1)一定质量理想气体的状态变化图像与特点
(2)一般状态变化图像的处理方法
基本方法是化“一般”为“特殊”。举例说明,如图是一定质量的某种气体的状
态变化过程A→B→C→A。在V-T图线上,等压线是一簇延长线过原点的直线,
过A、B、C三点作三条等压线分别表示三个过程,则有pA‘
低,体积增大,压强减小。
理想气体状态方程的推广
(1)气体密度方程:?=?
对于一定质量的理想气体,在初状态(p1,V1,T1)时密度为ρ1,在末状态(p2,V2,T2)时密度
为ρ2,则联立ρ1=?、ρ2=?和理想气体状态方程?=?可得?=?。
适用条件:温度不太低(与常温比较)、压强不太大(与标准大气压比较)。
(2)分态式理想气体状态方程:?=?+?+…+?,此方程等号两边所取气体
质量必须相等。
证明:设有一定质量的理想气体,其压强为p0,体积为V0,热力学温度为T0,将该气体分
装于体积分别为V1、V2、…、Vn的n个容器内,则有?=?=?+
?+…+?。对于每一个容器内的气体来说,状态分别变为(p1,V1,T1)、(p2,V2,T
2)、…、(pn,Vn,Tn),则对每部分气体应用理想气体状态方程有?=?、?=
?、…、?=?,所以有?=?+?+?+…+?。
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
