化学平衡的图象
图片预览


文档简介
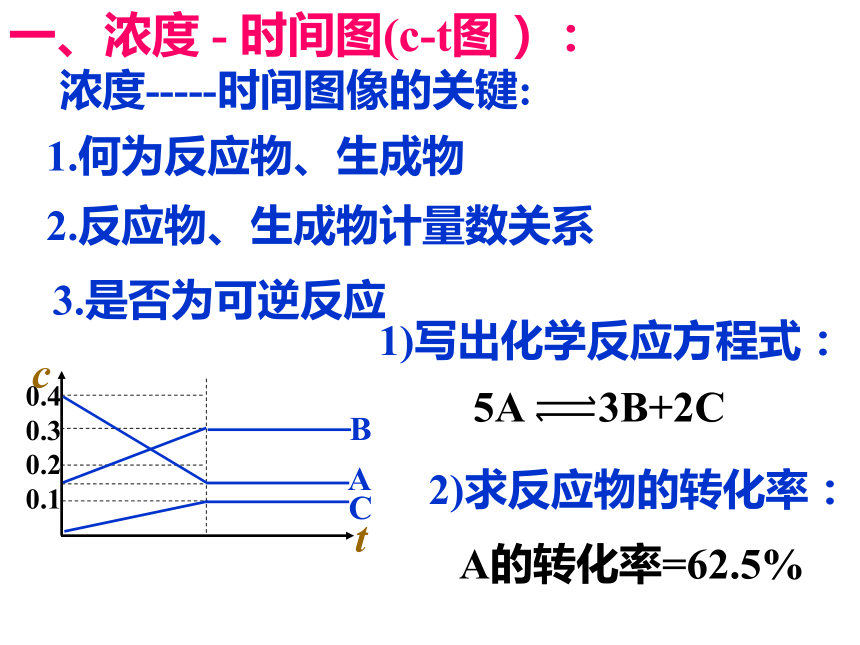
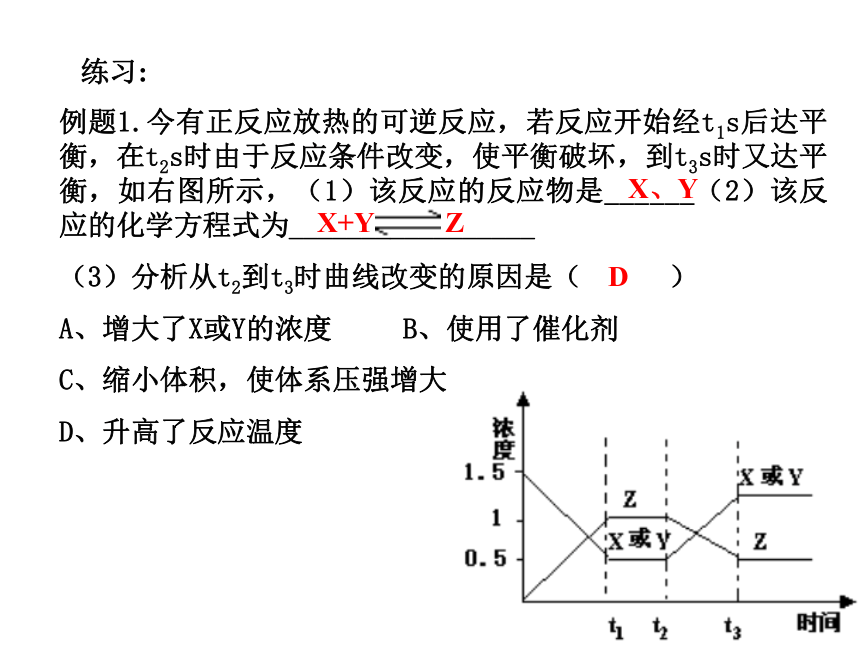
课件25张PPT。化学平衡的图象一、浓度 - 时间图(c-t图):1)写出化学反应方程式:A的转化率=62.5%1.何为反应物、生成物浓度-----时间图像的关键: 2)求反应物的转化率:2.反应物、生成物计量数关系3.是否为可逆反应练习:例题1.今有正反应放热的可逆反应,若反应开始经t1s后达平衡,在t2s时由于反应条件改变,使平衡破坏,到t3s时又达平衡,如右图所示,(1)该反应的反应物是______(2)该反应的化学方程式为_________________
(3)分析从t2到t3时曲线改变的原因是( )
A、增大了X或Y的浓度 B、使用了催化剂
C、缩小体积,使体系压强增大
D、升高了反应温度X、YX+Y ZD二、速率-时间图: 可用于:
1) 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。?引起平衡移动的因素是
,平衡
将向 方向移动。增大反应物浓度正?引起平衡移动的因素是
,平衡
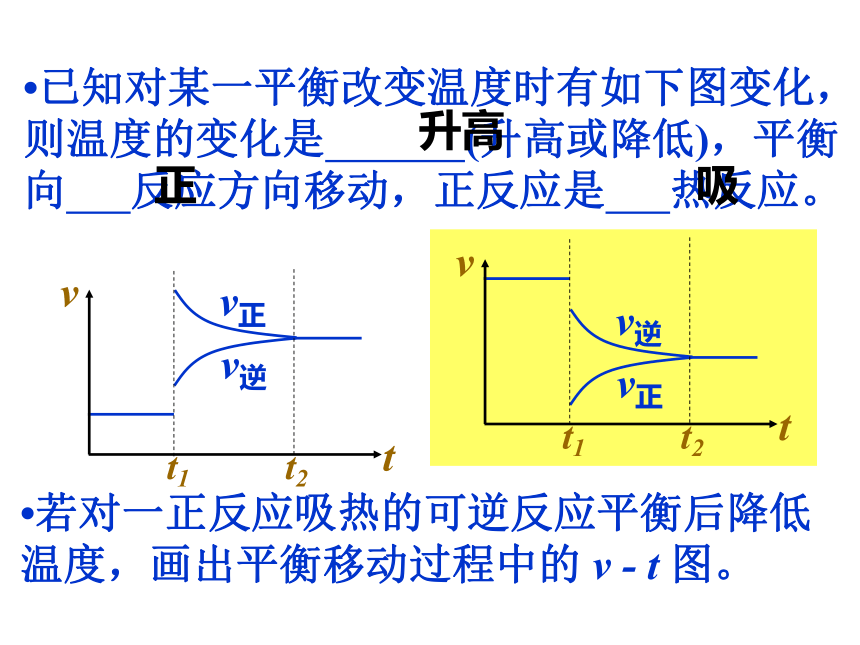
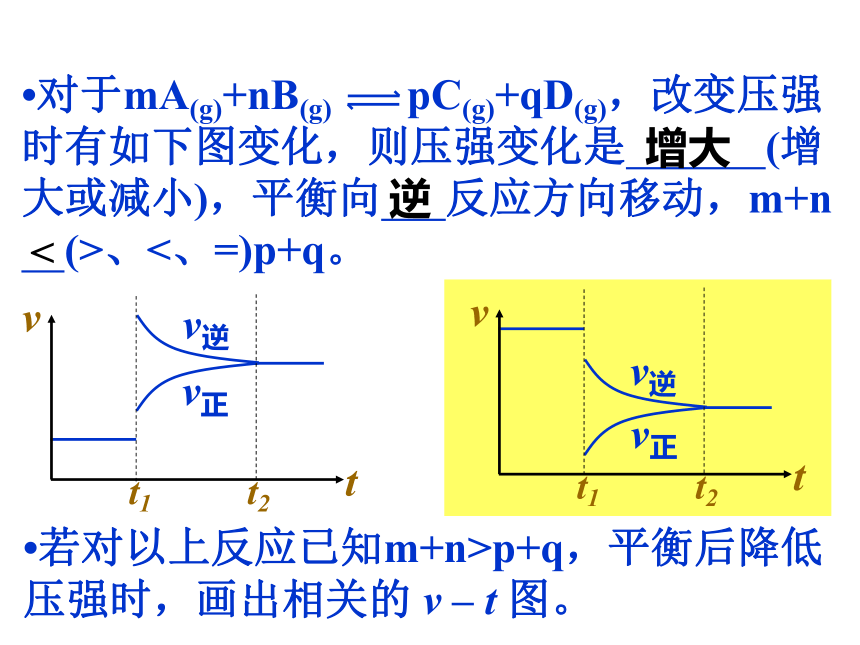
将向 方向移动。减小生成物浓度正?已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低),平衡向 反应方向移动,正反应是 热反应。升高正吸?若对一正反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。?对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则压强变化是 (增大或减小),平衡向 反应方向移动,m+n
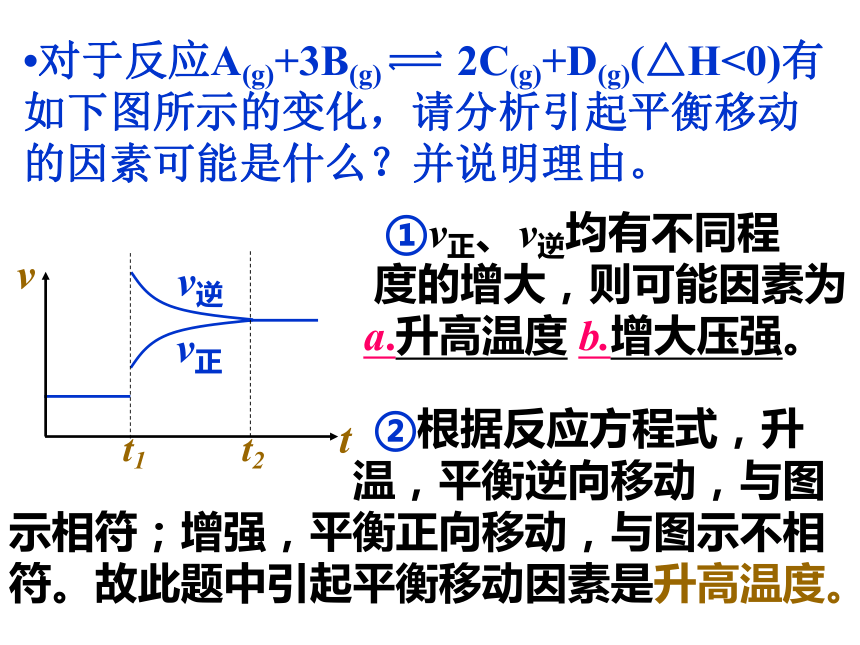
(>、<、=)p+q。增大逆p+q,平衡后降低压强时,画出相关的 v – t 图。?对于反应A(g)+3B(g) 2C(g)+D(g)(△H<0)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。 ①v正、v逆均有不同程
度的增大,则可能因素为
a.升高温度 b.增大压强。
②根据反应方程式,升
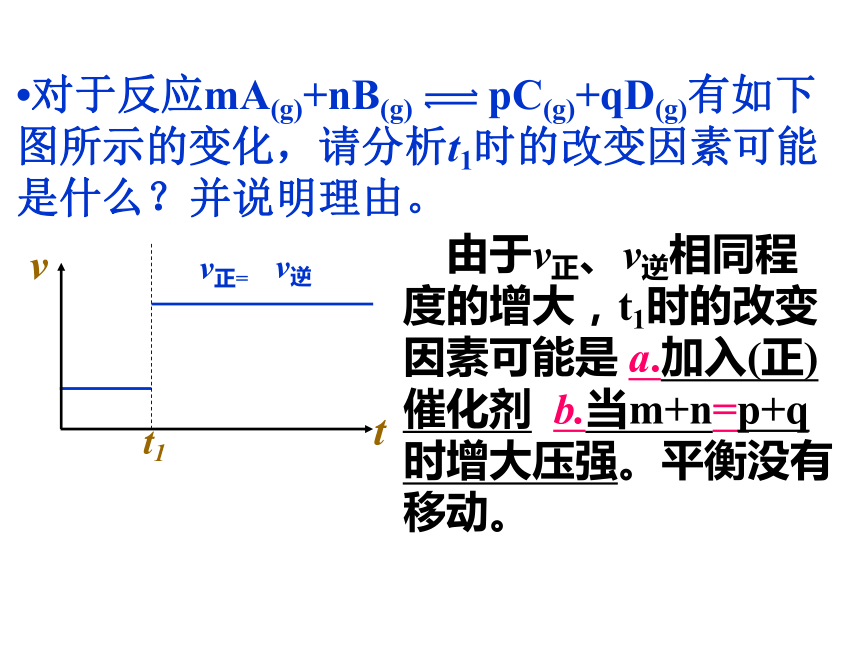
温,平衡逆向移动,与图示相符;增强,平衡正向移动,与图示不相符。故此题中引起平衡移动因素是升高温度。?对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。 由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。练习: 1、以mA(g)+nB(g) qC (g);为例
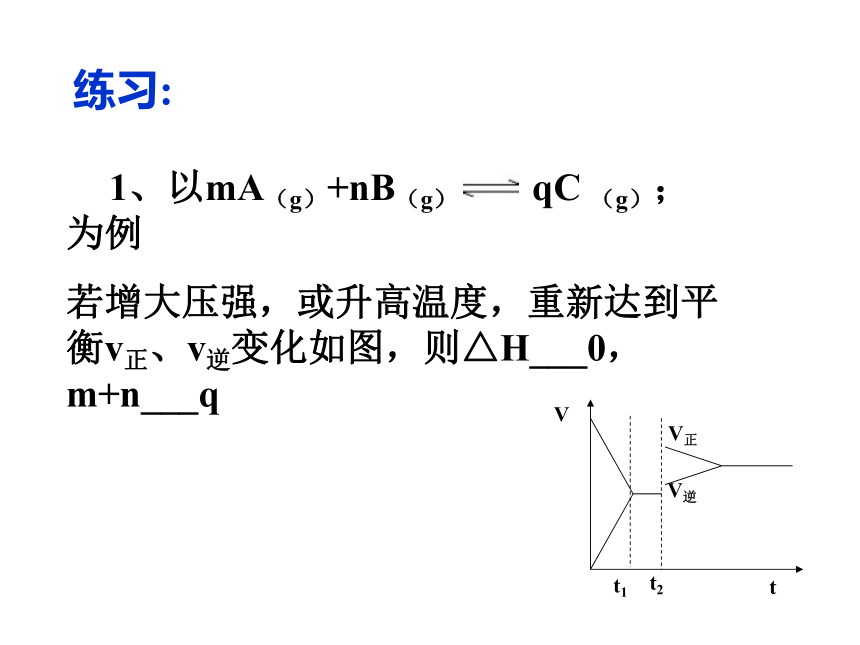
若增大压强,或升高温度,重新达到平衡v正、v逆变化如图,则△H___0,m+n___q三、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应吸热?m+n A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%A、D五、其它:?正反应 热?正反应 热?正反应 热?m+n p+q对于反应mA(g)+nB(g) pC(g)+qD(g)吸吸放<对于化学反应速率和化学平衡的有关图象问题,可按以下的方法进行分析: ①认清坐标系中纵、横坐标所代表的意义,并用勒夏特列原理解题。
②紧扣可逆反应的特征,搞清正反应方向是吸还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
③看清速率的变化及变化量的大小,在条件与变化之间搭桥。 ④看清起点、拐点、终点,看清曲线的变化趋势。 ⑤先拐先平。例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
⑥定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。解答时遵守两个原则:①定一议二;②先拐后平。P2 > P 1T2 < T 1m + n > p放例2(2004年广东18).右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度
B.加大X的投入量
C.加催化剂
D.减小体积1.下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
D0练习:ABCDC点TNO转化率图表示反应N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是
A t0~t1 B t2~t3
C t3~t4 D t5~t6
右图是温度和压强对X+Y 2z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A 上述可逆反应的正反应为放热反应
B X、Y、Z均为气态
C X和Y中只有一种为气态,Z为气态
D 上述反应的逆反应的ΔH>0
在下列反应中:A2(g)+B2(g) 2AB(g)(正反应放热)当其达到平衡时,在下图的曲线中,符合勒夏特列原理的曲线是
A ①② B ③④ C ① D ①⑤下图表示某可逆反应达到平衡过程中某一反应物的v—t图象,我们知道v=Δc/ Δt;反之,Δc= v×Δt。请问下列v—t图象中的阴影面积表示的意义是( )CA、从反应开始到平衡时,该反应物的消耗浓度
B、从反应开始到平衡时,该反应物的生成浓度
C、从反应开始到平衡时,该反应物实际减小的浓度一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A气体的浓度为0.5mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3mol·L-1,则下列叙述正确的是( )?
A.平衡向正反应方向移动?
B.x +y>z?
C.C的体积分数降低?
D.B的转化率提高? B、C
(3)分析从t2到t3时曲线改变的原因是( )
A、增大了X或Y的浓度 B、使用了催化剂
C、缩小体积,使体系压强增大
D、升高了反应温度X、YX+Y ZD二、速率-时间图: 可用于:
1) 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。?引起平衡移动的因素是
,平衡
将向 方向移动。增大反应物浓度正?引起平衡移动的因素是
,平衡
将向 方向移动。减小生成物浓度正?已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低),平衡向 反应方向移动,正反应是 热反应。升高正吸?若对一正反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。?对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则压强变化是 (增大或减小),平衡向 反应方向移动,m+n
(>、<、=)p+q。增大逆p+q,平衡后降低压强时,画出相关的 v – t 图。?对于反应A(g)+3B(g) 2C(g)+D(g)(△H<0)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。 ①v正、v逆均有不同程
度的增大,则可能因素为
a.升高温度 b.增大压强。
②根据反应方程式,升
温,平衡逆向移动,与图示相符;增强,平衡正向移动,与图示不相符。故此题中引起平衡移动因素是升高温度。?对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。 由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。练习: 1、以mA(g)+nB(g) qC (g);为例
若增大压强,或升高温度,重新达到平衡v正、v逆变化如图,则△H___0,m+n___q三、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应吸热?m+n
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%A、D五、其它:?正反应 热?正反应 热?正反应 热?m+n p+q对于反应mA(g)+nB(g) pC(g)+qD(g)吸吸放<对于化学反应速率和化学平衡的有关图象问题,可按以下的方法进行分析: ①认清坐标系中纵、横坐标所代表的意义,并用勒夏特列原理解题。
②紧扣可逆反应的特征,搞清正反应方向是吸还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
③看清速率的变化及变化量的大小,在条件与变化之间搭桥。 ④看清起点、拐点、终点,看清曲线的变化趋势。 ⑤先拐先平。例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
⑥定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。解答时遵守两个原则:①定一议二;②先拐后平。P2 > P 1T2 < T 1m + n > p放例2(2004年广东18).右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度
B.加大X的投入量
C.加催化剂
D.减小体积1.下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
D0练习:ABCDC点TNO转化率图表示反应N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是
A t0~t1 B t2~t3
C t3~t4 D t5~t6
右图是温度和压强对X+Y 2z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A 上述可逆反应的正反应为放热反应
B X、Y、Z均为气态
C X和Y中只有一种为气态,Z为气态
D 上述反应的逆反应的ΔH>0
在下列反应中:A2(g)+B2(g) 2AB(g)(正反应放热)当其达到平衡时,在下图的曲线中,符合勒夏特列原理的曲线是
A ①② B ③④ C ① D ①⑤下图表示某可逆反应达到平衡过程中某一反应物的v—t图象,我们知道v=Δc/ Δt;反之,Δc= v×Δt。请问下列v—t图象中的阴影面积表示的意义是( )CA、从反应开始到平衡时,该反应物的消耗浓度
B、从反应开始到平衡时,该反应物的生成浓度
C、从反应开始到平衡时,该反应物实际减小的浓度一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A气体的浓度为0.5mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3mol·L-1,则下列叙述正确的是( )?
A.平衡向正反应方向移动?
B.x +y>z?
C.C的体积分数降低?
D.B的转化率提高? B、C
