山东省临清三中2012高二化学课件:第3章第2节 分子晶体与原子晶体(人教版选修3)
文档属性
| 名称 | 山东省临清三中2012高二化学课件:第3章第2节 分子晶体与原子晶体(人教版选修3) |  | |
| 格式 | rar | ||
| 文件大小 | 371.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-24 21:36:10 | ||
图片预览









文档简介
(共33张PPT)
第二节 分子晶体与原子晶体
学习目标
1.掌握分子晶体、原子晶体的概念及结构特点。
2.掌握晶体类型与性质之间的关系。
3.了解氢键对物质物理性质的影响。
课堂互动讲练
课前自主学案
知能优化训练
第二节 分子晶体与原子晶体
课前自主学案
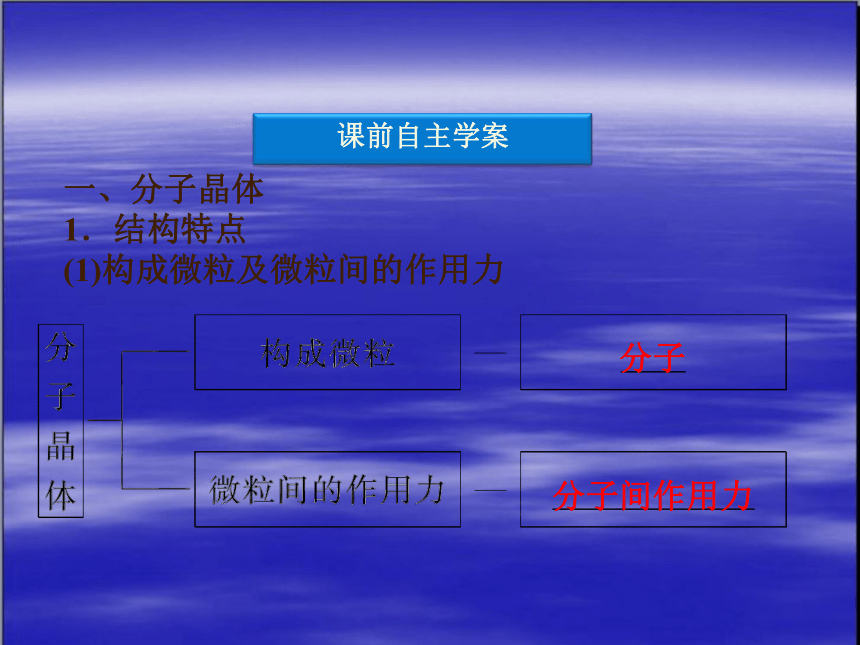
一、分子晶体
1.结构特点
(1)构成微粒及微粒间的作用力
分子
分子间作用力
(2)微粒堆积方式
①若分子间只有范德华力,则分子晶体有_______________特征,即每个分子周围有______个紧邻分子。
②若分子间含有其他作用力,如氢键。由于氢键具有___________,使分子不能采取密堆积的方式,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有4个紧邻的水分子。
分子密堆积
12
方向性
2.属于分子晶体的物质
(1)所有____________________,如H2O、NH3、CH4等。
(2)部分非金属单质,如卤素(X2)、O2、N2、白磷(P4)、硫(S8)、稀有气体等。
(3)部分_________________,如CO2、P4O6、P4O10、SO2等。
(4)几乎所有的_______,如HNO3、H2SO4、H3PO4、H2SiO3等。
(5)绝大多数有机物的晶体,如苯、乙醇。
非金属氢化物
非金属氧化物
酸
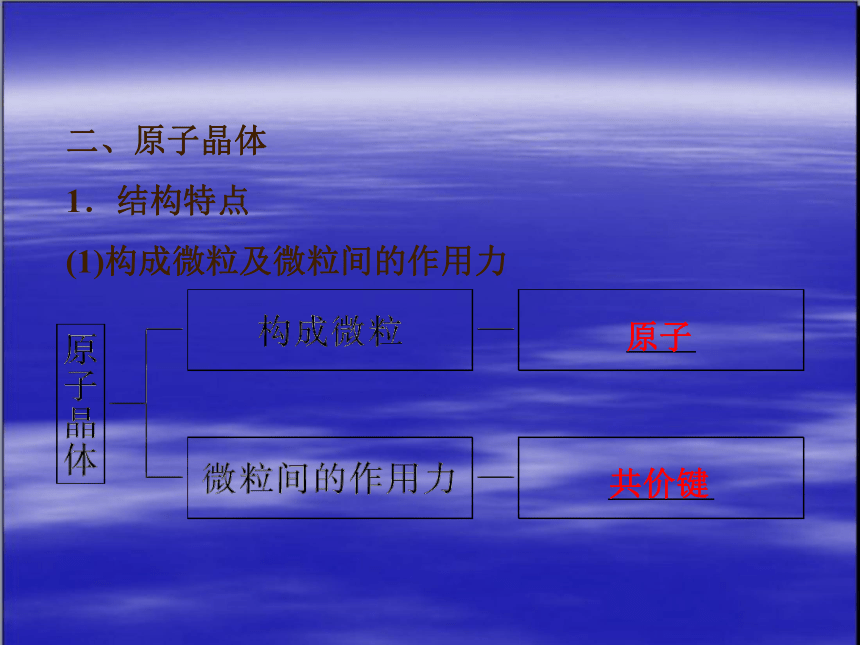
二、原子晶体
1.结构特点
(1)构成微粒及微粒间的作用力
原子
共价键
(2)微粒堆积方式:
整块晶体是一个三维的_____________结构,不存在单个小分子,是一个“巨分子”,又称_______________。
2.属于原子晶体的物质
(1)某些______________,如晶体硼、晶体硅、晶体锗、金刚石等。
(2)某些___________________,如碳化硅(SiC)、二氧化硅(SiO2)、氮化硅(Si3N4)、氮化硼(BN)等。
共价键网状
共价晶体
非金属单质
非金属化合物
思考感悟
(1)含有共价键的晶体都是原子晶体吗?
(2)SiO2是二氧化硅的分子式吗?
【提示】 (1)原子晶体中都有共价键,但含有共价键的不一定是原子晶体。如CO2、H2O等分子晶体中也含有共价键。
(2)二氧化硅为原子晶体,晶体中不存在单个分子,其化学式为Si与O的最简个数比,而不是分子式。
课堂互动讲练
分子晶体与原子晶体的比较
晶体类型 分子晶体 原子晶体
定义 分子间通过分子间作用力结合形成的晶体 相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体
组成微粒 分子 原子
晶体类型 分子晶体 原子晶体
物质类别 多数的非金属单质和共价化合物 金刚石、晶体硅、碳化硅、二氧化硅等少数非金属单质及共价化合物
微粒间
的作用力 分子间作用力(氢键、范德华力) 共价键(极性键、非极性键)
熔化时需克
服的作用力 较弱的分子间作用力 很强的共价键
晶体类型 分子晶体 原子晶体
物理性质 熔、沸点 较低 很高
硬度 较小 很大
导电性 固态和熔化时都不导电,但某些分子晶体溶于水能导电,如HCl 固态和熔化时都不导电
(Si、Ge为半导体)
溶解性 相似相溶 难溶于一般溶剂
决定熔、
沸点高
低的因素 分子间作用力的强弱 共价键的强弱
晶体类型 分子晶体 原子晶体
典型例子 (1)干冰
①每个晶胞中有4个CO2分子,12个原子。
②每个CO2分子周围等距离紧邻的CO2分子有12个。 (1)金刚石
①在晶体中每个碳原子以4个共价键对称地与相邻的4个碳原子相结合,形成正四面体结构。②晶体中C—C—C夹角为109°28′,碳原子采取了sp3杂化。
③最小环上有6个碳原子。
④晶体中C原子个数与C—C键数之比为
1∶(4× )=1∶2。
晶体类型 分子晶体 原子晶体
典型例子 (2)冰
①水分子之间的作用力有范德华力,但主要作用力是氢键。
②由于氢键的存在迫使在四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。
(2)二氧化硅
①在晶体中每个硅原子和4个氧原子形成4个共价键;每个氧原子与2个硅原子相结合。故SiO2晶体中硅原子与氧原子按1∶2的比例组成。
②最小环上有12个原子。
特别提醒:分子晶体熔化时一定会破坏范德华力,有一些晶体还破坏氢键,如冰的熔化。还有少数晶体会破坏共价键,如S8晶体熔化时,除破坏范德华力外,S8分子也会分解,破坏共价键。
例1
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2
④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫磺和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
【解析】 本题考查了化学键的类型与晶体类型的判断。解题时应注意化学键类型的判断。属于分子晶体的有SO3、HCl、CO2、SO2、晶体氖、晶体氮、硫磺和碘。属于原子晶体的有SiO2、晶体硼、晶体硅和金刚石。但晶体氖是由稀有气体分子组成,稀有气体为单原子分子,分子间不存在化学键。
【答案】 C
【规律方法】 判断非金属元素组成的晶体是分子晶体还是原子晶体的方法有:
(1)依据构成晶体的粒子和粒子间的作用判断:原子晶体的构成粒子是原子,质点间的作用是共价键;分子晶体的构成粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。常见的原子晶体有:某些非金属单质如硼、硅、锗等;某些非金属化合物如碳化硅、氮化硼、二氧化硅等。
(3)依据晶体的熔、沸点判断:原子晶体熔、沸点高,常在1000 ℃以上;分子晶体熔、沸点低,常在几百度以下至很低的温度。
(4)依据导电性判断:分子晶体为非导体,但部分分子晶体溶于水后能导电;原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。
变式训练1 (2011年黄冈高二检测)下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.因为HCl的相对分子质量大于HF,所以HCl的熔点高于HF
C.干冰升华时,分子内共价键不会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
解析:选C。原子晶体中可能存在非极性共价键,也可能存在极性共价键,如SiO2、SiC等,A不正确;HF晶体中存在氢键,熔点高于HCl晶体,B不正确;干冰升华是物理变化,分子间作用力被破坏,但分子内共价键不断裂,C正确;金属元素和非金属元素形成的化合物不一定是离子化合物,也可能是共价化合物,如AlCl3等,D不正确。
分子晶体和原子晶体熔、沸点比较
1.不同类型的晶体:原子晶体>分子晶体。
2.同一类型的晶体
(1)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常的高。如H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如CO>N2,CH3OH>CH3CH3。
④同分异构体,支链越多,熔、沸点越低。
(2)原子晶体
晶体的熔、沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。
例2
(2011年黄石高二检测)据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167 kJ·mol-1。请回答下列问题。
(1)N60分子组成的晶体为________晶体,其熔、沸点比N2________(填“高”或“低”),原因是________________________________________________________________________
________________________________________________________________________。
(2)1 mol N60分解成N2时吸收或放出的热量是________________________________________________________________________
kJ(已知N≡N键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种)
________________________________________________________________________。
【思路点拨】
(3)由于反应放出大量的热同时生成大量气体,因此N60可用作高能炸药。
【答案】 (1)分子 高 N60、N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
(2)13230 <
(3)N60可作高能炸药
【误区警示】 比较分子晶体熔、沸点高低时,要充分考虑影响分子晶体熔、沸点的各种因素,如相对分子质量对组成和结构都相似的分子晶体熔、沸点的影响,相对分子质量越大,分子间作用力越大,熔、沸点越高;在同分异构体中,支链越多,熔、沸点越低。不要漏了氢键的影响,氢键的存在使得相应的氢化物的熔、沸点比同族元素氢化物的熔、沸点高得多。
变式训练2 下列分子晶体,关于熔、沸点高低叙述中,正确的是( )
A.Cl2>I2
B.SiCl4>CCl4
C.NH3<PH3
D.C(CH3)4>CH3(CH2)3CH3
解析:选B。比较物质熔、沸点,先搞清该物质属于哪一类晶体,再分析决定晶体熔、沸点的因素。A、B选项属于无氢键存在的分子结构相似的情况,相对分子质量大的熔、沸点高;C选项属于有氢键存在但分子结构相似的情况,存在氢键的熔、沸点高;D选项属于相对分子质量相同,但分子结构不同的情况,支链越多的熔、沸点越低。
第二节 分子晶体与原子晶体
学习目标
1.掌握分子晶体、原子晶体的概念及结构特点。
2.掌握晶体类型与性质之间的关系。
3.了解氢键对物质物理性质的影响。
课堂互动讲练
课前自主学案
知能优化训练
第二节 分子晶体与原子晶体
课前自主学案
一、分子晶体
1.结构特点
(1)构成微粒及微粒间的作用力
分子
分子间作用力
(2)微粒堆积方式
①若分子间只有范德华力,则分子晶体有_______________特征,即每个分子周围有______个紧邻分子。
②若分子间含有其他作用力,如氢键。由于氢键具有___________,使分子不能采取密堆积的方式,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有4个紧邻的水分子。
分子密堆积
12
方向性
2.属于分子晶体的物质
(1)所有____________________,如H2O、NH3、CH4等。
(2)部分非金属单质,如卤素(X2)、O2、N2、白磷(P4)、硫(S8)、稀有气体等。
(3)部分_________________,如CO2、P4O6、P4O10、SO2等。
(4)几乎所有的_______,如HNO3、H2SO4、H3PO4、H2SiO3等。
(5)绝大多数有机物的晶体,如苯、乙醇。
非金属氢化物
非金属氧化物
酸
二、原子晶体
1.结构特点
(1)构成微粒及微粒间的作用力
原子
共价键
(2)微粒堆积方式:
整块晶体是一个三维的_____________结构,不存在单个小分子,是一个“巨分子”,又称_______________。
2.属于原子晶体的物质
(1)某些______________,如晶体硼、晶体硅、晶体锗、金刚石等。
(2)某些___________________,如碳化硅(SiC)、二氧化硅(SiO2)、氮化硅(Si3N4)、氮化硼(BN)等。
共价键网状
共价晶体
非金属单质
非金属化合物
思考感悟
(1)含有共价键的晶体都是原子晶体吗?
(2)SiO2是二氧化硅的分子式吗?
【提示】 (1)原子晶体中都有共价键,但含有共价键的不一定是原子晶体。如CO2、H2O等分子晶体中也含有共价键。
(2)二氧化硅为原子晶体,晶体中不存在单个分子,其化学式为Si与O的最简个数比,而不是分子式。
课堂互动讲练
分子晶体与原子晶体的比较
晶体类型 分子晶体 原子晶体
定义 分子间通过分子间作用力结合形成的晶体 相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体
组成微粒 分子 原子
晶体类型 分子晶体 原子晶体
物质类别 多数的非金属单质和共价化合物 金刚石、晶体硅、碳化硅、二氧化硅等少数非金属单质及共价化合物
微粒间
的作用力 分子间作用力(氢键、范德华力) 共价键(极性键、非极性键)
熔化时需克
服的作用力 较弱的分子间作用力 很强的共价键
晶体类型 分子晶体 原子晶体
物理性质 熔、沸点 较低 很高
硬度 较小 很大
导电性 固态和熔化时都不导电,但某些分子晶体溶于水能导电,如HCl 固态和熔化时都不导电
(Si、Ge为半导体)
溶解性 相似相溶 难溶于一般溶剂
决定熔、
沸点高
低的因素 分子间作用力的强弱 共价键的强弱
晶体类型 分子晶体 原子晶体
典型例子 (1)干冰
①每个晶胞中有4个CO2分子,12个原子。
②每个CO2分子周围等距离紧邻的CO2分子有12个。 (1)金刚石
①在晶体中每个碳原子以4个共价键对称地与相邻的4个碳原子相结合,形成正四面体结构。②晶体中C—C—C夹角为109°28′,碳原子采取了sp3杂化。
③最小环上有6个碳原子。
④晶体中C原子个数与C—C键数之比为
1∶(4× )=1∶2。
晶体类型 分子晶体 原子晶体
典型例子 (2)冰
①水分子之间的作用力有范德华力,但主要作用力是氢键。
②由于氢键的存在迫使在四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。
(2)二氧化硅
①在晶体中每个硅原子和4个氧原子形成4个共价键;每个氧原子与2个硅原子相结合。故SiO2晶体中硅原子与氧原子按1∶2的比例组成。
②最小环上有12个原子。
特别提醒:分子晶体熔化时一定会破坏范德华力,有一些晶体还破坏氢键,如冰的熔化。还有少数晶体会破坏共价键,如S8晶体熔化时,除破坏范德华力外,S8分子也会分解,破坏共价键。
例1
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2
④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫磺和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
【解析】 本题考查了化学键的类型与晶体类型的判断。解题时应注意化学键类型的判断。属于分子晶体的有SO3、HCl、CO2、SO2、晶体氖、晶体氮、硫磺和碘。属于原子晶体的有SiO2、晶体硼、晶体硅和金刚石。但晶体氖是由稀有气体分子组成,稀有气体为单原子分子,分子间不存在化学键。
【答案】 C
【规律方法】 判断非金属元素组成的晶体是分子晶体还是原子晶体的方法有:
(1)依据构成晶体的粒子和粒子间的作用判断:原子晶体的构成粒子是原子,质点间的作用是共价键;分子晶体的构成粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。常见的原子晶体有:某些非金属单质如硼、硅、锗等;某些非金属化合物如碳化硅、氮化硼、二氧化硅等。
(3)依据晶体的熔、沸点判断:原子晶体熔、沸点高,常在1000 ℃以上;分子晶体熔、沸点低,常在几百度以下至很低的温度。
(4)依据导电性判断:分子晶体为非导体,但部分分子晶体溶于水后能导电;原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。
变式训练1 (2011年黄冈高二检测)下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.因为HCl的相对分子质量大于HF,所以HCl的熔点高于HF
C.干冰升华时,分子内共价键不会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
解析:选C。原子晶体中可能存在非极性共价键,也可能存在极性共价键,如SiO2、SiC等,A不正确;HF晶体中存在氢键,熔点高于HCl晶体,B不正确;干冰升华是物理变化,分子间作用力被破坏,但分子内共价键不断裂,C正确;金属元素和非金属元素形成的化合物不一定是离子化合物,也可能是共价化合物,如AlCl3等,D不正确。
分子晶体和原子晶体熔、沸点比较
1.不同类型的晶体:原子晶体>分子晶体。
2.同一类型的晶体
(1)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常的高。如H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如CO>N2,CH3OH>CH3CH3。
④同分异构体,支链越多,熔、沸点越低。
(2)原子晶体
晶体的熔、沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。
例2
(2011年黄石高二检测)据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167 kJ·mol-1。请回答下列问题。
(1)N60分子组成的晶体为________晶体,其熔、沸点比N2________(填“高”或“低”),原因是________________________________________________________________________
________________________________________________________________________。
(2)1 mol N60分解成N2时吸收或放出的热量是________________________________________________________________________
kJ(已知N≡N键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种)
________________________________________________________________________。
【思路点拨】
(3)由于反应放出大量的热同时生成大量气体,因此N60可用作高能炸药。
【答案】 (1)分子 高 N60、N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
(2)13230 <
(3)N60可作高能炸药
【误区警示】 比较分子晶体熔、沸点高低时,要充分考虑影响分子晶体熔、沸点的各种因素,如相对分子质量对组成和结构都相似的分子晶体熔、沸点的影响,相对分子质量越大,分子间作用力越大,熔、沸点越高;在同分异构体中,支链越多,熔、沸点越低。不要漏了氢键的影响,氢键的存在使得相应的氢化物的熔、沸点比同族元素氢化物的熔、沸点高得多。
变式训练2 下列分子晶体,关于熔、沸点高低叙述中,正确的是( )
A.Cl2>I2
B.SiCl4>CCl4
C.NH3<PH3
D.C(CH3)4>CH3(CH2)3CH3
解析:选B。比较物质熔、沸点,先搞清该物质属于哪一类晶体,再分析决定晶体熔、沸点的因素。A、B选项属于无氢键存在的分子结构相似的情况,相对分子质量大的熔、沸点高;C选项属于有氢键存在但分子结构相似的情况,存在氢键的熔、沸点高;D选项属于相对分子质量相同,但分子结构不同的情况,支链越多的熔、沸点越低。
