山东省临清三中2012高二化学课件:第2章第1节 共价键(人教版选修3)
文档属性
| 名称 | 山东省临清三中2012高二化学课件:第2章第1节 共价键(人教版选修3) |  | |
| 格式 | rar | ||
| 文件大小 | 350.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-24 21:36:10 | ||
图片预览










文档简介
(共34张PPT)
第一节 共价键
学习目标
1.知道共价键的主要类型σ键和π键。
2.能用键能、键长、键角等说明简单分子的某些性质。
3.结合实例说明“等电子原理”的应用。
课堂互动讲练
课前自主学案
知能优化训练
第一节 共价键
课前自主学案
一、共价键
1.概念
原子间通过______________形成的化学键。
共用电子对
3.类型
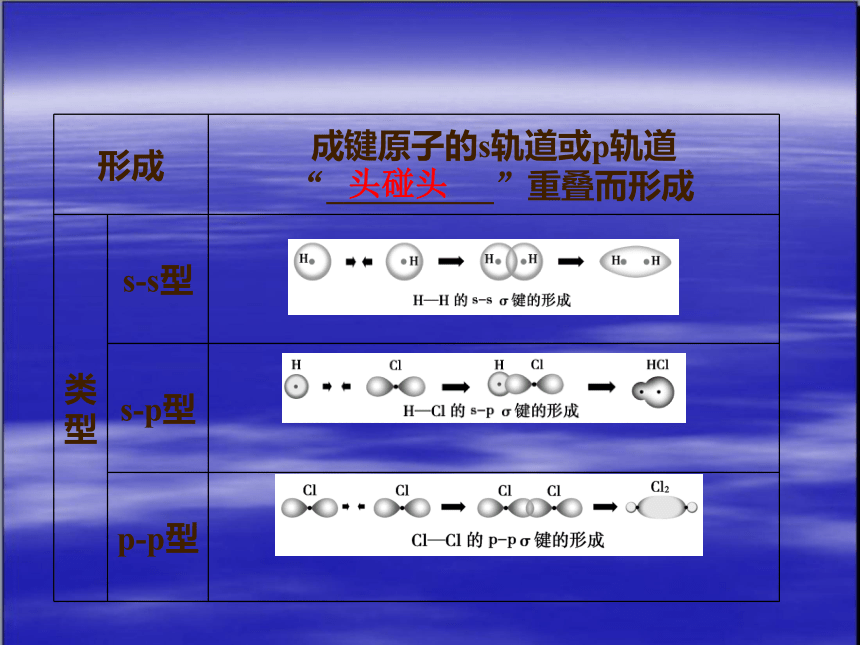
(1)σ键
形成 成键原子的s轨道或p轨道“__________”重叠而形成
类型 s s型
s p型
p p型
头碰头
特征 以形成化学键的两原子核的_______为轴作旋转操作,共价键电子云的图形__________,这种特征称为__________;σ键的强度_______
连线
不变
轴对称
较大
(2)π键
形成 由两个原子的p轨道“___________”重叠形成
p p π键
特征 π键的电子云具有____________性,即每个π键的电子云由两块组成,分别位于由_____________构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为___________;π键_________旋转;不如σ键牢固,较易_________
肩并肩
镜像对称
两原子核
镜像
不能
断裂
思考感悟
1.所有的共价键都有方向性吗?
【提示】 并不是所有的共价键都有方向性,如s s σ键就没有方向性。
二、键参数——键能、键长与键角
概念 作用
键能 ___________原子形成1 mol化学键________的最低能量 键能越大,键越_______,越不易__________
键长 形成共价键的两个原子之间的___________ 键长越短,键能_______,键越________
键角 两个_________之间的夹角 表明共价键有__________,决定分子的___________
气态基态
释放
稳定
被打断
核间距
共价键
越大
稳定
方向性
立体构型
思考感悟
2.试从键长和键能的角度分析卤素氢化物稳定性逐渐减弱的原因。
【提示】 卤素原子从F到I原子半径逐渐增大,分别与H原子形成共价键时,按H-F、H-Cl、H-Br、H-I,键长逐渐增长,键能逐渐减小,故分子的稳定性逐渐减弱。
三、等电子原理
1.等电子原理及等电子体
等电子原理:___________相同、____________相同的分子具有相似的________________,它们的许多性质是相近的。
满足等电子原理的分子称为等电子体。
原子总数
价电子总数
化学键特征
2.等电子体实例
CO和N2具有相同的原子总数和相同的价电子总数,属于等电子体,其性质对比如下:
分子 熔点/℃ 沸点/℃ 在水中的溶解度(室温) 分子解离能/kJ·mol-1 分子的价电子总数
CO -205.05 -191.49 2.3 mL 1075 10
N2 -210.00 -195.81 1.6 mL 946 10
思考感悟
3.根据所学知识和等电子原理,试举出几种等电子体。
【提示】 H2O和H2S,SO2和O3,CO2和CS2,卤素的氢化物。
课堂互动讲练
共价键的特征和类型
1.共价键的特征
(1)饱和性
因为每个原子所能提供的未成对电子的数目是一定的,因此在共价键的形成过程中,一个原子中的一个未成对电子与另一个原子中的一个未成对电子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,所以共价键具有饱和性。
(2)方向性
除s轨道是球形对称的外,其他的原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的愈多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键具有方向性。
2.类型
分类标准 类型
共用电子对数 单键、双键、三键
共用电子对的偏移程度 极性键、非极性键
原子轨道重叠方式 σ键、π键
3.σ键与π键
键类型 σ键 π键
原子轨道重叠方式 沿键轴方向“头碰头”重叠 沿键轴方向“肩并肩”重叠
原子轨道重叠部位 两原子核之间,在键轴处 键轴上方和下方,键轴处为零
原子轨道重叠程度 大 小
键的强度 较大 较小
特别提醒:(1)s轨道与s轨道重叠形成σ键时,电子不是只在两核间运动,而是电子在两核间出现的概率增大。
(2)因s轨道是球形的,故s轨道和s轨道形成σ键时,无方向性。两个s轨道只能形成σ键,不能形成π键。
(3)两个原子间可以只形成σ键,但不能只形成π键。
例1
【解析】 A项S原子的价电子构型是3s23p4,有2个未成对电子,并且分布在相互垂直的3px和3py轨道中,当与两个H原子配对成键时,形成的两个共价键间夹角接近90°,这体现了共价键的方向性,是由轨道的伸展方向决定的。B项N2分子中有三个化学键,其中有一个σ键、两个π键。C项,两个原子形成的共价键,首先有一个σ键,其余为π键。D项,σ键的重叠程度比π键大,故键能σ键大于π键。
【答案】 D
【规律方法】 σ、π键存在的规律
(1)共价单键全部是σ键。
(2)共价双键中,一个是σ键,一个是π键。
(3)共价三键中,一个是σ键,两个是π键。
变式训练1 关于乙醇分子的说法正确的是( )
A.分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.分子中含有1个π键
解析:选C。乙醇的结构式为 共含有8个共价键,其中C—H、C—O、O—H键为极性键,共7个,C—C键为非极性键。由于全为单键,故无π键。
键参数与分子性质
1.一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。
如HF、HCl、HBr、HI中,分子的共用电子对数相同(1对),因F、Cl、Br、I的原子半径依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性HF>HCl>HBr>HI。
2.键长越短,往往键能越大,共价键越稳定。
3.键能与键长是衡量共价键稳定性的参数,键角是描述分子立体构型的参数。一般来说,如果知道分子中的键长和键角,这个分子的立体构型就确定了。如氨分子的H—N—H键角是107°,N—H键的键长是101 pm,就可以断定氨分子是三角锥形分子,如图:
4.F—F键键长短,键能小的解释
氟原子的半径很小,因此其键长短,而由于键长短,两氟原子形成共价键时,原子核之间的距离很近,排斥力很大,因此键能不大,F2的稳定性差,很容易与其他物质反应。
特别提醒:(1)通过键长、键角可以判断分子的立体构型。
(2)键长不是成键两原子半径的和,而是小于其半径的和。
5.键能与化学反应的能量变化关系
(1)化学反应过程中,旧键断裂吸收的总能量大于新键形成所放出的总能量,则反应为吸热反应,吸热反应使反应体系的能量增加,故规定反应的热量变化ΔH为“+”。
化学反应过程中,旧键断裂所吸收的总能量小于新键形成放出的总能量,则反应为放热反应,放热反应使反应体系的能量降低,故规定反应的热量变化ΔH为“-”。
(2)利用键能计算反应的热量变化(ΔH)
ΔH=反应物的键能总和-生成物的键能总和。
例2
从实验测得不同物质中氧—氧键之间的键长和键能数据如下表,其中X、Y的键能数据尚未测定,但可根据规律推导键能的大小顺序为W>Z>Y>X。该规律是( )
A.成键时电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
【思路点拨】 解答本题要注意以下两点:
(1)键长越长键能越小。
(2)共价键的本质:自旋方向相反的未成对电子形成共用电子对时,原子轨道发生重叠。
【答案】 B
【误区警示】 (1)键能与键长反映键的强弱程度,键长与键角用来描述分子的立体构型。
(2)对键能的概念把握不准,容易忽略键能概念中的前提条件——气态基态原子。
变式训练2 (2011年黄冈高二检测)能够用键能的大小作为主要依据来解释的是( )
A.常温常压下氯气呈气态而溴单质呈液态
B.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C.稀有气体一般难发生化学反应
D.空气中氮气的化学性质比氧气稳定
解析:选D。共价分子构成物质的状态与分子内共价键的键能无关;物质的挥发性与分子内键能的大小无关;稀有气体是单原子分子,无化学键,难发生化学反应的原因是它们的价电子已形成稳定结构;氮气比氧气稳定是由于N2分子中形成共价键的键能(946 kJ/mol)比O2分子中共价键键能(497.3 kJ/mol)大,在化学反应中更难于断裂。
第一节 共价键
学习目标
1.知道共价键的主要类型σ键和π键。
2.能用键能、键长、键角等说明简单分子的某些性质。
3.结合实例说明“等电子原理”的应用。
课堂互动讲练
课前自主学案
知能优化训练
第一节 共价键
课前自主学案
一、共价键
1.概念
原子间通过______________形成的化学键。
共用电子对
3.类型
(1)σ键
形成 成键原子的s轨道或p轨道“__________”重叠而形成
类型 s s型
s p型
p p型
头碰头
特征 以形成化学键的两原子核的_______为轴作旋转操作,共价键电子云的图形__________,这种特征称为__________;σ键的强度_______
连线
不变
轴对称
较大
(2)π键
形成 由两个原子的p轨道“___________”重叠形成
p p π键
特征 π键的电子云具有____________性,即每个π键的电子云由两块组成,分别位于由_____________构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为___________;π键_________旋转;不如σ键牢固,较易_________
肩并肩
镜像对称
两原子核
镜像
不能
断裂
思考感悟
1.所有的共价键都有方向性吗?
【提示】 并不是所有的共价键都有方向性,如s s σ键就没有方向性。
二、键参数——键能、键长与键角
概念 作用
键能 ___________原子形成1 mol化学键________的最低能量 键能越大,键越_______,越不易__________
键长 形成共价键的两个原子之间的___________ 键长越短,键能_______,键越________
键角 两个_________之间的夹角 表明共价键有__________,决定分子的___________
气态基态
释放
稳定
被打断
核间距
共价键
越大
稳定
方向性
立体构型
思考感悟
2.试从键长和键能的角度分析卤素氢化物稳定性逐渐减弱的原因。
【提示】 卤素原子从F到I原子半径逐渐增大,分别与H原子形成共价键时,按H-F、H-Cl、H-Br、H-I,键长逐渐增长,键能逐渐减小,故分子的稳定性逐渐减弱。
三、等电子原理
1.等电子原理及等电子体
等电子原理:___________相同、____________相同的分子具有相似的________________,它们的许多性质是相近的。
满足等电子原理的分子称为等电子体。
原子总数
价电子总数
化学键特征
2.等电子体实例
CO和N2具有相同的原子总数和相同的价电子总数,属于等电子体,其性质对比如下:
分子 熔点/℃ 沸点/℃ 在水中的溶解度(室温) 分子解离能/kJ·mol-1 分子的价电子总数
CO -205.05 -191.49 2.3 mL 1075 10
N2 -210.00 -195.81 1.6 mL 946 10
思考感悟
3.根据所学知识和等电子原理,试举出几种等电子体。
【提示】 H2O和H2S,SO2和O3,CO2和CS2,卤素的氢化物。
课堂互动讲练
共价键的特征和类型
1.共价键的特征
(1)饱和性
因为每个原子所能提供的未成对电子的数目是一定的,因此在共价键的形成过程中,一个原子中的一个未成对电子与另一个原子中的一个未成对电子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,所以共价键具有饱和性。
(2)方向性
除s轨道是球形对称的外,其他的原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的愈多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键具有方向性。
2.类型
分类标准 类型
共用电子对数 单键、双键、三键
共用电子对的偏移程度 极性键、非极性键
原子轨道重叠方式 σ键、π键
3.σ键与π键
键类型 σ键 π键
原子轨道重叠方式 沿键轴方向“头碰头”重叠 沿键轴方向“肩并肩”重叠
原子轨道重叠部位 两原子核之间,在键轴处 键轴上方和下方,键轴处为零
原子轨道重叠程度 大 小
键的强度 较大 较小
特别提醒:(1)s轨道与s轨道重叠形成σ键时,电子不是只在两核间运动,而是电子在两核间出现的概率增大。
(2)因s轨道是球形的,故s轨道和s轨道形成σ键时,无方向性。两个s轨道只能形成σ键,不能形成π键。
(3)两个原子间可以只形成σ键,但不能只形成π键。
例1
【解析】 A项S原子的价电子构型是3s23p4,有2个未成对电子,并且分布在相互垂直的3px和3py轨道中,当与两个H原子配对成键时,形成的两个共价键间夹角接近90°,这体现了共价键的方向性,是由轨道的伸展方向决定的。B项N2分子中有三个化学键,其中有一个σ键、两个π键。C项,两个原子形成的共价键,首先有一个σ键,其余为π键。D项,σ键的重叠程度比π键大,故键能σ键大于π键。
【答案】 D
【规律方法】 σ、π键存在的规律
(1)共价单键全部是σ键。
(2)共价双键中,一个是σ键,一个是π键。
(3)共价三键中,一个是σ键,两个是π键。
变式训练1 关于乙醇分子的说法正确的是( )
A.分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.分子中含有1个π键
解析:选C。乙醇的结构式为 共含有8个共价键,其中C—H、C—O、O—H键为极性键,共7个,C—C键为非极性键。由于全为单键,故无π键。
键参数与分子性质
1.一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。
如HF、HCl、HBr、HI中,分子的共用电子对数相同(1对),因F、Cl、Br、I的原子半径依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性HF>HCl>HBr>HI。
2.键长越短,往往键能越大,共价键越稳定。
3.键能与键长是衡量共价键稳定性的参数,键角是描述分子立体构型的参数。一般来说,如果知道分子中的键长和键角,这个分子的立体构型就确定了。如氨分子的H—N—H键角是107°,N—H键的键长是101 pm,就可以断定氨分子是三角锥形分子,如图:
4.F—F键键长短,键能小的解释
氟原子的半径很小,因此其键长短,而由于键长短,两氟原子形成共价键时,原子核之间的距离很近,排斥力很大,因此键能不大,F2的稳定性差,很容易与其他物质反应。
特别提醒:(1)通过键长、键角可以判断分子的立体构型。
(2)键长不是成键两原子半径的和,而是小于其半径的和。
5.键能与化学反应的能量变化关系
(1)化学反应过程中,旧键断裂吸收的总能量大于新键形成所放出的总能量,则反应为吸热反应,吸热反应使反应体系的能量增加,故规定反应的热量变化ΔH为“+”。
化学反应过程中,旧键断裂所吸收的总能量小于新键形成放出的总能量,则反应为放热反应,放热反应使反应体系的能量降低,故规定反应的热量变化ΔH为“-”。
(2)利用键能计算反应的热量变化(ΔH)
ΔH=反应物的键能总和-生成物的键能总和。
例2
从实验测得不同物质中氧—氧键之间的键长和键能数据如下表,其中X、Y的键能数据尚未测定,但可根据规律推导键能的大小顺序为W>Z>Y>X。该规律是( )
A.成键时电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
【思路点拨】 解答本题要注意以下两点:
(1)键长越长键能越小。
(2)共价键的本质:自旋方向相反的未成对电子形成共用电子对时,原子轨道发生重叠。
【答案】 B
【误区警示】 (1)键能与键长反映键的强弱程度,键长与键角用来描述分子的立体构型。
(2)对键能的概念把握不准,容易忽略键能概念中的前提条件——气态基态原子。
变式训练2 (2011年黄冈高二检测)能够用键能的大小作为主要依据来解释的是( )
A.常温常压下氯气呈气态而溴单质呈液态
B.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C.稀有气体一般难发生化学反应
D.空气中氮气的化学性质比氧气稳定
解析:选D。共价分子构成物质的状态与分子内共价键的键能无关;物质的挥发性与分子内键能的大小无关;稀有气体是单原子分子,无化学键,难发生化学反应的原因是它们的价电子已形成稳定结构;氮气比氧气稳定是由于N2分子中形成共价键的键能(946 kJ/mol)比O2分子中共价键键能(497.3 kJ/mol)大,在化学反应中更难于断裂。
