人教版九年级化学下册 第十一单元 课题1 生活中常见的盐 第1课时 常见的盐(共24张PPT)
文档属性
| 名称 | 人教版九年级化学下册 第十一单元 课题1 生活中常见的盐 第1课时 常见的盐(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 11.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-20 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第十一单元 盐
化肥
课题1 生活中常见的盐
第1课时 常见的盐
铃声伴读
酸的化学性质:(方程式不读)
1、酸使紫色石蕊溶液变红
;
不能使无色酚酞变色
2、酸+活泼金属=
盐
+氢气(
属于置换反应)
Mg+2HCl=MgCl2+H2
↑
3、酸+金属氧化物=
盐
+
水(
属于复分解反应)
Fe2O3+6HCl=2FeCl3+3H2O
4、酸+某些盐=新盐+新酸(
属于复分解反应)
2HCl+CaCO3
=CaCl2+H2O+CO2
↑
碱的化学性质:
1、碱能使紫色石蕊试液变蓝色,无色酚酞变红色。
2、碱+非金属氧化物=
盐
+
水
(不属于复分解反应
)
2NaOH+CO2=Na2CO3+H2O
写出下列盐类物质的化学式:
盐:金属离子(或NH4+)和酸根离子
硫酸盐:
盐酸盐:
硝酸盐:
碳酸盐:
碳酸氢盐:
硫酸钠
氯化钙
硝酸钾
碳酸钡
碳酸氢钠
钾盐:
铵盐:
氯化钾
高锰酸钾
氯酸钾
氯化铵
硫酸铵
Na2SO4
CaCl2
KNO3
BaCO3
NaHCO3
KCl
KMnO4
KClO3
NH4Cl
(NH4)2SO4
盐的分类和读法:
一、根据所含的酸根或金属离子
硫酸盐:Na2SO4
CaSO4
BaSO4
Fe2(SO4)3
碳酸盐:Na2CO3
CaCO3
MgCO3
BaCO3
硝酸盐:KNO3
AgNO3
Mg(NO3)2
Fe(NO3)2
盐酸盐(氯化物):NaCl
CaCl2
FeCl2
AlCl3
铵盐:NH4NO3
(NH4)2CO3
(NH4)2SO4
钠盐:NaCl
NaNO3
Na2SO4
钾盐:KCl
K2CO3……
其它盐:KMnO4
K2MnO4
KClO3
NaClO
NaNO2
二、根据解离的情况
1、正盐:Na2CO3
KCl
CaCl2
NH4NO3
Mg(NO3)2
2、酸式盐:NaHCO3
KHSO4
NH4HCO3
KH2PO4
3、碱式盐:Cu2(OH)2CO3
碱式碳酸铜
1.了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙等的俗称和用途;
2.了解碳酸盐的某些化学性质,掌握碳酸根离子的检验方法。
用钡餐
(BaSO4)
观察肠内情况
五水硫酸铜晶体CuSO4.
5H2O
氯化钠
NaCl
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
高锰酸钾
KMnO4
大理石中含
CaCO3
知识点一 氯化钠
1.氯化钠是重要的调味品(食盐的主要成分是NaCl),是人的正
常生理活动所必不可少的。
(1)钠离子对维持细胞内外正常的____________和促进细胞内外
____________起主要作用;
(2)氯离子是胃液中的主要成分,
具有促生盐酸、____________
和____________的作用。
水分分布
物质交换
帮助消化
增进食欲
巧学精练
阅读课本第72、73页,了解氯化钠的作用、用途和在自然界中的分布,填写有关内容:
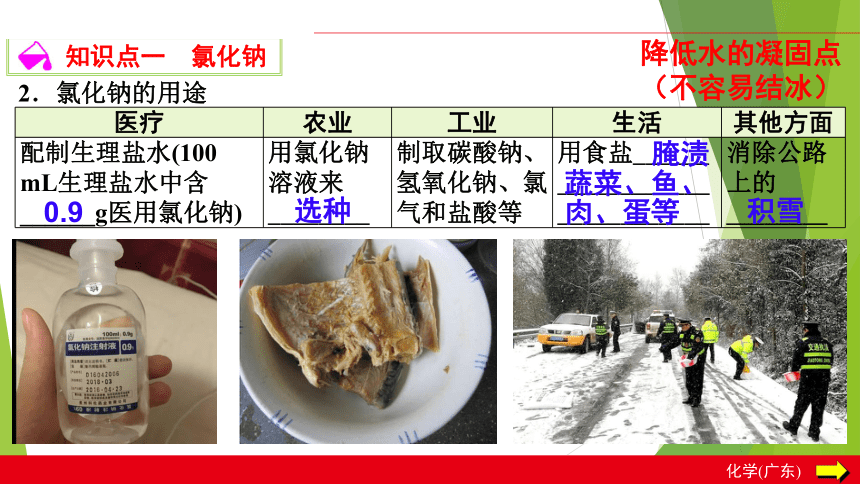
2.氯化钠的用途
医疗
农业
工业
生活
其他方面
配制生理盐水(100
mL生理盐水中含______g医用氯化钠)
用氯化钠溶液来________
制取碳酸钠、氢氧化钠、氯气和盐酸等
用食盐______
____________
____________
消除公路上的________
知识点一 氯化钠
0.9
选种
腌渍
蔬菜、鱼、
肉、蛋等
积雪
降低水的凝固点(不容易结冰)
3.氯化钠在自然界中的分布:主要存在于________里,盐湖、盐井和盐矿
也是氯化钠的来源。
知识点一 氯化钠
海水
教师点拨 亚硝酸钠(NaNO2)是一种工业用盐,有毒,有咸味,外观与食
盐相似,人若误食会引起中毒。
知识点一 氯化钠
NaNO2是工业用盐,它是一种白色不透明晶体,形状很像食盐。
NaNO2不仅是致癌物质,而且摄入0.2~0.5
g即可引起食物中毒,3
g可致死。而NaNO2是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
知识点二 碳酸钠、碳酸氢钠和碳酸钙
阅读课本第73页,了解碳酸钠、碳酸氢钠和碳酸钙的俗称(主要成分)和用途,填写下表:
名称
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗称
(主要成分)
是大理石、石灰石的主要成分
Na2CO3
NaHCO3
CaCO3
纯碱、苏打
小苏打
名称
碳酸钠
碳酸氢钠
碳酸钙
主要用途
用于______________
__________________的生产等
焙制糕点所用的__________的主要成分之一,医疗上用于治疗________过多症
大理石作____________,
碳酸钙可用作__________
知识点二 碳酸钠、碳酸氢钠和碳酸钙
玻璃、造纸、纺织和洗涤剂
发酵粉
胃酸
建筑材料
补钙剂
发酵粉
大理石地砖
大理石华表
碳酸钙补钙剂
教师点拨 食盐水pH______7,呈中性;
Na2CO3、NaHCO3溶液pH______7,呈碱性。
知识点二 碳酸钠、碳酸氢钠和碳酸钙
=
>
苏打水
生理盐水
0.9%氯化钠溶液
1.下列物质的名称、俗名与物质类别对应正确的是( )
A.氧化钙——消石灰——氧化物
B.碳酸钠——纯碱——碱
C.碳酸氢钠——苏打——盐
D.氢氧化钙——熟石灰——碱
知识点二 碳酸钠、碳酸氢钠和碳酸钙
2.性质决定用途。下列关于物质用途的说法正确的是( )
A.石灰石可用作补钙剂
B.亚硝酸钠可用作调味品
C.烧碱可用于中和过多的胃酸
D.氯化钠可用于消除公路上的积雪
D
D
知识点三 碳酸钠、碳酸氢钠的化学性质
观察课本第74页实验11-1和实验11-2,填写下表:
物质
Na2CO3
NaHCO3
与盐酸反应
现象
化学方程式
与澄清
石灰水反应
现象
化学方程式
产生大量气泡,固体快速溶解
产生大量气泡,固体快速溶解
Na2CO3
+
2HCl
═
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
═
NaCl
+
H2O
+
CO2↑
【问题讨论】
(1)在实验室是否适合用碳酸钠、碳酸氢钠与盐酸反应制取CO2?为什么?
_______________________________________________。
(2)根据碳酸钙、碳酸钠等与盐酸的反应,总结如何检验碳酸盐(含CO32-的盐)?
选用的试剂:______________________。
操作方法:_____________________________________________________
_____________________________________________________
__________________________________。
不适合。因为反应速率太快,不易控制
稀盐酸和澄清石灰水
取样,向待测样品中加入适量的稀盐酸,将产生的气体通入澄清石灰水中,如果出现白色浑浊,则证明待测样品中含有CO32-
知识点三 碳酸钠、碳酸氢钠的化学性质
观察课本第74页实验11-1和实验11-2,填写下表:
物质
Na2CO3
NaHCO3
与盐酸反应
现象
化学方程式
与澄清
石灰水反应
现象
化学方程式
产生大量气泡,固体快速溶解
产生大量气泡,固体快速溶解
产生白色沉淀
Na2CO3
+
2HCl
═
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
═
NaCl
+
H2O
+
CO2↑
Ca(OH)2
+
Na2CO3
═
CaCO3↓+
2NaOH
常用于制取烧碱
(过滤,蒸发结晶)
3.下列鉴别NaOH和Ca(OH)2两种碱溶液的方法中,
不可行的是( )
A.通入CO2
B.滴加稀盐酸
C.滴加Na2CO3溶液
D.滴加K2CO3溶液
B
自我提升
1.下列关于盐的说法正确的是( )
A.盐都能食用,故称为食盐
B.盐是一类物质的总称
C.盐就是食盐,易溶于水
D.盐都有咸味,都是白色晶体
2.下列有关NaCl的说法错误的是( )
A.是食盐的主要成分
B.其水溶液呈中性
C.可用于腌渍蔬菜
D.由氯化钠离子构成
B
D
3.如图为××泡打粉的标签,下列说法错误的是( )
A.碳酸氢钠俗称小苏打
B.泡打粉可以随意放置
C.加入泡打粉制作的蛋糕更松软
D.泡打粉属于无毒的食品添加剂
4.下面是小明设计的鉴别Na2CO3和NaOH溶液的几种方法,其中正确的是( )
①滴加稀盐酸 ②通入CO2 ③滴加酞酞溶液 ④滴加澄清石灰水
A.①③
B.②③
C.①④
D.①③④
B
C
5.欲证明生石灰中含有未烧透的石灰石,最简单的方法是( )
A.加热
B.滴加稀盐酸
C.加水溶解
D.加入Na2CO3溶液
6.工业上常用石灰石、水、纯碱制取烧碱,请用化学方程式表示上述制备
过程:
(1)__________________________________;
(2)__________________________________;
(3)____________________________________________。
B
CaCO3
═══
CaO
+
CO2↑
高温
CaO
+
H2O
═
Ca(OH)2
Ca(OH)2
+
Na2CO3
═
CaCO3↓+
2NaOH
教师点拨 (1)如何除去CO2中的HCl气体?
方法:如右图,先通过饱和NaHCO3溶液除去
HCl,再通过浓H2SO4除去水蒸气。
反应的化学方程式为:
________________________________________。
注:最后得到的CO2气体质量______原CO2气体质量(填“>”“=”
或“<”)。
>
NaHCO3+HCl═NaCl+H2O+CO2↑
(2)我国化工专家侯德榜发明了联合制碱法
(又称侯氏制碱法),
其生产过程
中发生的反应主要有:
①NH3+CO2+H2O
═
NH4HCO3;
②NH4HCO3+NaCl
═
NaHCO3↓+NH4Cl;
③2NaHCO3
Na2CO3+H2O+CO2↑,
由此可见,侯氏制碱法制得的“碱”是______________。
纯碱(Na2CO3)
第十一单元 盐
化肥
课题1 生活中常见的盐
第1课时 常见的盐
铃声伴读
酸的化学性质:(方程式不读)
1、酸使紫色石蕊溶液变红
;
不能使无色酚酞变色
2、酸+活泼金属=
盐
+氢气(
属于置换反应)
Mg+2HCl=MgCl2+H2
↑
3、酸+金属氧化物=
盐
+
水(
属于复分解反应)
Fe2O3+6HCl=2FeCl3+3H2O
4、酸+某些盐=新盐+新酸(
属于复分解反应)
2HCl+CaCO3
=CaCl2+H2O+CO2
↑
碱的化学性质:
1、碱能使紫色石蕊试液变蓝色,无色酚酞变红色。
2、碱+非金属氧化物=
盐
+
水
(不属于复分解反应
)
2NaOH+CO2=Na2CO3+H2O
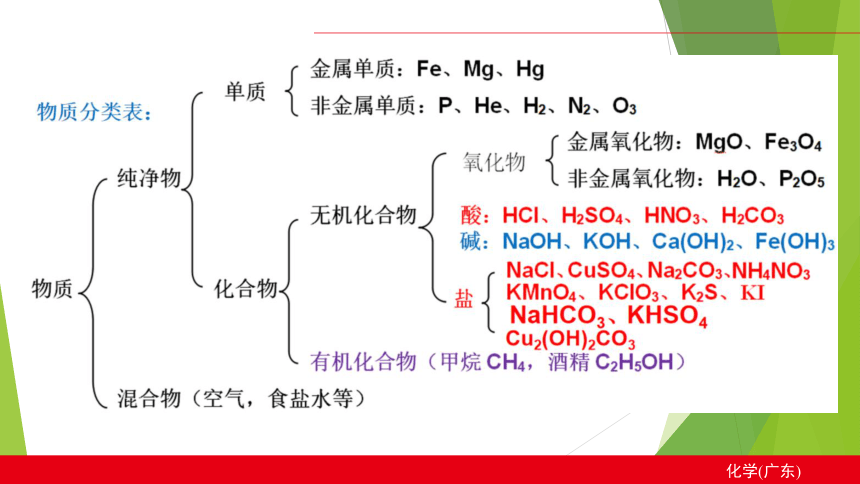
写出下列盐类物质的化学式:
盐:金属离子(或NH4+)和酸根离子
硫酸盐:
盐酸盐:
硝酸盐:
碳酸盐:
碳酸氢盐:
硫酸钠
氯化钙
硝酸钾
碳酸钡
碳酸氢钠
钾盐:
铵盐:
氯化钾
高锰酸钾
氯酸钾
氯化铵
硫酸铵
Na2SO4
CaCl2
KNO3
BaCO3
NaHCO3
KCl
KMnO4
KClO3
NH4Cl
(NH4)2SO4
盐的分类和读法:
一、根据所含的酸根或金属离子
硫酸盐:Na2SO4
CaSO4
BaSO4
Fe2(SO4)3
碳酸盐:Na2CO3
CaCO3
MgCO3
BaCO3
硝酸盐:KNO3
AgNO3
Mg(NO3)2
Fe(NO3)2
盐酸盐(氯化物):NaCl
CaCl2
FeCl2
AlCl3
铵盐:NH4NO3
(NH4)2CO3
(NH4)2SO4
钠盐:NaCl
NaNO3
Na2SO4
钾盐:KCl
K2CO3……
其它盐:KMnO4
K2MnO4
KClO3
NaClO
NaNO2
二、根据解离的情况
1、正盐:Na2CO3
KCl
CaCl2
NH4NO3
Mg(NO3)2
2、酸式盐:NaHCO3
KHSO4
NH4HCO3
KH2PO4
3、碱式盐:Cu2(OH)2CO3
碱式碳酸铜
1.了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙等的俗称和用途;
2.了解碳酸盐的某些化学性质,掌握碳酸根离子的检验方法。
用钡餐
(BaSO4)
观察肠内情况
五水硫酸铜晶体CuSO4.
5H2O
氯化钠
NaCl
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
高锰酸钾
KMnO4
大理石中含
CaCO3
知识点一 氯化钠
1.氯化钠是重要的调味品(食盐的主要成分是NaCl),是人的正
常生理活动所必不可少的。
(1)钠离子对维持细胞内外正常的____________和促进细胞内外
____________起主要作用;
(2)氯离子是胃液中的主要成分,
具有促生盐酸、____________
和____________的作用。
水分分布
物质交换
帮助消化
增进食欲
巧学精练
阅读课本第72、73页,了解氯化钠的作用、用途和在自然界中的分布,填写有关内容:
2.氯化钠的用途
医疗
农业
工业
生活
其他方面
配制生理盐水(100
mL生理盐水中含______g医用氯化钠)
用氯化钠溶液来________
制取碳酸钠、氢氧化钠、氯气和盐酸等
用食盐______
____________
____________
消除公路上的________
知识点一 氯化钠
0.9
选种
腌渍
蔬菜、鱼、
肉、蛋等
积雪
降低水的凝固点(不容易结冰)
3.氯化钠在自然界中的分布:主要存在于________里,盐湖、盐井和盐矿
也是氯化钠的来源。
知识点一 氯化钠
海水
教师点拨 亚硝酸钠(NaNO2)是一种工业用盐,有毒,有咸味,外观与食
盐相似,人若误食会引起中毒。
知识点一 氯化钠
NaNO2是工业用盐,它是一种白色不透明晶体,形状很像食盐。
NaNO2不仅是致癌物质,而且摄入0.2~0.5
g即可引起食物中毒,3
g可致死。而NaNO2是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
知识点二 碳酸钠、碳酸氢钠和碳酸钙
阅读课本第73页,了解碳酸钠、碳酸氢钠和碳酸钙的俗称(主要成分)和用途,填写下表:
名称
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗称
(主要成分)
是大理石、石灰石的主要成分
Na2CO3
NaHCO3
CaCO3
纯碱、苏打
小苏打
名称
碳酸钠
碳酸氢钠
碳酸钙
主要用途
用于______________
__________________的生产等
焙制糕点所用的__________的主要成分之一,医疗上用于治疗________过多症
大理石作____________,
碳酸钙可用作__________
知识点二 碳酸钠、碳酸氢钠和碳酸钙
玻璃、造纸、纺织和洗涤剂
发酵粉
胃酸
建筑材料
补钙剂
发酵粉
大理石地砖
大理石华表
碳酸钙补钙剂
教师点拨 食盐水pH______7,呈中性;
Na2CO3、NaHCO3溶液pH______7,呈碱性。
知识点二 碳酸钠、碳酸氢钠和碳酸钙
=
>
苏打水
生理盐水
0.9%氯化钠溶液
1.下列物质的名称、俗名与物质类别对应正确的是( )
A.氧化钙——消石灰——氧化物
B.碳酸钠——纯碱——碱
C.碳酸氢钠——苏打——盐
D.氢氧化钙——熟石灰——碱
知识点二 碳酸钠、碳酸氢钠和碳酸钙
2.性质决定用途。下列关于物质用途的说法正确的是( )
A.石灰石可用作补钙剂
B.亚硝酸钠可用作调味品
C.烧碱可用于中和过多的胃酸
D.氯化钠可用于消除公路上的积雪
D
D
知识点三 碳酸钠、碳酸氢钠的化学性质
观察课本第74页实验11-1和实验11-2,填写下表:
物质
Na2CO3
NaHCO3
与盐酸反应
现象
化学方程式
与澄清
石灰水反应
现象
化学方程式
产生大量气泡,固体快速溶解
产生大量气泡,固体快速溶解
Na2CO3
+
2HCl
═
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
═
NaCl
+
H2O
+
CO2↑
【问题讨论】
(1)在实验室是否适合用碳酸钠、碳酸氢钠与盐酸反应制取CO2?为什么?
_______________________________________________。
(2)根据碳酸钙、碳酸钠等与盐酸的反应,总结如何检验碳酸盐(含CO32-的盐)?
选用的试剂:______________________。
操作方法:_____________________________________________________
_____________________________________________________
__________________________________。
不适合。因为反应速率太快,不易控制
稀盐酸和澄清石灰水
取样,向待测样品中加入适量的稀盐酸,将产生的气体通入澄清石灰水中,如果出现白色浑浊,则证明待测样品中含有CO32-
知识点三 碳酸钠、碳酸氢钠的化学性质
观察课本第74页实验11-1和实验11-2,填写下表:
物质
Na2CO3
NaHCO3
与盐酸反应
现象
化学方程式
与澄清
石灰水反应
现象
化学方程式
产生大量气泡,固体快速溶解
产生大量气泡,固体快速溶解
产生白色沉淀
Na2CO3
+
2HCl
═
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
═
NaCl
+
H2O
+
CO2↑
Ca(OH)2
+
Na2CO3
═
CaCO3↓+
2NaOH
常用于制取烧碱
(过滤,蒸发结晶)
3.下列鉴别NaOH和Ca(OH)2两种碱溶液的方法中,
不可行的是( )
A.通入CO2
B.滴加稀盐酸
C.滴加Na2CO3溶液
D.滴加K2CO3溶液
B
自我提升
1.下列关于盐的说法正确的是( )
A.盐都能食用,故称为食盐
B.盐是一类物质的总称
C.盐就是食盐,易溶于水
D.盐都有咸味,都是白色晶体
2.下列有关NaCl的说法错误的是( )
A.是食盐的主要成分
B.其水溶液呈中性
C.可用于腌渍蔬菜
D.由氯化钠离子构成
B
D
3.如图为××泡打粉的标签,下列说法错误的是( )
A.碳酸氢钠俗称小苏打
B.泡打粉可以随意放置
C.加入泡打粉制作的蛋糕更松软
D.泡打粉属于无毒的食品添加剂
4.下面是小明设计的鉴别Na2CO3和NaOH溶液的几种方法,其中正确的是( )
①滴加稀盐酸 ②通入CO2 ③滴加酞酞溶液 ④滴加澄清石灰水
A.①③
B.②③
C.①④
D.①③④
B
C
5.欲证明生石灰中含有未烧透的石灰石,最简单的方法是( )
A.加热
B.滴加稀盐酸
C.加水溶解
D.加入Na2CO3溶液
6.工业上常用石灰石、水、纯碱制取烧碱,请用化学方程式表示上述制备
过程:
(1)__________________________________;
(2)__________________________________;
(3)____________________________________________。
B
CaCO3
═══
CaO
+
CO2↑
高温
CaO
+
H2O
═
Ca(OH)2
Ca(OH)2
+
Na2CO3
═
CaCO3↓+
2NaOH
教师点拨 (1)如何除去CO2中的HCl气体?
方法:如右图,先通过饱和NaHCO3溶液除去
HCl,再通过浓H2SO4除去水蒸气。
反应的化学方程式为:
________________________________________。
注:最后得到的CO2气体质量______原CO2气体质量(填“>”“=”
或“<”)。
>
NaHCO3+HCl═NaCl+H2O+CO2↑
(2)我国化工专家侯德榜发明了联合制碱法
(又称侯氏制碱法),
其生产过程
中发生的反应主要有:
①NH3+CO2+H2O
═
NH4HCO3;
②NH4HCO3+NaCl
═
NaHCO3↓+NH4Cl;
③2NaHCO3
Na2CO3+H2O+CO2↑,
由此可见,侯氏制碱法制得的“碱”是______________。
纯碱(Na2CO3)
同课章节目录
