河北省秦皇岛第一高中2020-2021学年高二下学期开学考试化学试卷 Word版含答案
文档属性
| 名称 | 河北省秦皇岛第一高中2020-2021学年高二下学期开学考试化学试卷 Word版含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 384.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-20 00:00:00 | ||
图片预览



文档简介
河北省秦皇岛第一高中2020-2021学年高二下学期开学考试化学试卷
说明:1、考试时间75分钟,满分100分。
将卷Ⅰ答案用2B铅笔涂在答题卡上,卷Ⅱ用黑色字迹的签字笔答在试卷上。
可能用到的相对分子质量:H 1 Li 7 C 12 N 14 O 16 P 31 K 39 Fe 56 Cu 64 Br 80
单项选择题(本题有10小题,每题2分,共20分。每小题只有一个正确答案)
1.下列说法不正确的是( )
A.葡萄糖和果糖均为单糖,二者互为同分异构体
B.“天宫二号”使用的碳纤维是一种新型有机高分子材料
C.油脂在碱性环境下的水解反应为皂化反应
D.丝绸的主要成分是蛋白质,属于天然高分子化合物
2.2020年春,新型冠状病毒肆虐全球,疫情出现以来,一系列举措体现了中国力量。下列有关说法错误的是( )
A.新型冠状病毒主要由C、H、O、N、S等元素组成,常用质量分数75%的医用酒精杀灭新型冠状病毒
B.N95型口罩的核心材料是聚丙烯,属于有机高分子材料
C.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
D.N95口罩烘烤后不能再继续使用,必须更换
3.下列有关叙述不正确的是( )
A.“中华有为”华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4﹣2e﹣+2H2O=PbO2+4H++SO42-
C.珠港澳大桥桥底镶嵌锌块,锌作负极,以防大桥被腐蚀
D.精炼铜工业中,当阳极通过的电子数为2NA,阴极析出的铜为1mol
4.下列说法正确的是( )
①正戊烷分子中所有的碳原子均在一条直线上
②乙烯和甲烷可用溴的四氯化碳溶液鉴别
③石油是混合物,其分馏产品汽油为纯净物
④和互为同分异构体,和是同一种物质
⑤甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
⑥甲苯分子中共平面的原子最多有13个
A.②⑤⑥ B.②③⑥ C.②③④⑤ D.①②⑥
5.室温时下列有关说法正确的是( )
A.浓度均为0.1mol?L﹣1的NH3?H2O和NH4Cl的混合溶液pH为10,
则c(NH4+)+c(H+)>c(NH3?H2O)+c(OH﹣)
B.0.2 mol?L﹣1CH3COOH溶液与0.1 mol?L﹣1NaOH溶液等体积混合后的溶液中:
c(CH3COO﹣)+c(OH﹣)=c(CH3COOH)+c(H+)
C.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液,其中的c(Na+):①<②<③
D.已知Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12,向浓度均为0.01mol?L﹣1的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,Ag2CrO4沉淀先析出
6.分子式为C5H9ClO2,且能与NaHCO3溶液反应放出气体的有机物共有( )
A.10种 B.11种 C.12种 D.13种
7.蛟龙号载人潜水器由我国自行设计、自主集成研制,是目前世界上下潜能力最深的作业型载人潜水器。给某潜水器提供动力的电池如图所示。下列有关说法正确的是( )
A.Zn电极发生了还原反应
B.电池中的Cl﹣向Pt电极移动
C.Pt电极反应式为H2O2+2e﹣=2OH﹣
D.电子从Zn电极沿导线流向Pt电极,再经溶液回到Zn电极
8.t℃时,向20.00mL 0.1 mol?L﹣1 H2X(H2X为二元弱酸)溶液中滴入0.1mol?L﹣1NaOH溶液,溶液中由水电离出的c水(OH﹣)的负对数[﹣lgc水(OH﹣)]与所加NaOH溶液体积的关系如图所示,下列说法中不正确的是( )
A.水的电离程度:P>N=Q>M,且a=7
B.图中M、P、Q三点对应溶液中c(HX-)/c(X2-)不相等
C.M点溶液中:c(Na+)>c(HX﹣)>c(H2X)
D.P点溶液中c(OH﹣)=c(H+)+c(HX﹣)+2c(H2X)
9.用微生物燃料电池作电源进行模拟消除酸性工业废水中的重铬酸根离子(Cr2O72﹣)的示意图如图所示。反应一段时间后,在装置②中得到Fe(OH)3和Cr(OH)3两种沉淀。下列说法错误的是( )
A.装置①中,a极的电极反应为:HS﹣+4H2O﹣8e﹣═SO42﹣+9H+
B.向装置②中加入适量Na2SO4晶体,其主要作用是增强溶液的导电性
C.装置①中,b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)相等
D.当装置①中有0.6mol H+通过质子交换膜时,装置②中产生0.4mol沉淀
10.已知两个醛分子在 NaOH 溶液作用下可以发生加成反应,生成羟基醛:
(醛基相连的碳上的碳氢单键与另一分子的醛基加成),如果将甲醛、乙醛、丙醛在 NaOH 溶液中发生反应,最多可以形成羟基醛的种类是( )
A.6 种 B.7 种 C.8 种 D.9 种
不定项选择题(本题有5小题,每题4分,共20分。每题有1-2个选项符合题意,全选对得4分,少选得2分,错选不得分)
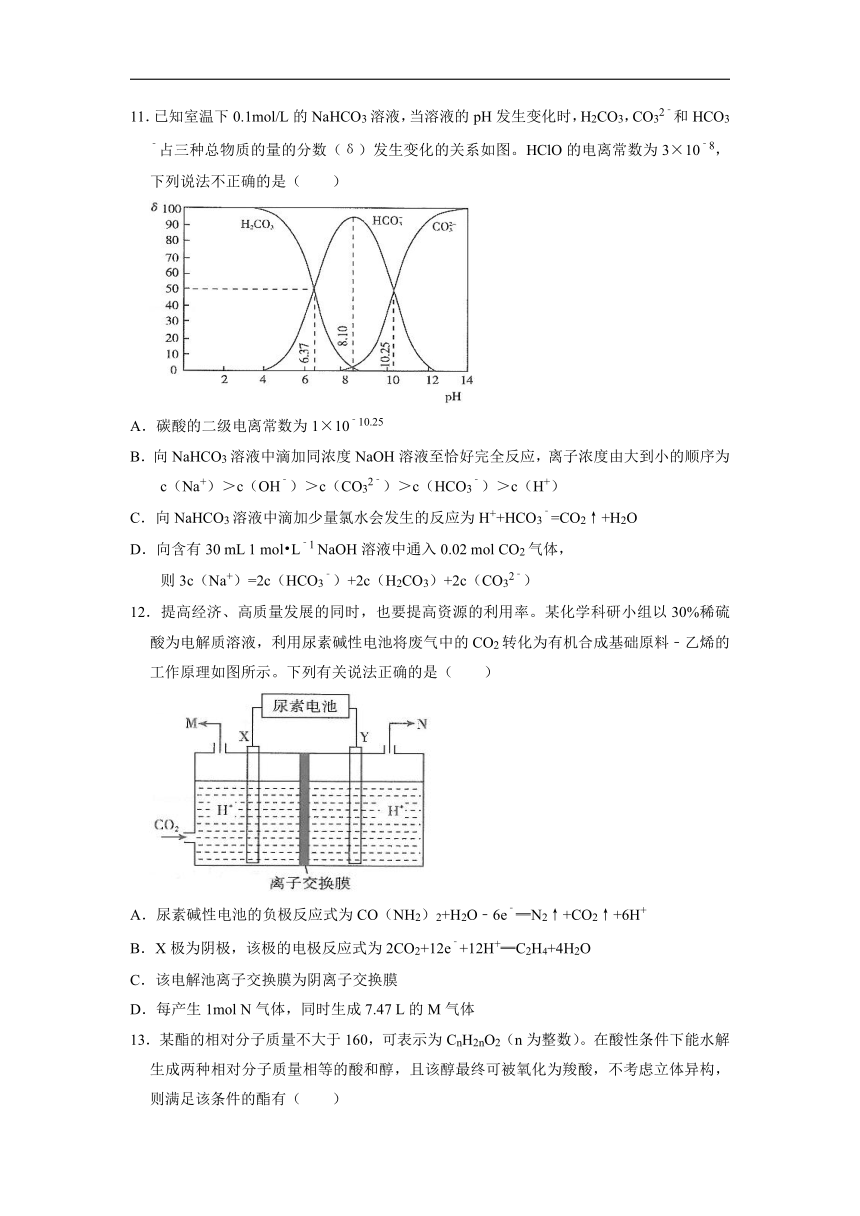
11.已知室温下0.1mol/L的NaHCO3溶液,当溶液的pH发生变化时,H2CO3,CO32﹣和HCO3﹣占三种总物质的量的分数(δ)发生变化的关系如图。HClO的电离常数为3×10﹣8,下列说法不正确的是( )
A.碳酸的二级电离常数为1×10﹣10.25
B.向NaHCO3溶液中滴加同浓度NaOH溶液至恰好完全反应,离子浓度由大到小的顺序为
c(Na+)>c(OH﹣)>c(CO32﹣)>c(HCO3﹣)>c(H+)
C.向NaHCO3溶液中滴加少量氯水会发生的反应为H++HCO3﹣=CO2↑+H2O
D.向含有30 mL 1 mol?L﹣1 NaOH溶液中通入0.02 mol CO2气体,
则3c(Na+)=2c(HCO3﹣)+2c(H2CO3)+2c(CO32﹣)
12.提高经济、高质量发展的同时,也要提高资源的利用率。某化学科研小组以30%稀硫酸为电解质溶液,利用尿素碱性电池将废气中的CO2转化为有机合成基础原料﹣乙烯的工作原理如图所示。下列有关说法正确的是( )
A.尿素碱性电池的负极反应式为CO(NH2)2+H2O﹣6e﹣═N2↑+CO2↑+6H+
B.X极为阴极,该极的电极反应式为2CO2+12e﹣+12H+═C2H4+4H2O
C.该电解池离子交换膜为阴离子交换膜
D.每产生1mol N气体,同时生成7.47 L的M气体
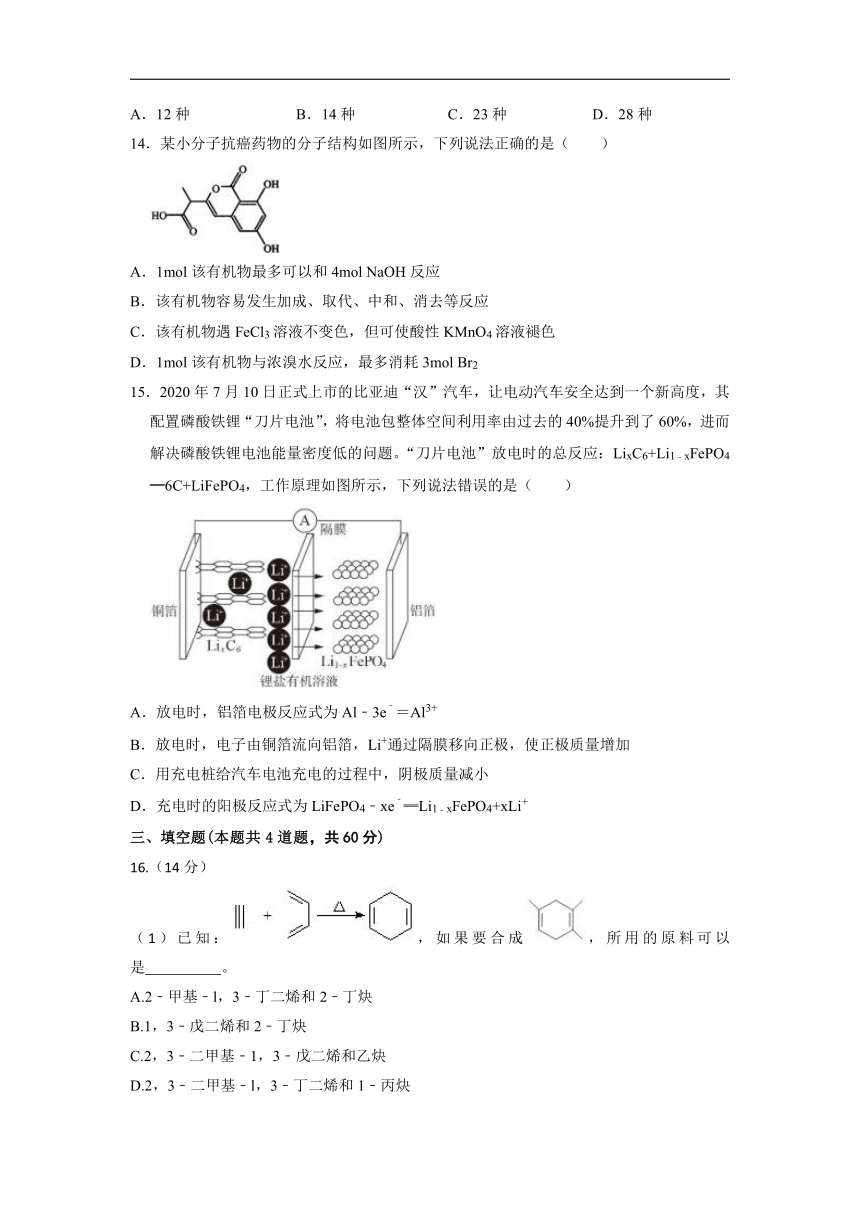
13.某酯的相对分子质量不大于160,可表示为CnH2nO2(n为整数)。在酸性条件下能水解生成两种相对分子质量相等的酸和醇,且该醇最终可被氧化为羧酸,不考虑立体异构,则满足该条件的酯有( )
A.12种 B.14种 C.23种 D.28种
14.某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )
A.1mol该有机物最多可以和4mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
15.2020年7月10日正式上市的比亚迪“汉”汽车,让电动汽车安全达到一个新高度,其配置磷酸铁锂“刀片电池”,将电池包整体空间利用率由过去的40%提升到了60%,进而解决磷酸铁锂电池能量密度低的问题。“刀片电池”放电时的总反应:LixC6+Li1﹣xFePO4═6C+LiFePO4,工作原理如图所示,下列说法错误的是( )
A.放电时,铝箔电极反应式为Al﹣3e﹣=Al3+
B.放电时,电子由铜箔流向铝箔,Li+通过隔膜移向正极,使正极质量增加
C.用充电桩给汽车电池充电的过程中,阴极质量减小
D.充电时的阳极反应式为LiFePO4﹣xe﹣═Li1﹣xFePO4+xLi+
三、填空题(本题共4道题,共60分)
16.(14分)
(1)已知:,如果要合成,所用的原料可以是 。
A.2﹣甲基﹣l,3﹣丁二烯和2﹣丁炔
B.1,3﹣戊二烯和2﹣丁炔
C.2,3﹣二甲基﹣1,3﹣戊二烯和乙炔
D.2,3﹣二甲基﹣l,3﹣丁二烯和1﹣丙炔
(2)分子式为C5H10的有机物同分异构体的数目为(考虑顺反异构) 种。
(3)某烃0.1mol和0.2mol HCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,则该烃的结构简式
为 。
(4)相对分子质量为84的烃与氢气加成后得到,该烃的系统命名法名称为 。
(5)中含有的官能团的名称为 。
(6)梯恩梯(TNT)结构简式为 。
(7)松节油脱去一分子水发生消去反应,最多可有 种有机产物。
17.(16分)
(一)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3(如图Ⅰ)
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为 。
(2)X的分子式为 ;X的结构简式为 。
(二)溴乙烷性质的探究:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL 6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
Ⅱ:将试管如图1固定后,水浴加热。
(3)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图2装置。A试管中的水的作用是 ,若无A试管,B试管中的试剂应为 。
(三)某同学通过查阅资料后设计如图所示的装置制备粗溴苯。
(5)B中生成溴苯的化学方程式为 。
(6)粗溴苯中含有FeBr3、Br2、苯、二溴苯等杂质,可经过几次洗涤后再用CaCl2处理,最后用蒸馏的方法就
可得到ag精制溴苯。若实验中使用了20mL苯(密度为0.88g/mL),则苯的利用率为 (列出计算式即可)。
18.(16分)
(一)高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。
图1为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。
请回答下列问题:
(1)该电池放电时的总反应的离子方程式为 。
(2)该电池充电时阳极反应的电极反应式为 。
(3)放电时,此盐桥中阴离子的运动方向是 。(填“从左向右”或“从右向左”)
现用蓄电池Fe+NiO2+2H2OFe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾。反应装置如图2所示:
(4)电解时,石墨电极连接的a极上放电的物质为 。(填“Fe”或“NiO2”)
(5)写出电解池中铁电极发生的电极反应式 。
(6)当消耗掉0.1mol NiO2时,生成高铁酸钾 g。
(二)图中甲池的总反应式为N2H4+O2═N2+2H2O。
(7)甲池中负极上的电极反应式为 。
(8)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为 g。
19.(14分)芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子个数之和是氧原子数的5倍。已知:各有机物间存在如图转化关系,其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是 。
(2)E中所含官能团的名称是 ;完全燃烧时,1mol D与1mol下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)写出水杨酸与小苏打反应的化学方程式是 ;
写出C与F反应的化学方程式是 。
(4)同时符合下列要求的同分异构体有 种。
①与A互为同分异构体。②能发生水解反应。③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1mol上述(4)中的一种有机物X,能与4mol NaOH发生反应,写出此反应的化学方程式 。
参考答案
1-10:BAAAA CCACA 11-15:BD,B,A,AD,AC
16.(1)AD
(2)11
(3)CH≡C﹣CH3
(4)3,3﹣二甲基﹣1﹣丁烯
(5)羟基、羧基
(6)
(7)4
17.(1)质谱法
(2)C8H10
(3)液体不分层
(4)吸收乙醇 溴水
(5)
(6)
18.(1)Fe+FeO42-+4H2O=2Fe(OH)3+2OH-
(2)Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
(3)从右向左
(4)Fe
(5)Fe﹣6e﹣+8OH﹣=FeO42﹣+4H2O
(6)6.6
(7)N2H4﹣4e﹣+4OH﹣=N2+4H2O
(8)12.8
19.(1)C10H10O4
(2)羧基 ac
(3)
CH3OH+HCOOHHCOOCH3+H2O
(4)3
(5)
说明:1、考试时间75分钟,满分100分。
将卷Ⅰ答案用2B铅笔涂在答题卡上,卷Ⅱ用黑色字迹的签字笔答在试卷上。
可能用到的相对分子质量:H 1 Li 7 C 12 N 14 O 16 P 31 K 39 Fe 56 Cu 64 Br 80
单项选择题(本题有10小题,每题2分,共20分。每小题只有一个正确答案)
1.下列说法不正确的是( )
A.葡萄糖和果糖均为单糖,二者互为同分异构体
B.“天宫二号”使用的碳纤维是一种新型有机高分子材料
C.油脂在碱性环境下的水解反应为皂化反应
D.丝绸的主要成分是蛋白质,属于天然高分子化合物
2.2020年春,新型冠状病毒肆虐全球,疫情出现以来,一系列举措体现了中国力量。下列有关说法错误的是( )
A.新型冠状病毒主要由C、H、O、N、S等元素组成,常用质量分数75%的医用酒精杀灭新型冠状病毒
B.N95型口罩的核心材料是聚丙烯,属于有机高分子材料
C.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
D.N95口罩烘烤后不能再继续使用,必须更换
3.下列有关叙述不正确的是( )
A.“中华有为”华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4﹣2e﹣+2H2O=PbO2+4H++SO42-
C.珠港澳大桥桥底镶嵌锌块,锌作负极,以防大桥被腐蚀
D.精炼铜工业中,当阳极通过的电子数为2NA,阴极析出的铜为1mol
4.下列说法正确的是( )
①正戊烷分子中所有的碳原子均在一条直线上
②乙烯和甲烷可用溴的四氯化碳溶液鉴别
③石油是混合物,其分馏产品汽油为纯净物
④和互为同分异构体,和是同一种物质
⑤甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
⑥甲苯分子中共平面的原子最多有13个
A.②⑤⑥ B.②③⑥ C.②③④⑤ D.①②⑥
5.室温时下列有关说法正确的是( )
A.浓度均为0.1mol?L﹣1的NH3?H2O和NH4Cl的混合溶液pH为10,
则c(NH4+)+c(H+)>c(NH3?H2O)+c(OH﹣)
B.0.2 mol?L﹣1CH3COOH溶液与0.1 mol?L﹣1NaOH溶液等体积混合后的溶液中:
c(CH3COO﹣)+c(OH﹣)=c(CH3COOH)+c(H+)
C.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液,其中的c(Na+):①<②<③
D.已知Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12,向浓度均为0.01mol?L﹣1的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,Ag2CrO4沉淀先析出
6.分子式为C5H9ClO2,且能与NaHCO3溶液反应放出气体的有机物共有( )
A.10种 B.11种 C.12种 D.13种
7.蛟龙号载人潜水器由我国自行设计、自主集成研制,是目前世界上下潜能力最深的作业型载人潜水器。给某潜水器提供动力的电池如图所示。下列有关说法正确的是( )
A.Zn电极发生了还原反应
B.电池中的Cl﹣向Pt电极移动
C.Pt电极反应式为H2O2+2e﹣=2OH﹣
D.电子从Zn电极沿导线流向Pt电极,再经溶液回到Zn电极
8.t℃时,向20.00mL 0.1 mol?L﹣1 H2X(H2X为二元弱酸)溶液中滴入0.1mol?L﹣1NaOH溶液,溶液中由水电离出的c水(OH﹣)的负对数[﹣lgc水(OH﹣)]与所加NaOH溶液体积的关系如图所示,下列说法中不正确的是( )
A.水的电离程度:P>N=Q>M,且a=7
B.图中M、P、Q三点对应溶液中c(HX-)/c(X2-)不相等
C.M点溶液中:c(Na+)>c(HX﹣)>c(H2X)
D.P点溶液中c(OH﹣)=c(H+)+c(HX﹣)+2c(H2X)
9.用微生物燃料电池作电源进行模拟消除酸性工业废水中的重铬酸根离子(Cr2O72﹣)的示意图如图所示。反应一段时间后,在装置②中得到Fe(OH)3和Cr(OH)3两种沉淀。下列说法错误的是( )
A.装置①中,a极的电极反应为:HS﹣+4H2O﹣8e﹣═SO42﹣+9H+
B.向装置②中加入适量Na2SO4晶体,其主要作用是增强溶液的导电性
C.装置①中,b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)相等
D.当装置①中有0.6mol H+通过质子交换膜时,装置②中产生0.4mol沉淀
10.已知两个醛分子在 NaOH 溶液作用下可以发生加成反应,生成羟基醛:
(醛基相连的碳上的碳氢单键与另一分子的醛基加成),如果将甲醛、乙醛、丙醛在 NaOH 溶液中发生反应,最多可以形成羟基醛的种类是( )
A.6 种 B.7 种 C.8 种 D.9 种
不定项选择题(本题有5小题,每题4分,共20分。每题有1-2个选项符合题意,全选对得4分,少选得2分,错选不得分)
11.已知室温下0.1mol/L的NaHCO3溶液,当溶液的pH发生变化时,H2CO3,CO32﹣和HCO3﹣占三种总物质的量的分数(δ)发生变化的关系如图。HClO的电离常数为3×10﹣8,下列说法不正确的是( )
A.碳酸的二级电离常数为1×10﹣10.25
B.向NaHCO3溶液中滴加同浓度NaOH溶液至恰好完全反应,离子浓度由大到小的顺序为
c(Na+)>c(OH﹣)>c(CO32﹣)>c(HCO3﹣)>c(H+)
C.向NaHCO3溶液中滴加少量氯水会发生的反应为H++HCO3﹣=CO2↑+H2O
D.向含有30 mL 1 mol?L﹣1 NaOH溶液中通入0.02 mol CO2气体,
则3c(Na+)=2c(HCO3﹣)+2c(H2CO3)+2c(CO32﹣)
12.提高经济、高质量发展的同时,也要提高资源的利用率。某化学科研小组以30%稀硫酸为电解质溶液,利用尿素碱性电池将废气中的CO2转化为有机合成基础原料﹣乙烯的工作原理如图所示。下列有关说法正确的是( )
A.尿素碱性电池的负极反应式为CO(NH2)2+H2O﹣6e﹣═N2↑+CO2↑+6H+
B.X极为阴极,该极的电极反应式为2CO2+12e﹣+12H+═C2H4+4H2O
C.该电解池离子交换膜为阴离子交换膜
D.每产生1mol N气体,同时生成7.47 L的M气体
13.某酯的相对分子质量不大于160,可表示为CnH2nO2(n为整数)。在酸性条件下能水解生成两种相对分子质量相等的酸和醇,且该醇最终可被氧化为羧酸,不考虑立体异构,则满足该条件的酯有( )
A.12种 B.14种 C.23种 D.28种
14.某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )
A.1mol该有机物最多可以和4mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
15.2020年7月10日正式上市的比亚迪“汉”汽车,让电动汽车安全达到一个新高度,其配置磷酸铁锂“刀片电池”,将电池包整体空间利用率由过去的40%提升到了60%,进而解决磷酸铁锂电池能量密度低的问题。“刀片电池”放电时的总反应:LixC6+Li1﹣xFePO4═6C+LiFePO4,工作原理如图所示,下列说法错误的是( )
A.放电时,铝箔电极反应式为Al﹣3e﹣=Al3+
B.放电时,电子由铜箔流向铝箔,Li+通过隔膜移向正极,使正极质量增加
C.用充电桩给汽车电池充电的过程中,阴极质量减小
D.充电时的阳极反应式为LiFePO4﹣xe﹣═Li1﹣xFePO4+xLi+
三、填空题(本题共4道题,共60分)
16.(14分)
(1)已知:,如果要合成,所用的原料可以是 。
A.2﹣甲基﹣l,3﹣丁二烯和2﹣丁炔
B.1,3﹣戊二烯和2﹣丁炔
C.2,3﹣二甲基﹣1,3﹣戊二烯和乙炔
D.2,3﹣二甲基﹣l,3﹣丁二烯和1﹣丙炔
(2)分子式为C5H10的有机物同分异构体的数目为(考虑顺反异构) 种。
(3)某烃0.1mol和0.2mol HCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,则该烃的结构简式
为 。
(4)相对分子质量为84的烃与氢气加成后得到,该烃的系统命名法名称为 。
(5)中含有的官能团的名称为 。
(6)梯恩梯(TNT)结构简式为 。
(7)松节油脱去一分子水发生消去反应,最多可有 种有机产物。
17.(16分)
(一)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3(如图Ⅰ)
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为 。
(2)X的分子式为 ;X的结构简式为 。
(二)溴乙烷性质的探究:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL 6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
Ⅱ:将试管如图1固定后,水浴加热。
(3)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图2装置。A试管中的水的作用是 ,若无A试管,B试管中的试剂应为 。
(三)某同学通过查阅资料后设计如图所示的装置制备粗溴苯。
(5)B中生成溴苯的化学方程式为 。
(6)粗溴苯中含有FeBr3、Br2、苯、二溴苯等杂质,可经过几次洗涤后再用CaCl2处理,最后用蒸馏的方法就
可得到ag精制溴苯。若实验中使用了20mL苯(密度为0.88g/mL),则苯的利用率为 (列出计算式即可)。
18.(16分)
(一)高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。
图1为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。
请回答下列问题:
(1)该电池放电时的总反应的离子方程式为 。
(2)该电池充电时阳极反应的电极反应式为 。
(3)放电时,此盐桥中阴离子的运动方向是 。(填“从左向右”或“从右向左”)
现用蓄电池Fe+NiO2+2H2OFe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾。反应装置如图2所示:
(4)电解时,石墨电极连接的a极上放电的物质为 。(填“Fe”或“NiO2”)
(5)写出电解池中铁电极发生的电极反应式 。
(6)当消耗掉0.1mol NiO2时,生成高铁酸钾 g。
(二)图中甲池的总反应式为N2H4+O2═N2+2H2O。
(7)甲池中负极上的电极反应式为 。
(8)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为 g。
19.(14分)芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子个数之和是氧原子数的5倍。已知:各有机物间存在如图转化关系,其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是 。
(2)E中所含官能团的名称是 ;完全燃烧时,1mol D与1mol下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)写出水杨酸与小苏打反应的化学方程式是 ;
写出C与F反应的化学方程式是 。
(4)同时符合下列要求的同分异构体有 种。
①与A互为同分异构体。②能发生水解反应。③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1mol上述(4)中的一种有机物X,能与4mol NaOH发生反应,写出此反应的化学方程式 。
参考答案
1-10:BAAAA CCACA 11-15:BD,B,A,AD,AC
16.(1)AD
(2)11
(3)CH≡C﹣CH3
(4)3,3﹣二甲基﹣1﹣丁烯
(5)羟基、羧基
(6)
(7)4
17.(1)质谱法
(2)C8H10
(3)液体不分层
(4)吸收乙醇 溴水
(5)
(6)
18.(1)Fe+FeO42-+4H2O=2Fe(OH)3+2OH-
(2)Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
(3)从右向左
(4)Fe
(5)Fe﹣6e﹣+8OH﹣=FeO42﹣+4H2O
(6)6.6
(7)N2H4﹣4e﹣+4OH﹣=N2+4H2O
(8)12.8
19.(1)C10H10O4
(2)羧基 ac
(3)
CH3OH+HCOOHHCOOCH3+H2O
(4)3
(5)
同课章节目录
