2020-2021学年九年级化学人教版(五四学制)全一册 第一单元 课题2 金属的化学性质 课件(39张PPT)
文档属性
| 名称 | 2020-2021学年九年级化学人教版(五四学制)全一册 第一单元 课题2 金属的化学性质 课件(39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 27.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-21 12:00:36 | ||
图片预览









文档简介
金属的化学性质(一)
初步认识常见金属与盐酸、稀硫酸的置换反应
初步认识金属能与金属化合物溶液发生反应
能用金属活动性解释一些与日常生活有关的化学问题
学习目标
2018年“活力之星”竞选大赛
金
Au
“活力之星”的评判标准:金属活动性强弱
评判标准
即表现在反应时的剧烈程度:
反应越不剧烈越不活泼,活动性就越弱。
金属反应越剧烈越活泼,活动性就越强;
1
比比谁更容易和氧气反应
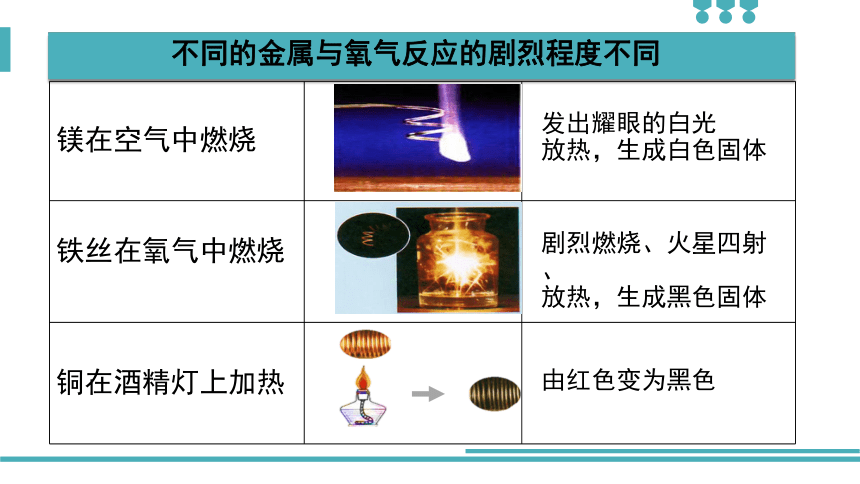
项目
镁在空气中燃烧
铁丝在氧气中燃烧
铜在酒精灯上加热
发出耀眼的白光
放热,生成白色固体
剧烈燃烧、火星四射、
放热,生成黑色固体
由红色变为黑色
不同的金属与氧气反应的剧烈程度不同
与氧气反应的条件
化学方程式
镁
铝
铁
铜
金
4Al+3O2=2Al2O3
3Fe+2O2=Fe3O4
点燃
2Cu+O2=2CuO
△
2Mg+O2=2MgO
点燃
不同的金属与氧气反应的难易不同
在常温就能与氧气反应,生成
致密的氧化铝(Al2O3)膜。
在空气中点燃能剧烈燃烧
在纯氧中才能被点燃
加热(或高温)时才会平缓的反应
在高温时也不与氧气反应
真金不怕火炼
大多数金属能与氧气反应,但反应的难易
和剧烈程度不同
根据金属能否与氧气反应及反应的难易和剧烈程度不同可判断金属的活泼程度
01
02
活动性
Mg、Al
>
Fe、Cu
>
Au
结论一
铝极易与空气中的氧气反应,生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
原因:
铝比铁活泼,为什么铝制品不易生锈?
生锈的铁链
铝制厨具
2
项目
在酸中“游泳”,看谁反应最剧烈
在4支试管里分别放入一小块打磨光亮的铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(A组)或稀硫酸(B组)
1.酸有腐蚀性,使用时要格外小心
2.要明确实验目的,提高实验效率
友情
提醒
实验探究
金属与酸的反应
仔细观察金属表面与溶液的变化,比较反应的剧烈程度
选择反应比较快的,将燃着木条放在试管口,观察现象
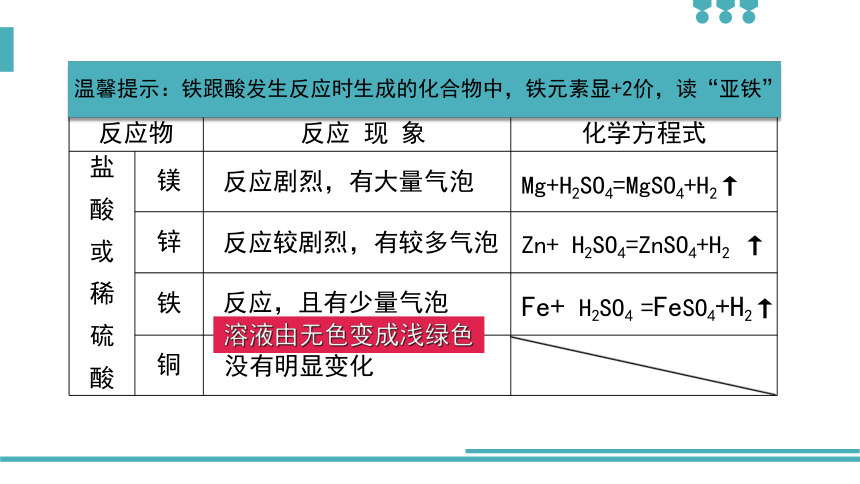
反应物
反应
现
象
化学方程式
盐
酸
或
稀
硫
酸
镁
锌
铁
铜
反应剧烈,有大量气泡
反应较剧烈,有较多气泡
反应,且有少量气泡
Mg+H2SO4=MgSO4+H2↑
Zn+
H2SO4=ZnSO4+H2
↑
Fe+
H2SO4
=FeSO4+H2↑
溶液由无色变成浅绿色
没有明显变化
温馨提示:铁跟酸发生反应时生成的化合物中,铁元素显+2价,读“亚铁”
Fe+2HCl=FeCl2+H2↑
火眼金睛
结论二
大多数金属能与酸反应,但反应的剧烈程度不同
根据金属能否与酸反应及反应的剧烈程度不同可判断金属的活泼程度
01
02
Mg
>
Zn
>
Fe
>
Cu
活动性
盐酸
God
Save
me
!!
无所谓,
我无所谓
…
为什
么受
伤的
总是
我!
我得意的
笑,又得
意的笑
…
金属与盐酸的反应
趣味漫画
金属与盐酸反应的比较
根据反应时是否有氢气产生,将金属分为两类:一类是能与金属反应的金属,另一类是不能与金属反应的金属。
----太剧烈,速度太快,很快就反应结束了
----气泡少,速度太慢
----气泡多,速度刚刚好
反思交流
实验室利用金属和酸反应制取氢气应该选择哪种金属?为什么?
镁
锌
铁
A
+BC
→
B
+
AC
+
+
Mg
2HCl
MgCl2
H2
↑
Zn
2HCl
ZnCl2
+
+
H2
↑
Fe
2HCl
FeCl2
+
+
H2
↑
置换反应
归纳总结
+
+
化合物
单质
化合物
单质
常见的反应形式:
(1)C、H2与金属氧化物的反应
(2)金属与酸的反应
(3)金属与化合物溶液的反应
(1)
Mg+CuO=Cu+MgO
(2)
CH4+2O2
=
CO2+2H2O
(3)
CuO+CO=Cu+CO2
(4)
C+2CuO
=
2Cu+CO2↑
(5)
CaCO3+2HCl=CaCl2+H2O+CO2
↑
(6)
2H2O2
=
2H2O+O2↑
△
点燃
高温
MnO2
△
否
否
否
否
是
是
判断下列反应是否属于置换反应?
抢答
抢答
回顾思考
Fe+CuSO4=Cu+FeSO4
铁钉表面覆盖一层红色物质,溶液由蓝色变为浅绿色。
(湿法冶金的原理)
3
项目
和金属化合物溶液反应强者胜
我来设计
Al
、Cu
、Ag
三种金属活动性顺序
探究内容
实验药品
铝丝、铜丝、稀盐酸、硫酸铜溶液
硝酸银溶液、硫酸铝溶液
探究过程
1.自选药品,设计实验方案
2.小组实验,记录实验现象
3.分析实验现象,得出结论
实验方案可以参照课本,也可以自己设计
2Al+3CuSO4=Al2(SO4)3+3Cu
火眼金睛
活动性
Al﹥Cu﹥Ag
根据金属能否将另一种金属从其化合物溶液中置换出来,可判断金属的活泼程度
有些金属能跟另一些金属的化合物溶液反应
01
02
结论三
同学们说出自己的实验方案
同学们说出自己的实验方案
同学们自己设计的方案
一
Mg
>
Al
>
Zn
>
Fe
>
Cu
>Ag
>
Au
总成绩
金属活动性排名
项目一
Mg、Al
>
Fe、Cu
>
Au
项目二
Mg
>
Zn
>
Fe
>
Cu
项目三
Al
>
Cu
>
Ag
01
02
03
镁
“活力之星”颁奖仪式
小结
判断金属活动性的方法
1.根据金属与氧气反应的难易程度、反应现象的剧烈程度判断
2.根据金属能否与酸反应及反应的剧烈程度判断
3.根据金属能否与另一种金属的化合物溶液反应判断
小结
下表是几种不同的金属被开发和利用的年代,从化学反应的角度看,决定这一年代先后顺序的关键因素是(
)
A、金属的活动性
B、金属的导电性
C、金属的延展性
D、地壳中金属元素的含量
A
金属冶炼的早晚与金属活动性的强弱有关
化学与生活
A、铝制品抗腐蚀性强,不易生锈
B、铝的密度小,比较轻便
C、铝的活动性强,当时炼铝技术落后,铝比金贵
D、铝的延展性好,可塑性好
拿破仑加冕时戴铝制皇冠,不戴金皇冠的原因
(
)
化学与生活
C
收获和体会
通过本节课的学习,你有哪些收获?
还存在哪些疑惑?同学之间交流一下。
在平顶山博物馆陈列的文物中,金器保存很好,铜器表面有锈迹,而铁器表面锈迹斑斑,这表明金、铜、铁的活泼性顺序由强到
弱为(
)
A.
金、铜、铁
B.
铁、金、铜
C.
铜、铁、金
D.
铁,铜,金
D
拓展练习
1
拓展练顶山晚报》一篇文章报道:有人将铁放入照相馆废弃的定影液(含有硝酸银)中,每月可回收20万元的银。你知道其回收的原理吗?请用化学方程式表示。
Fe
+
2AgNO3
=
2Ag
+
Fe(NO3)2
2
拓展练习
(2014.河南)据古籍记载江西上饶有一苦泉
(苦泉水呈蓝色)。铁锅使用苦泉水会变成铜锅,试分析蕴含的化学原理。
Fe+CuSO4=FeSO4+Cu
3
课后作业
设计三种方案证明金属的活动性
Fe﹥Cu﹥Ag
作
业
化学是神秘美丽的花园,
金属是这美丽花园的一角,
化学是香气扑鼻的绿茶,
金属是这扑鼻绿茶的清香;
金属世界,奥妙无穷;
期待你的探索。
Thank
You
初步认识常见金属与盐酸、稀硫酸的置换反应
初步认识金属能与金属化合物溶液发生反应
能用金属活动性解释一些与日常生活有关的化学问题
学习目标
2018年“活力之星”竞选大赛
金
Au
“活力之星”的评判标准:金属活动性强弱
评判标准
即表现在反应时的剧烈程度:
反应越不剧烈越不活泼,活动性就越弱。
金属反应越剧烈越活泼,活动性就越强;
1
比比谁更容易和氧气反应
项目
镁在空气中燃烧
铁丝在氧气中燃烧
铜在酒精灯上加热
发出耀眼的白光
放热,生成白色固体
剧烈燃烧、火星四射、
放热,生成黑色固体
由红色变为黑色
不同的金属与氧气反应的剧烈程度不同
与氧气反应的条件
化学方程式
镁
铝
铁
铜
金
4Al+3O2=2Al2O3
3Fe+2O2=Fe3O4
点燃
2Cu+O2=2CuO
△
2Mg+O2=2MgO
点燃
不同的金属与氧气反应的难易不同
在常温就能与氧气反应,生成
致密的氧化铝(Al2O3)膜。
在空气中点燃能剧烈燃烧
在纯氧中才能被点燃
加热(或高温)时才会平缓的反应
在高温时也不与氧气反应
真金不怕火炼
大多数金属能与氧气反应,但反应的难易
和剧烈程度不同
根据金属能否与氧气反应及反应的难易和剧烈程度不同可判断金属的活泼程度
01
02
活动性
Mg、Al
>
Fe、Cu
>
Au
结论一
铝极易与空气中的氧气反应,生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
原因:
铝比铁活泼,为什么铝制品不易生锈?
生锈的铁链
铝制厨具
2
项目
在酸中“游泳”,看谁反应最剧烈
在4支试管里分别放入一小块打磨光亮的铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(A组)或稀硫酸(B组)
1.酸有腐蚀性,使用时要格外小心
2.要明确实验目的,提高实验效率
友情
提醒
实验探究
金属与酸的反应
仔细观察金属表面与溶液的变化,比较反应的剧烈程度
选择反应比较快的,将燃着木条放在试管口,观察现象
反应物
反应
现
象
化学方程式
盐
酸
或
稀
硫
酸
镁
锌
铁
铜
反应剧烈,有大量气泡
反应较剧烈,有较多气泡
反应,且有少量气泡
Mg+H2SO4=MgSO4+H2↑
Zn+
H2SO4=ZnSO4+H2
↑
Fe+
H2SO4
=FeSO4+H2↑
溶液由无色变成浅绿色
没有明显变化
温馨提示:铁跟酸发生反应时生成的化合物中,铁元素显+2价,读“亚铁”
Fe+2HCl=FeCl2+H2↑
火眼金睛
结论二
大多数金属能与酸反应,但反应的剧烈程度不同
根据金属能否与酸反应及反应的剧烈程度不同可判断金属的活泼程度
01
02
Mg
>
Zn
>
Fe
>
Cu
活动性
盐酸
God
Save
me
!!
无所谓,
我无所谓
…
为什
么受
伤的
总是
我!
我得意的
笑,又得
意的笑
…
金属与盐酸的反应
趣味漫画
金属与盐酸反应的比较
根据反应时是否有氢气产生,将金属分为两类:一类是能与金属反应的金属,另一类是不能与金属反应的金属。
----太剧烈,速度太快,很快就反应结束了
----气泡少,速度太慢
----气泡多,速度刚刚好
反思交流
实验室利用金属和酸反应制取氢气应该选择哪种金属?为什么?
镁
锌
铁
A
+BC
→
B
+
AC
+
+
Mg
2HCl
MgCl2
H2
↑
Zn
2HCl
ZnCl2
+
+
H2
↑
Fe
2HCl
FeCl2
+
+
H2
↑
置换反应
归纳总结
+
+
化合物
单质
化合物
单质
常见的反应形式:
(1)C、H2与金属氧化物的反应
(2)金属与酸的反应
(3)金属与化合物溶液的反应
(1)
Mg+CuO=Cu+MgO
(2)
CH4+2O2
=
CO2+2H2O
(3)
CuO+CO=Cu+CO2
(4)
C+2CuO
=
2Cu+CO2↑
(5)
CaCO3+2HCl=CaCl2+H2O+CO2
↑
(6)
2H2O2
=
2H2O+O2↑
△
点燃
高温
MnO2
△
否
否
否
否
是
是
判断下列反应是否属于置换反应?
抢答
抢答
回顾思考
Fe+CuSO4=Cu+FeSO4
铁钉表面覆盖一层红色物质,溶液由蓝色变为浅绿色。
(湿法冶金的原理)
3
项目
和金属化合物溶液反应强者胜
我来设计
Al
、Cu
、Ag
三种金属活动性顺序
探究内容
实验药品
铝丝、铜丝、稀盐酸、硫酸铜溶液
硝酸银溶液、硫酸铝溶液
探究过程
1.自选药品,设计实验方案
2.小组实验,记录实验现象
3.分析实验现象,得出结论
实验方案可以参照课本,也可以自己设计
2Al+3CuSO4=Al2(SO4)3+3Cu
火眼金睛
活动性
Al﹥Cu﹥Ag
根据金属能否将另一种金属从其化合物溶液中置换出来,可判断金属的活泼程度
有些金属能跟另一些金属的化合物溶液反应
01
02
结论三
同学们说出自己的实验方案
同学们说出自己的实验方案
同学们自己设计的方案
一
Mg
>
Al
>
Zn
>
Fe
>
Cu
>Ag
>
Au
总成绩
金属活动性排名
项目一
Mg、Al
>
Fe、Cu
>
Au
项目二
Mg
>
Zn
>
Fe
>
Cu
项目三
Al
>
Cu
>
Ag
01
02
03
镁
“活力之星”颁奖仪式
小结
判断金属活动性的方法
1.根据金属与氧气反应的难易程度、反应现象的剧烈程度判断
2.根据金属能否与酸反应及反应的剧烈程度判断
3.根据金属能否与另一种金属的化合物溶液反应判断
小结
下表是几种不同的金属被开发和利用的年代,从化学反应的角度看,决定这一年代先后顺序的关键因素是(
)
A、金属的活动性
B、金属的导电性
C、金属的延展性
D、地壳中金属元素的含量
A
金属冶炼的早晚与金属活动性的强弱有关
化学与生活
A、铝制品抗腐蚀性强,不易生锈
B、铝的密度小,比较轻便
C、铝的活动性强,当时炼铝技术落后,铝比金贵
D、铝的延展性好,可塑性好
拿破仑加冕时戴铝制皇冠,不戴金皇冠的原因
(
)
化学与生活
C
收获和体会
通过本节课的学习,你有哪些收获?
还存在哪些疑惑?同学之间交流一下。
在平顶山博物馆陈列的文物中,金器保存很好,铜器表面有锈迹,而铁器表面锈迹斑斑,这表明金、铜、铁的活泼性顺序由强到
弱为(
)
A.
金、铜、铁
B.
铁、金、铜
C.
铜、铁、金
D.
铁,铜,金
D
拓展练习
1
拓展练顶山晚报》一篇文章报道:有人将铁放入照相馆废弃的定影液(含有硝酸银)中,每月可回收20万元的银。你知道其回收的原理吗?请用化学方程式表示。
Fe
+
2AgNO3
=
2Ag
+
Fe(NO3)2
2
拓展练习
(2014.河南)据古籍记载江西上饶有一苦泉
(苦泉水呈蓝色)。铁锅使用苦泉水会变成铜锅,试分析蕴含的化学原理。
Fe+CuSO4=FeSO4+Cu
3
课后作业
设计三种方案证明金属的活动性
Fe﹥Cu﹥Ag
作
业
化学是神秘美丽的花园,
金属是这美丽花园的一角,
化学是香气扑鼻的绿茶,
金属是这扑鼻绿茶的清香;
金属世界,奥妙无穷;
期待你的探索。
Thank
You
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
