9.1 常见的金属材料 课件(29张PPT)
文档属性
| 名称 | 9.1 常见的金属材料 课件(29张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-22 17:18:19 | ||
图片预览








文档简介
常见的金属材料
一、金属材料的发展史
人类文明进步和金属材料发展关系十分密切。继石器时代之后的青铜器时代和铁器时代,均以金属材料的广泛应用为其时代标志。
石器时代(旧石器时代,中石器时代,新石器时代)
主要运用磨制石器制造工具,开始出现冶炼,烧制陶器。
青铜器时代:中国青铜器开始出现于夏朝时期,兴盛于商朝时期,结束于春秋,在战国时期被铁器取代。
铁器时代:春秋时期开始冶铁;战国时期开始炼钢;钢和铁一直是人类广泛应用的金属材料。
在100多年前,又开始了铝的使用,因为铝具有密度小和抗腐蚀等许多优良性能。
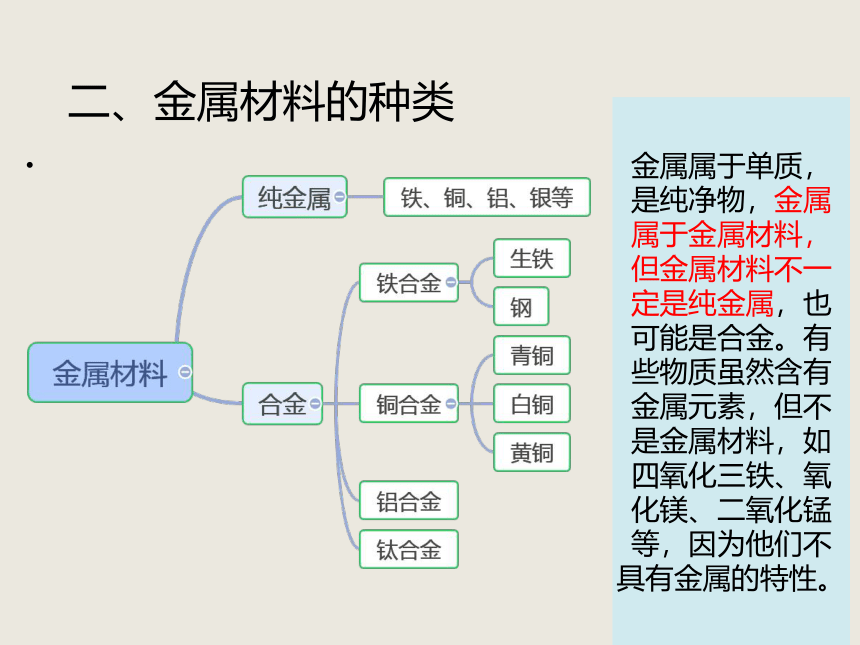
二、金属材料的种类
金属属于单质,是纯净物,金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。有些物质虽然含有金属元素,但不是金属材料,如四氧化三铁、氧化镁、二氧化锰等,因为他们不具有金属的特性。
例一、
下列物质属于金属材料的是()
A、金刚石
B、大理石
C、氧化铜
D、铜
D
三、金属的物理性质
金属在生活生产中有着非常广泛的应用,这些应用有许多都是由金属的物理性质决定的。
1.金属的共性
大多数金属都具有金属光泽,密度和硬度较大,熔点和沸点较高,具有良好的延展性和导电、导热性能。除汞外,金属在常温下都是固体。
颜色和光泽一般是指金属在整块时表现出来的外观特性,当金属为粉末时,一般都为黑色
2.金属的特性
不同的金属还具有各自的特性,如大多数金属为银白色,铜为紫红色,金为黄色;铂的延性好,可以抽成直径只有1/5000mm的细丝;金的展性好啊,可以压成厚度只有1/1000mm的薄片。
3.金属的物理性质与用途之间的关系。
(1)金属物理性质的应用
铜和铝制成导线——铜和铝具有良好的导电性;
铜做炊具——铜具有良好的导热性;
钨做灯丝——钨熔点高;
铜做铜像——铜的延展性;
铁的合金和铝的合金做餐具—铁和铝硬度大、延展性好、有金属光泽;
铁做哑铃——铁的密度大;
铁做锤子——铁的强度大
(2)金属的物理性质与用途的关系
金属的物理性质
金属的用途
内容
能导电
制电线、电缆
能导热
做炊具
有延展性
拉成丝,压成箔
有一定的机械强度
制作车辆、防盗门窗、机械等
具有金属光泽
做饰品等
关系
性质决定用途,用途反映性质
物质的性质很大程度上决定了物质的用途。在实际应用中我们考虑物质的用途时,不仅要考虑物质的性质,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
如银的导电性比铜要好,但一般的导线用铜制而不用银,因为银的资源有限,价格比较贵,而铜的价格相对便宜;如水龙头镀金和镀铬都能防锈,但一般水龙头是镀铬,而不是镀金,因为铬的价格便宜且硬度大而金价格很高。
(1)金属之最
地壳中含量最高的金属元素——铝;
人体中含量最高的金属元素——钙;
目前世界上年产量最高的金属——铁;
导电导热型最好的金属——银;
硬度最高的金属——铬;
熔点最高的金属——钨;
熔点最低的金属——汞。
拓展
例二、
金属材料在现实生活中有极为广泛的应用。下列金属材料的应用与金属所具有的性质不一致的是()
A、制造白炽灯灯丝——熔点高
B、制造飞机——坚硬而质轻
C、制造保险丝——硬度大
D、制造盛装化工原料的容器——耐腐蚀
C
铝镁合金,熔点低
铝合金、镁合金、钛合金
四、金属的分类
五、合金
1.定义:在某种金属中加热融合其他金属或非金属后形成的、具有金属特性的物质。
(1)合金不定全部由金属组成,也可以由金属与非金属组成。但是合金至少含有一种金属。
(2)合金具有金属特性,如导电性、导热性、延展性等
(3)合金是混合物
(4)合金中各成分仍保持自己的性质
2.常见的合金
合金
主要成分
性能
主要用途
铁合金
生铁
炼钢生铁
铁、碳
硬而脆、可铸造但不可煅轧
炼钢
铸造生铁
铁、碳
加工性能好,但不能煅轧
化工机械和铸件
钢
碳素钢
低碳钢
铁、碳(低0.3%)
韧性好
机械零件、钢管
中碳钢
铁、碳(0.3~0.6%)
韧性好
机械零件、钢管
高碳钢
铁、碳(0.6~2%)
硬度大
刀具、量具、模具
合金钢
锰钢
铁、锰、碳
韧性好、硬度大
钢轨、挖掘机铲斗、坦克、自行车架
不锈钢
铁、铬、镍
抗腐蚀性好
医疗器械、餐具等
硅钢
铁、硅
导磁性好
变压器、发电机和电动机铁芯
钨钢
铁、钨
耐高温、硬度大
刀具
合金的性能主要取决于合金的成分
生铁和钢是应用最广的铁合金,区别在于含碳量不同,生铁的含碳量为2~4.3%,钢的含碳量在0.03~2%之间
合金
主要成分
性能
主要用途
铜合金
青铜
铜、锡
强度较高、可塑性好、易加工、耐腐蚀
机器零件、仪表和日用品
黄铜
铜、锌
强度较高、可塑性好、耐磨、耐腐蚀
机器零件和轴承、齿轮
白铜
铜、镍
光泽好、耐磨、耐腐蚀、易加工
钱币、饰品
硬铝
铝、铜、镁、硅
强度和硬度好
火箭、飞机、轮船等制造业
钛合金
钛、铝、钒
耐高温、耐腐蚀、强度高
航空、航天业就化学工业
焊锡
锡、铅
熔点低
焊接金属
18k黄金
金、银、铜
光泽好、耐磨、易加工
金饰品、钱币、电子元件
18k白金
金、铜、镍、锌
光泽好、耐磨、易加工
金饰品
人类历史上使用最早的合金
钛和钛合金被认为是21世纪的重要金属材料,具有良好的防腐蚀性,对海水、空气和若干腐蚀介质都较稳定,可塑性能好,强度大,密度小,又称亲生物金属。可用于喷气发动机、飞机机身人造卫星外壳、火箭壳体、医学补形、造纸、人造骨、海水淡化设备、游轮、舰艇外壳的制造
3.金属与合金的性质比较
现象
结论
实验1
纯金属和合金都具有金属光泽,但颜色可能会改变
合金的颜色更艳丽
实验2
纯金属与合金相互刻画,纯金属上有划痕
合金硬度大
实验3
将锡片与焊锡放在铁上同时加热,可观察到焊锡先融化
合金熔点要比组成它的纯金属的熔点低
(1)纯金属与合金的性质差异合金的强度和硬度一般比组成它们的纯金属高;合金的熔点比组成它们的纯金属熔点低;合金的抗腐蚀性能更好的、机械加工性能好、色泽更艳丽。
(2)用途:由于合金的很多性能比组成它们的纯金属更优良,其优越性能能满足许多特殊要求的用途和高科技需要,改变合金成分的配比及合金的形成条件,可以值得多种不同性能的合金。因此合金具有更广泛的用途。
例三、金属的用途很广,我们应该保护好金属资源。回答以下问题:
(1)金属能用于做炊具,是因为金属具有_____(填“导电性”或“导热性”)
(2)黄铜片和铜片相比较,硬度较大的是______。
六、金属矿物及其冶炼
地球上的金属资源广泛存在于地壳和浩瀚的海洋中,其中杉树很不活泼的金属(如金、银、铂等)以单质的形式存在,其余金属都以化合物的形式存在。
铝元素在自然界中的分布极广,以化合物的形式存在于各种岩石和矿物中,常见的铝土矿、钾长石和明矾石等,他们的主要成分分别是Al2O3、KAlSi3O8和KAl3(SO4)2(OH)6
铁元素在自然界中的分布也很广,大多数以化合物的形式存在于各种铁矿石中。常见的铁矿石有赤铁矿、磁铁矿、菱铁矿和黄铁矿等,他们的主要成分是Fe2O3、Fe3O4、FeCO3、FeS2 。
1.那么人类是如何从铁矿石中的到铁的呢?下面让我们通过实验来探究炼铁的化学反应原理。
红色粉末逐渐变为黑色,澄清石灰水变浑浊。尾气燃烧产生淡蓝色火焰
(1)实验原理:在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。
(2)步骤:
①检查装置气密性;
②将氧化铁翻入硬质玻璃管中;
③向硬质玻璃管中通入一氧化碳气体直至排进硬质玻璃管中的空气;
④给氧化铁加热;
⑤当红色粉末全部变黑后,停止加热,继续通入一氧化碳,直至试管冷却;
⑥停止通入一氧化碳。
CO具有可燃性,通入一氧化碳前需检验CO纯度。
加热前先通入CO将空气排净,是因为CO是可燃性气体,与空气混合加热可能会发生爆炸
实验结束时,应先停止加热,继续通入CO,防止高温下铁被空气中的氧气氧化,而且可以防止石灰水倒吸入硬质玻璃管,引起硬质玻璃管炸裂。
反应之前要通气,空气排净在点灯;
反应结束先撤灯,装置冷却通气停;
先点后通要爆炸,先撤后停要氧化
(3)现象:红色粉末逐渐变为黑色,澄清石灰水变浑浊。尾气燃烧产生蓝色火焰。
(4)产物检验:黑色粉末能被磁铁吸引,说明有铁产生;澄清石灰水变浑浊,说明产生了二氧化碳。
(5)实验结论:红色的氧化铁被一氧化碳还原成黑色的单质铁,同时生成CO2气体。
(6)反应原理:
纯净的块状铁为银白色,此实验生成的铁粉为黑色
(7)尾气处理:一氧化碳有毒,不能排放到空气中,否则会污染空气。
尾气处理方法有:①收集法(在图中导管末端系一个气球收集尾气或用排水法收集尾气);②燃烧法(在导管末端用酒精灯将尾气点燃),反应的化学方程式:
2.工业炼铁
①炼铁的设备:高炉
②炼铁的原料:铁炉石、焦炭、石灰石、空气。
③原料中石灰石的作用:除去铁矿石中
的杂质,使之成为炉渣。
④原料中焦炭的作用:与氧气反应放出
热量,与二氧化碳反应制备还原剂——
一氧化碳
⑤产品:生铁,及含碳量为2%~4.3%
的铁合金
3.工业炼铝
工业上采取电解法炼铝,反应的化学方程式
七、还原反应
1.定义:化学上把含氧化合物中的氧被夺去的反应叫做还原反应。例如反应: 中,Fe2O3—Fe,Fe2O3 中的氧被夺去,Fe2O3 发生了还原反应。
中CuO中的氧被夺去,CuO发生了还原反应。
2.氧化反应和还原反应的区别与联系
类型
氧化反应
还原反应
概念
物质与氧发生的反应
含氧化合物中的氧被夺去的反应
本质
得到氧
失去氧
联系
氧化还原反应是同时发生的
升失氧化还原剂
降得还原氧化剂
一、金属材料的发展史
人类文明进步和金属材料发展关系十分密切。继石器时代之后的青铜器时代和铁器时代,均以金属材料的广泛应用为其时代标志。
石器时代(旧石器时代,中石器时代,新石器时代)
主要运用磨制石器制造工具,开始出现冶炼,烧制陶器。
青铜器时代:中国青铜器开始出现于夏朝时期,兴盛于商朝时期,结束于春秋,在战国时期被铁器取代。
铁器时代:春秋时期开始冶铁;战国时期开始炼钢;钢和铁一直是人类广泛应用的金属材料。
在100多年前,又开始了铝的使用,因为铝具有密度小和抗腐蚀等许多优良性能。
二、金属材料的种类
金属属于单质,是纯净物,金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。有些物质虽然含有金属元素,但不是金属材料,如四氧化三铁、氧化镁、二氧化锰等,因为他们不具有金属的特性。
例一、
下列物质属于金属材料的是()
A、金刚石
B、大理石
C、氧化铜
D、铜
D
三、金属的物理性质
金属在生活生产中有着非常广泛的应用,这些应用有许多都是由金属的物理性质决定的。
1.金属的共性
大多数金属都具有金属光泽,密度和硬度较大,熔点和沸点较高,具有良好的延展性和导电、导热性能。除汞外,金属在常温下都是固体。
颜色和光泽一般是指金属在整块时表现出来的外观特性,当金属为粉末时,一般都为黑色
2.金属的特性
不同的金属还具有各自的特性,如大多数金属为银白色,铜为紫红色,金为黄色;铂的延性好,可以抽成直径只有1/5000mm的细丝;金的展性好啊,可以压成厚度只有1/1000mm的薄片。
3.金属的物理性质与用途之间的关系。
(1)金属物理性质的应用
铜和铝制成导线——铜和铝具有良好的导电性;
铜做炊具——铜具有良好的导热性;
钨做灯丝——钨熔点高;
铜做铜像——铜的延展性;
铁的合金和铝的合金做餐具—铁和铝硬度大、延展性好、有金属光泽;
铁做哑铃——铁的密度大;
铁做锤子——铁的强度大
(2)金属的物理性质与用途的关系
金属的物理性质
金属的用途
内容
能导电
制电线、电缆
能导热
做炊具
有延展性
拉成丝,压成箔
有一定的机械强度
制作车辆、防盗门窗、机械等
具有金属光泽
做饰品等
关系
性质决定用途,用途反映性质
物质的性质很大程度上决定了物质的用途。在实际应用中我们考虑物质的用途时,不仅要考虑物质的性质,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
如银的导电性比铜要好,但一般的导线用铜制而不用银,因为银的资源有限,价格比较贵,而铜的价格相对便宜;如水龙头镀金和镀铬都能防锈,但一般水龙头是镀铬,而不是镀金,因为铬的价格便宜且硬度大而金价格很高。
(1)金属之最
地壳中含量最高的金属元素——铝;
人体中含量最高的金属元素——钙;
目前世界上年产量最高的金属——铁;
导电导热型最好的金属——银;
硬度最高的金属——铬;
熔点最高的金属——钨;
熔点最低的金属——汞。
拓展
例二、
金属材料在现实生活中有极为广泛的应用。下列金属材料的应用与金属所具有的性质不一致的是()
A、制造白炽灯灯丝——熔点高
B、制造飞机——坚硬而质轻
C、制造保险丝——硬度大
D、制造盛装化工原料的容器——耐腐蚀
C
铝镁合金,熔点低
铝合金、镁合金、钛合金
四、金属的分类
五、合金
1.定义:在某种金属中加热融合其他金属或非金属后形成的、具有金属特性的物质。
(1)合金不定全部由金属组成,也可以由金属与非金属组成。但是合金至少含有一种金属。
(2)合金具有金属特性,如导电性、导热性、延展性等
(3)合金是混合物
(4)合金中各成分仍保持自己的性质
2.常见的合金
合金
主要成分
性能
主要用途
铁合金
生铁
炼钢生铁
铁、碳
硬而脆、可铸造但不可煅轧
炼钢
铸造生铁
铁、碳
加工性能好,但不能煅轧
化工机械和铸件
钢
碳素钢
低碳钢
铁、碳(低0.3%)
韧性好
机械零件、钢管
中碳钢
铁、碳(0.3~0.6%)
韧性好
机械零件、钢管
高碳钢
铁、碳(0.6~2%)
硬度大
刀具、量具、模具
合金钢
锰钢
铁、锰、碳
韧性好、硬度大
钢轨、挖掘机铲斗、坦克、自行车架
不锈钢
铁、铬、镍
抗腐蚀性好
医疗器械、餐具等
硅钢
铁、硅
导磁性好
变压器、发电机和电动机铁芯
钨钢
铁、钨
耐高温、硬度大
刀具
合金的性能主要取决于合金的成分
生铁和钢是应用最广的铁合金,区别在于含碳量不同,生铁的含碳量为2~4.3%,钢的含碳量在0.03~2%之间
合金
主要成分
性能
主要用途
铜合金
青铜
铜、锡
强度较高、可塑性好、易加工、耐腐蚀
机器零件、仪表和日用品
黄铜
铜、锌
强度较高、可塑性好、耐磨、耐腐蚀
机器零件和轴承、齿轮
白铜
铜、镍
光泽好、耐磨、耐腐蚀、易加工
钱币、饰品
硬铝
铝、铜、镁、硅
强度和硬度好
火箭、飞机、轮船等制造业
钛合金
钛、铝、钒
耐高温、耐腐蚀、强度高
航空、航天业就化学工业
焊锡
锡、铅
熔点低
焊接金属
18k黄金
金、银、铜
光泽好、耐磨、易加工
金饰品、钱币、电子元件
18k白金
金、铜、镍、锌
光泽好、耐磨、易加工
金饰品
人类历史上使用最早的合金
钛和钛合金被认为是21世纪的重要金属材料,具有良好的防腐蚀性,对海水、空气和若干腐蚀介质都较稳定,可塑性能好,强度大,密度小,又称亲生物金属。可用于喷气发动机、飞机机身人造卫星外壳、火箭壳体、医学补形、造纸、人造骨、海水淡化设备、游轮、舰艇外壳的制造
3.金属与合金的性质比较
现象
结论
实验1
纯金属和合金都具有金属光泽,但颜色可能会改变
合金的颜色更艳丽
实验2
纯金属与合金相互刻画,纯金属上有划痕
合金硬度大
实验3
将锡片与焊锡放在铁上同时加热,可观察到焊锡先融化
合金熔点要比组成它的纯金属的熔点低
(1)纯金属与合金的性质差异合金的强度和硬度一般比组成它们的纯金属高;合金的熔点比组成它们的纯金属熔点低;合金的抗腐蚀性能更好的、机械加工性能好、色泽更艳丽。
(2)用途:由于合金的很多性能比组成它们的纯金属更优良,其优越性能能满足许多特殊要求的用途和高科技需要,改变合金成分的配比及合金的形成条件,可以值得多种不同性能的合金。因此合金具有更广泛的用途。
例三、金属的用途很广,我们应该保护好金属资源。回答以下问题:
(1)金属能用于做炊具,是因为金属具有_____(填“导电性”或“导热性”)
(2)黄铜片和铜片相比较,硬度较大的是______。
六、金属矿物及其冶炼
地球上的金属资源广泛存在于地壳和浩瀚的海洋中,其中杉树很不活泼的金属(如金、银、铂等)以单质的形式存在,其余金属都以化合物的形式存在。
铝元素在自然界中的分布极广,以化合物的形式存在于各种岩石和矿物中,常见的铝土矿、钾长石和明矾石等,他们的主要成分分别是Al2O3、KAlSi3O8和KAl3(SO4)2(OH)6
铁元素在自然界中的分布也很广,大多数以化合物的形式存在于各种铁矿石中。常见的铁矿石有赤铁矿、磁铁矿、菱铁矿和黄铁矿等,他们的主要成分是Fe2O3、Fe3O4、FeCO3、FeS2 。
1.那么人类是如何从铁矿石中的到铁的呢?下面让我们通过实验来探究炼铁的化学反应原理。
红色粉末逐渐变为黑色,澄清石灰水变浑浊。尾气燃烧产生淡蓝色火焰
(1)实验原理:在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。
(2)步骤:
①检查装置气密性;
②将氧化铁翻入硬质玻璃管中;
③向硬质玻璃管中通入一氧化碳气体直至排进硬质玻璃管中的空气;
④给氧化铁加热;
⑤当红色粉末全部变黑后,停止加热,继续通入一氧化碳,直至试管冷却;
⑥停止通入一氧化碳。
CO具有可燃性,通入一氧化碳前需检验CO纯度。
加热前先通入CO将空气排净,是因为CO是可燃性气体,与空气混合加热可能会发生爆炸
实验结束时,应先停止加热,继续通入CO,防止高温下铁被空气中的氧气氧化,而且可以防止石灰水倒吸入硬质玻璃管,引起硬质玻璃管炸裂。
反应之前要通气,空气排净在点灯;
反应结束先撤灯,装置冷却通气停;
先点后通要爆炸,先撤后停要氧化
(3)现象:红色粉末逐渐变为黑色,澄清石灰水变浑浊。尾气燃烧产生蓝色火焰。
(4)产物检验:黑色粉末能被磁铁吸引,说明有铁产生;澄清石灰水变浑浊,说明产生了二氧化碳。
(5)实验结论:红色的氧化铁被一氧化碳还原成黑色的单质铁,同时生成CO2气体。
(6)反应原理:
纯净的块状铁为银白色,此实验生成的铁粉为黑色
(7)尾气处理:一氧化碳有毒,不能排放到空气中,否则会污染空气。
尾气处理方法有:①收集法(在图中导管末端系一个气球收集尾气或用排水法收集尾气);②燃烧法(在导管末端用酒精灯将尾气点燃),反应的化学方程式:
2.工业炼铁
①炼铁的设备:高炉
②炼铁的原料:铁炉石、焦炭、石灰石、空气。
③原料中石灰石的作用:除去铁矿石中
的杂质,使之成为炉渣。
④原料中焦炭的作用:与氧气反应放出
热量,与二氧化碳反应制备还原剂——
一氧化碳
⑤产品:生铁,及含碳量为2%~4.3%
的铁合金
3.工业炼铝
工业上采取电解法炼铝,反应的化学方程式
七、还原反应
1.定义:化学上把含氧化合物中的氧被夺去的反应叫做还原反应。例如反应: 中,Fe2O3—Fe,Fe2O3 中的氧被夺去,Fe2O3 发生了还原反应。
中CuO中的氧被夺去,CuO发生了还原反应。
2.氧化反应和还原反应的区别与联系
类型
氧化反应
还原反应
概念
物质与氧发生的反应
含氧化合物中的氧被夺去的反应
本质
得到氧
失去氧
联系
氧化还原反应是同时发生的
升失氧化还原剂
降得还原氧化剂
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
