8.3 海水制碱 课件(23张PPT)
文档属性
| 名称 | 8.3 海水制碱 课件(23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 657.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-22 00:00:00 | ||
图片预览








文档简介
“海水制碱”
①知识目标:a、使学生了解纯碱的物理性质;b、通过工业上氨碱法制碱理解饱和溶液及溶液中化学反应的特点;c、通过本节学习,使学生进一步理解分子、原子等概念及相互关系,并可进一步理解化学变化的实质。
②能力目标:a、培养学生的观察探究能力;b、培养学生宏观和微观相结合的分析探究能力。
③德育目标:a、通过侯氏制碱法对学生进行爱国主义教育。做到既教书,更育人。 b、培养学生实事求是的科学态度
1. 教学目标?
①教学重点:工业上氨碱法制碱的原理。
②教学难点?:掌握工业上氨碱法制碱的原理。
2. 教学重点、难点
二、教学过程
激情导入:
播放歌曲《大海呀故乡》
同学们喜欢这首歌吗?你喜欢大海吗?大海中除了波涛汹涌之外,她还能带给我们什么?请进入今天的学习《海水制碱》
海水中含量最多的盐是什么?
食盐 NaCl
还记得食盐的用途吗?
海水制碱是制什么碱?
你知道纯碱和烧碱吗?请观察两个实验,在两只试管中分别盛装1~2ml的氢氧化钠溶液和纯碱溶液,后分别滴加1~2滴无色的酚酞试液,观察现象。
纯碱又名苏打,口碱,化学式Na 2C O3属于盐类。
烧碱又名火碱,化学式Na OH,属于碱类。
用NaCl制Na 2C O3还需要含什么元素的物质?
碳元素 氧元素
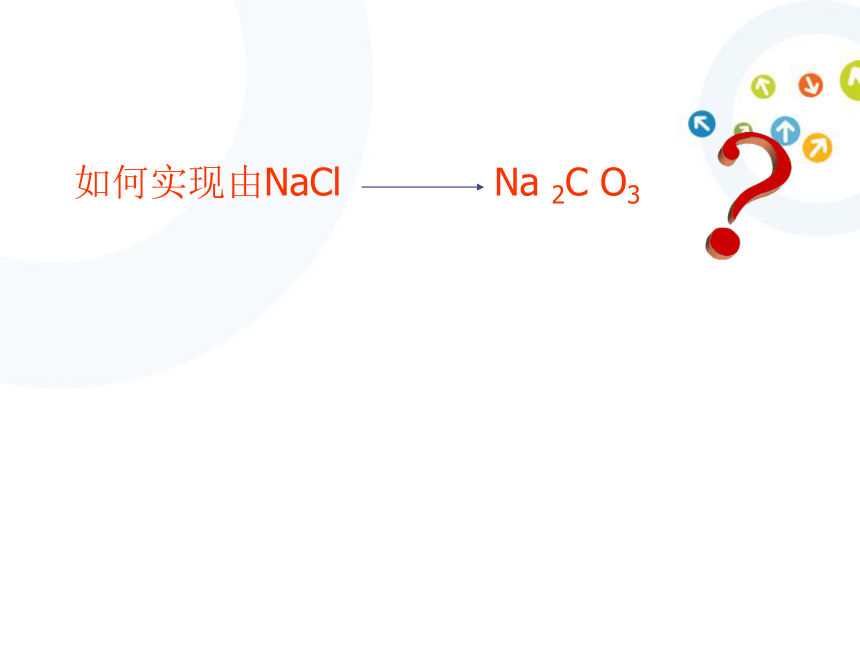
如何实现由NaCl Na 2C O3
?
NaCl﹢NH3﹢CO2﹢H2O﹦NaHCO3 ﹢ NH4Cl
2NaHCO3 = Na2CO3 ﹢ H2O ﹢ CO2↑
工业上制碱原理
△
精制 吸氨
碳酸化 过滤、热解
盐水
精盐水
氨盐水
碳酸氢钠
纯碱
工业上氨碱法制碱的流程
NaCl﹢NH3﹢CO2﹢H2O﹦NaHCO3 ﹢ NH4Cl
△
2NaHCO3 = Na2CO3 ﹢ H2O ﹢ CO2↑
为什么用氨盐水来吸收CO2 ?
氨盐水比食盐水更易吸收CO2。
二氧化碳溶于水生成碳酸,而氨盐水溶液显碱性,从酸碱中和的角度考虑氨盐水溶液更易二氧化碳。
氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
碳酸氢钠先结晶析出,因为它在该状态下的溶解度比氯化铵小,故先结晶析出。
NaCl﹢NH3﹢CO2﹢H2O﹦NaHCO3 ﹢ NH4Cl
△
2NaHCO3 = Na2CO3 ﹢ H2O ﹢ CO2↑
回收氨:
2NH4Cl ﹢ Ca(OH)2=CaCl2 ﹢ 2NH3 ↑ ﹢H2O
氨碱法制纯碱的优点是:
原料经济易得,CO2和NH3可回收利用,能连续生产。
缺点是:
氯化钠的利用率不高,回收氨时产生的大量CaCl2用处不大,并且污染环境
侯德榜
第一次世界大战期间,欧亚交通梗塞。由于我国所需纯碱都是从英国进口的,一时间,纯碱非常缺乏,一些以纯碱为原料的民族工业难以生存。1917年,爱国实业家范旭东在天津塘沽创办了永利碱业公司,决心打破洋人的垄断,生产出中国的纯碱。他聘请正在美国留学的侯德榜先生出任总工程师。
1920年,侯德榜先生毅然回国任职。他全身心地投入制碱工艺和设备的改进上,终于 摸索出了索尔维法的各项生产技术。1924年8月,塘沽碱厂正式投产。1926年,中国生产的“红三角”牌纯碱在美国费城的万国博览会上获得金质奖章。产品不但畅销国内,而且远销日本和东南亚。
侯氏制碱法
化学原理
侯氏制碱法又名联合制碱法
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3 ↓
加热
②2NaHCO3==Na2CO3+H2O+CO2↑
优点: 保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。
注:碱就是碳酸钠
二、纯碱的用途
石油精炼、粗盐精制、硬水软化、人造纤维及玻璃生产;冶金、造纸、纺织印染、洗涤剂生产
碳酸氢钠的俗名及用途
又名酸式碳酸钠。白色晶体,能溶于水;灭火器的原料,发酵粉的主要原料,治疗胃酸
谢谢!请多多指教!
①知识目标:a、使学生了解纯碱的物理性质;b、通过工业上氨碱法制碱理解饱和溶液及溶液中化学反应的特点;c、通过本节学习,使学生进一步理解分子、原子等概念及相互关系,并可进一步理解化学变化的实质。
②能力目标:a、培养学生的观察探究能力;b、培养学生宏观和微观相结合的分析探究能力。
③德育目标:a、通过侯氏制碱法对学生进行爱国主义教育。做到既教书,更育人。 b、培养学生实事求是的科学态度
1. 教学目标?
①教学重点:工业上氨碱法制碱的原理。
②教学难点?:掌握工业上氨碱法制碱的原理。
2. 教学重点、难点
二、教学过程
激情导入:
播放歌曲《大海呀故乡》
同学们喜欢这首歌吗?你喜欢大海吗?大海中除了波涛汹涌之外,她还能带给我们什么?请进入今天的学习《海水制碱》
海水中含量最多的盐是什么?
食盐 NaCl
还记得食盐的用途吗?
海水制碱是制什么碱?
你知道纯碱和烧碱吗?请观察两个实验,在两只试管中分别盛装1~2ml的氢氧化钠溶液和纯碱溶液,后分别滴加1~2滴无色的酚酞试液,观察现象。
纯碱又名苏打,口碱,化学式Na 2C O3属于盐类。
烧碱又名火碱,化学式Na OH,属于碱类。
用NaCl制Na 2C O3还需要含什么元素的物质?
碳元素 氧元素
如何实现由NaCl Na 2C O3
?
NaCl﹢NH3﹢CO2﹢H2O﹦NaHCO3 ﹢ NH4Cl
2NaHCO3 = Na2CO3 ﹢ H2O ﹢ CO2↑
工业上制碱原理
△
精制 吸氨
碳酸化 过滤、热解
盐水
精盐水
氨盐水
碳酸氢钠
纯碱
工业上氨碱法制碱的流程
NaCl﹢NH3﹢CO2﹢H2O﹦NaHCO3 ﹢ NH4Cl
△
2NaHCO3 = Na2CO3 ﹢ H2O ﹢ CO2↑
为什么用氨盐水来吸收CO2 ?
氨盐水比食盐水更易吸收CO2。
二氧化碳溶于水生成碳酸,而氨盐水溶液显碱性,从酸碱中和的角度考虑氨盐水溶液更易二氧化碳。
氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
碳酸氢钠先结晶析出,因为它在该状态下的溶解度比氯化铵小,故先结晶析出。
NaCl﹢NH3﹢CO2﹢H2O﹦NaHCO3 ﹢ NH4Cl
△
2NaHCO3 = Na2CO3 ﹢ H2O ﹢ CO2↑
回收氨:
2NH4Cl ﹢ Ca(OH)2=CaCl2 ﹢ 2NH3 ↑ ﹢H2O
氨碱法制纯碱的优点是:
原料经济易得,CO2和NH3可回收利用,能连续生产。
缺点是:
氯化钠的利用率不高,回收氨时产生的大量CaCl2用处不大,并且污染环境
侯德榜
第一次世界大战期间,欧亚交通梗塞。由于我国所需纯碱都是从英国进口的,一时间,纯碱非常缺乏,一些以纯碱为原料的民族工业难以生存。1917年,爱国实业家范旭东在天津塘沽创办了永利碱业公司,决心打破洋人的垄断,生产出中国的纯碱。他聘请正在美国留学的侯德榜先生出任总工程师。
1920年,侯德榜先生毅然回国任职。他全身心地投入制碱工艺和设备的改进上,终于 摸索出了索尔维法的各项生产技术。1924年8月,塘沽碱厂正式投产。1926年,中国生产的“红三角”牌纯碱在美国费城的万国博览会上获得金质奖章。产品不但畅销国内,而且远销日本和东南亚。
侯氏制碱法
化学原理
侯氏制碱法又名联合制碱法
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3 ↓
加热
②2NaHCO3==Na2CO3+H2O+CO2↑
优点: 保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。
注:碱就是碳酸钠
二、纯碱的用途
石油精炼、粗盐精制、硬水软化、人造纤维及玻璃生产;冶金、造纸、纺织印染、洗涤剂生产
碳酸氢钠的俗名及用途
又名酸式碳酸钠。白色晶体,能溶于水;灭火器的原料,发酵粉的主要原料,治疗胃酸
谢谢!请多多指教!
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
