科粤版(2012)初中化学 8.4 常用的盐第3课时 复分解反应发生的条件 课件(共25张PPT)
文档属性
| 名称 | 科粤版(2012)初中化学 8.4 常用的盐第3课时 复分解反应发生的条件 课件(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 419.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-22 21:58:00 | ||
图片预览






文档简介
(共25张PPT)
请判断下列化学反应类型:
1.
H2SO4+Zn=ZnSO4+H2↑
2.
C
+
O2
==
CO2
3.
2
KMnO4
==
K2MnO4
+
MnO2+
O2
↑
4.
BaCl2+Na2CO3
=
2NaCl+
BaCO3↓
二、复分解反应的概念:
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
。
表达式:AB
+
CD→
特
点:里应外合双交换,价不变
AD
+
CB
8.4.3复分解反应发生的条件
学习目标:
1.探讨(理解)复分解反应的条件
2.学会判断化学反应能否进行?
3.学会书写反应的化学方程式
4.盐的分类(关键记忆盐的溶解性)
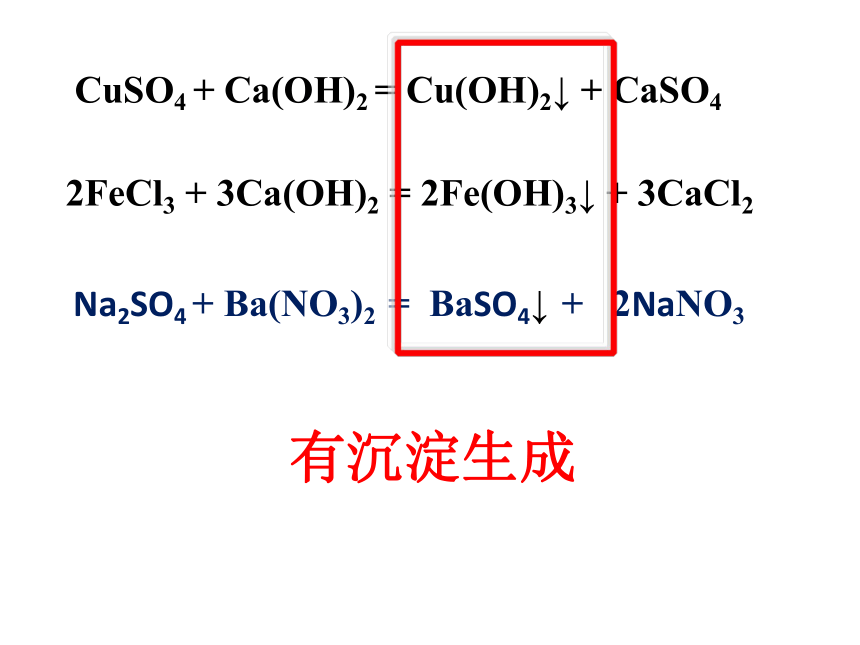
CuSO4
+
Ca(OH)2
=
Cu(OH)2↓
+
CaSO4
2FeCl3
+
3Ca(OH)2
=
2Fe(OH)3↓
+
3CaCl2
Na2SO4
+
Ba(NO3)2
=
BaSO4↓
+
2NaNO3
有沉淀生成
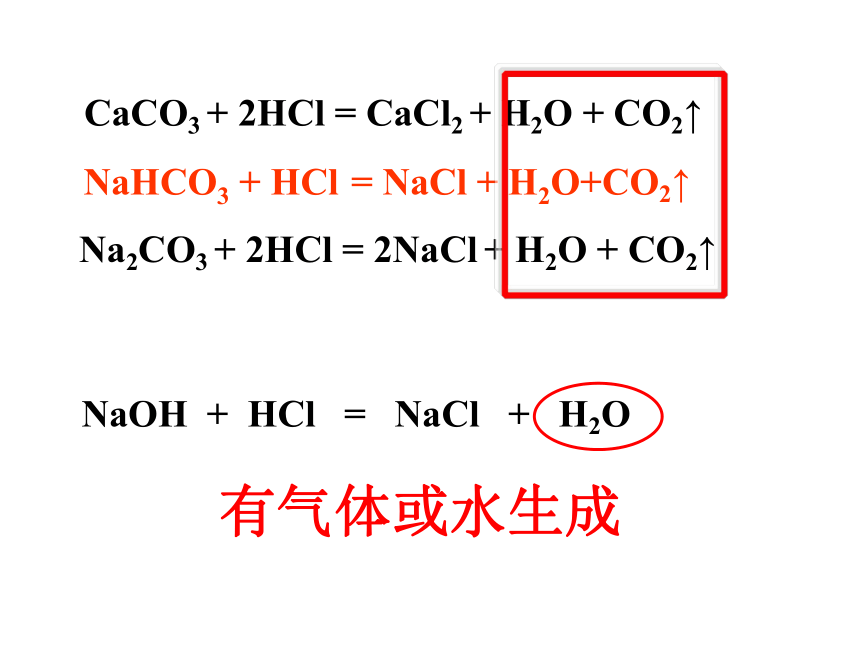
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
NaHCO3
+
HCl
=
NaCl
+
H2O+CO2↑
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
NaOH
+
HCl
=
NaCl
+
H2O
有气体或水生成
三、复分解反应发生的条件:
酸、碱、盐之间的反应都属复分解反应,但并不是任何酸、碱、盐之间都能发生复分解反应。生成物中要具备:
有沉淀
或有气体
或有水
三者必具其一即可发生
想一想:下列化学方程式是否正确?
KNO3+NaOH=NaNO3+KOH
X
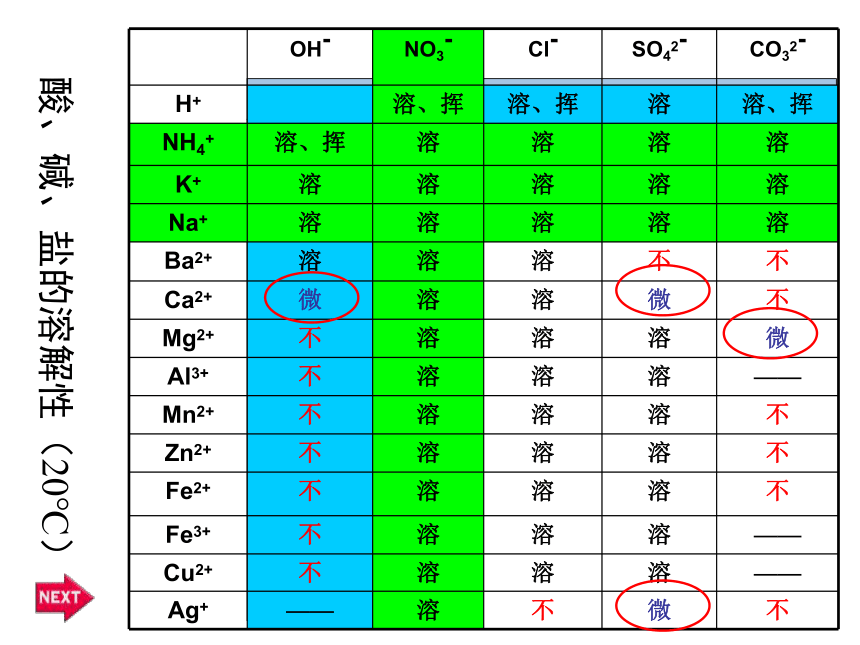
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
不
微
不
酸、碱、盐的溶解性(20℃)
温馨提示:
按是否完全中和分:
正盐:如NaCl、CuSO4、AgNO3等
酸式盐:如NaHCO3
、CaHCO3等
碱式盐:如Cu2(OH)2CO3
等
按所含酸根离子分:
读作“某酸盐”
盐酸盐:
NaCl、MgCl2
、BaCl2
碳酸盐:
Na2CO3
CaCO3、MgCO3
硫酸盐:
Na2SO4
CaSO4、BaSO4
硝酸盐:
NaNO3
Cu(NO3)2、Zn(NO3)2
按所含金属离子分:
钠盐、钾盐、钡盐、铜盐、铵盐等
NaCl、
K2SO4
、BaSO4、NH4NO3
四、物质溶解性口诀:
1、酸都
溶:
2、钾、钠、铵、硝溶水快;
K+
Na+
NH4+
NO3-
3、盐酸盐中(—
Cl)
氯化银
AgCl不可溶
4、硫酸盐中(—SO4)硫酸钡BaSO4不可溶。
5、碳酸盐(—CO3)
多数不溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
这些你都记住了吗?
判断下列反应能否进行?
FeCl3
+
NaOH
=
MgCl2
+
NaOH
=
AgNO3
+
HCl
=
AgNO3
+
NaCl
=
NaCl
+
NaOH
=
NaCl
+
HNO3=
提问???
是不是有水或有气体或有沉淀产生的一定是复分解反应?
小结:复分解反应发生的条件
只有当两种化合物交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
当碱和盐,盐和盐均可溶时,复分解反应才可以发生。
写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应
6HCl+2Fe2O3===2FeCl3+3H2O
Mg(OH)2+2HCl==MgCl2+2H2O
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
H2SO4+Na2CO3==Na2SO4+H2O+CO2↑
1、AgNO3
+
HCl
2、
K2CO3+
Ca(OH)2
3、Na2CO3+
CaCl2
4、Na2SO4
+
HCl
5、H2SO4
+
BaCl2
6、Ba(OH)2+
KCl
7、CuSO4
+
NH4NO3
8、HNO3
+
NaOH
AgCl↓+HNO3
CaCO3↓+2KOH
CaCO3↓+
2NaCl
不反应
BaSO4↓+
2HCl
不反应
不反应
NaNO3
+
H2O
2、断下列反应能否发生,若能反应,请完成化学反应方程式
【归纳】
常见的八大沉淀:
CaCO3
、BaCO3
、MgCO3
;BaSO4、AgCl
;(不溶于稀硝酸)
Mg(OH)2、Cu(OH)2
(蓝色)
、Fe(OH)3(红褐色)
三、巩固提升
题型一:写出正确的方程式
海水中除了含有氯化钠之外还含有氯化镁,我们可以从海水中提取金属镁。原料是海水和海边的贝壳(主要成分碳酸钙)。从海水中提取镁最基本的方法就是往海水里加碱,得到氢氧化镁沉淀,将沉淀分离出来后再加入盐酸把它变氯成化镁;然后经过滤、干燥、电解,就可得到金属镁
(1)贝壳起到提供碱-消石灰的作用。主要成分发生的化学反应有:???????,????????。
(2)写出产生氢氧化镁沉淀的反应:????????????????。
(3)写出加盐酸生成氯化镁的反应:?????????????
1.下列试剂中,能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别
出来的是
(
B
)
A
.KCl溶液
B.K2CO3溶液
C.NaNO3溶液
D.稀盐酸
2.
用下列方法鉴别各组无色溶液,能够达到目的的是
(
D
)
待鉴别溶液
试剂(均为溶液)
A
HNO3和KNO3
酚酞
B
HCl和NaCl
AgNO3
C
AgNO3和Na2SO4
BaCl2
D
Ca(OH)2和NaOH
Na2CO3
题型二:鉴别
3.
现有①NaCl、②Mg(NO3)2、③NaOH、④FeCl3四种溶液,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是
(
)
A.④②③①
B.④③②①
C.④②①③
D.③④①②
[解题要点]
完成鉴别题时,首先考虑物质本身的颜色,其次考虑发生化学反应时出现的特殊现象,如产生气体、沉淀、指示剂颜色变化等。
B
题型三:除杂
除去下列物质中混有的杂质,所选用的试剂及操作方法均正确(
)
物质
杂质
除杂质应选用的试剂和操作方法
A
CaO
CaCO3
加入足量的水充分溶解后,过滤、蒸发
B
NaCl固体
Na2CO3固体
加入过量盐酸,蒸发
C
KNO3溶液
KOH溶液
加入适量的CuSO4溶液,过滤
D
Cu(NO3)2溶液
AgNO3溶液
加入过量的铜粉,过滤
B
D
2.
除去下列物质中的少量杂质(括号内是杂质),所用试剂及方法正确的是(
)
A.硝酸钾(碳酸钾)——加盐酸
B.氯化亚铁溶液(氯化铜)——加过量的铁粉、过滤
C.氢氧化钠(碳酸钠)——加适量的稀盐酸、蒸发
D.氯化钠(氢氧化钡)——加硫酸钠
【解题要点]
利用化学方法除杂时,要注意三个方面:
1.
所加试剂只与杂质反应,不与被提纯
物反应;
2.
不引入新的杂质;
3.
最好将杂质转化为提纯物。同时也要注意观察所加试剂的量是适量还是过量
B
题型四:物质推断
有一包白色粉末,可能含有FeCl3、CuSO4、Na2SO4、MgCl2
、NaCl、Na2CO3中的一种或几种,现做下列实验:
a.取少量粉末,加水溶解得无色透明溶液,推断:不可能存在
;
b.在上述溶液中,加NaOH溶液,看不到变化,推断:
不可能存在
c.另取少量固体加盐酸,看不到任何变化,推断:不可能存在_______
从以上实验得出该固体粉末可能含有____________
【解题要点】解决推断题,首先要寻找题目的突破口。常用的突破口有物质本身特殊的颜色,反应时的特殊现象,特殊的条件等
FeCl3
CuSO4
MgCl2
Na2CO3
Na2SO4
NaCl
总结本节课的收获
作业
请判断下列化学反应类型:
1.
H2SO4+Zn=ZnSO4+H2↑
2.
C
+
O2
==
CO2
3.
2
KMnO4
==
K2MnO4
+
MnO2+
O2
↑
4.
BaCl2+Na2CO3
=
2NaCl+
BaCO3↓
二、复分解反应的概念:
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
。
表达式:AB
+
CD→
特
点:里应外合双交换,价不变
AD
+
CB
8.4.3复分解反应发生的条件
学习目标:
1.探讨(理解)复分解反应的条件
2.学会判断化学反应能否进行?
3.学会书写反应的化学方程式
4.盐的分类(关键记忆盐的溶解性)
CuSO4
+
Ca(OH)2
=
Cu(OH)2↓
+
CaSO4
2FeCl3
+
3Ca(OH)2
=
2Fe(OH)3↓
+
3CaCl2
Na2SO4
+
Ba(NO3)2
=
BaSO4↓
+
2NaNO3
有沉淀生成
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
NaHCO3
+
HCl
=
NaCl
+
H2O+CO2↑
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
NaOH
+
HCl
=
NaCl
+
H2O
有气体或水生成
三、复分解反应发生的条件:
酸、碱、盐之间的反应都属复分解反应,但并不是任何酸、碱、盐之间都能发生复分解反应。生成物中要具备:
有沉淀
或有气体
或有水
三者必具其一即可发生
想一想:下列化学方程式是否正确?
KNO3+NaOH=NaNO3+KOH
X
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
不
微
不
酸、碱、盐的溶解性(20℃)
温馨提示:
按是否完全中和分:
正盐:如NaCl、CuSO4、AgNO3等
酸式盐:如NaHCO3
、CaHCO3等
碱式盐:如Cu2(OH)2CO3
等
按所含酸根离子分:
读作“某酸盐”
盐酸盐:
NaCl、MgCl2
、BaCl2
碳酸盐:
Na2CO3
CaCO3、MgCO3
硫酸盐:
Na2SO4
CaSO4、BaSO4
硝酸盐:
NaNO3
Cu(NO3)2、Zn(NO3)2
按所含金属离子分:
钠盐、钾盐、钡盐、铜盐、铵盐等
NaCl、
K2SO4
、BaSO4、NH4NO3
四、物质溶解性口诀:
1、酸都
溶:
2、钾、钠、铵、硝溶水快;
K+
Na+
NH4+
NO3-
3、盐酸盐中(—
Cl)
氯化银
AgCl不可溶
4、硫酸盐中(—SO4)硫酸钡BaSO4不可溶。
5、碳酸盐(—CO3)
多数不溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
这些你都记住了吗?
判断下列反应能否进行?
FeCl3
+
NaOH
=
MgCl2
+
NaOH
=
AgNO3
+
HCl
=
AgNO3
+
NaCl
=
NaCl
+
NaOH
=
NaCl
+
HNO3=
提问???
是不是有水或有气体或有沉淀产生的一定是复分解反应?
小结:复分解反应发生的条件
只有当两种化合物交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
当碱和盐,盐和盐均可溶时,复分解反应才可以发生。
写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应
6HCl+2Fe2O3===2FeCl3+3H2O
Mg(OH)2+2HCl==MgCl2+2H2O
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
H2SO4+Na2CO3==Na2SO4+H2O+CO2↑
1、AgNO3
+
HCl
2、
K2CO3+
Ca(OH)2
3、Na2CO3+
CaCl2
4、Na2SO4
+
HCl
5、H2SO4
+
BaCl2
6、Ba(OH)2+
KCl
7、CuSO4
+
NH4NO3
8、HNO3
+
NaOH
AgCl↓+HNO3
CaCO3↓+2KOH
CaCO3↓+
2NaCl
不反应
BaSO4↓+
2HCl
不反应
不反应
NaNO3
+
H2O
2、断下列反应能否发生,若能反应,请完成化学反应方程式
【归纳】
常见的八大沉淀:
CaCO3
、BaCO3
、MgCO3
;BaSO4、AgCl
;(不溶于稀硝酸)
Mg(OH)2、Cu(OH)2
(蓝色)
、Fe(OH)3(红褐色)
三、巩固提升
题型一:写出正确的方程式
海水中除了含有氯化钠之外还含有氯化镁,我们可以从海水中提取金属镁。原料是海水和海边的贝壳(主要成分碳酸钙)。从海水中提取镁最基本的方法就是往海水里加碱,得到氢氧化镁沉淀,将沉淀分离出来后再加入盐酸把它变氯成化镁;然后经过滤、干燥、电解,就可得到金属镁
(1)贝壳起到提供碱-消石灰的作用。主要成分发生的化学反应有:???????,????????。
(2)写出产生氢氧化镁沉淀的反应:????????????????。
(3)写出加盐酸生成氯化镁的反应:?????????????
1.下列试剂中,能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别
出来的是
(
B
)
A
.KCl溶液
B.K2CO3溶液
C.NaNO3溶液
D.稀盐酸
2.
用下列方法鉴别各组无色溶液,能够达到目的的是
(
D
)
待鉴别溶液
试剂(均为溶液)
A
HNO3和KNO3
酚酞
B
HCl和NaCl
AgNO3
C
AgNO3和Na2SO4
BaCl2
D
Ca(OH)2和NaOH
Na2CO3
题型二:鉴别
3.
现有①NaCl、②Mg(NO3)2、③NaOH、④FeCl3四种溶液,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是
(
)
A.④②③①
B.④③②①
C.④②①③
D.③④①②
[解题要点]
完成鉴别题时,首先考虑物质本身的颜色,其次考虑发生化学反应时出现的特殊现象,如产生气体、沉淀、指示剂颜色变化等。
B
题型三:除杂
除去下列物质中混有的杂质,所选用的试剂及操作方法均正确(
)
物质
杂质
除杂质应选用的试剂和操作方法
A
CaO
CaCO3
加入足量的水充分溶解后,过滤、蒸发
B
NaCl固体
Na2CO3固体
加入过量盐酸,蒸发
C
KNO3溶液
KOH溶液
加入适量的CuSO4溶液,过滤
D
Cu(NO3)2溶液
AgNO3溶液
加入过量的铜粉,过滤
B
D
2.
除去下列物质中的少量杂质(括号内是杂质),所用试剂及方法正确的是(
)
A.硝酸钾(碳酸钾)——加盐酸
B.氯化亚铁溶液(氯化铜)——加过量的铁粉、过滤
C.氢氧化钠(碳酸钠)——加适量的稀盐酸、蒸发
D.氯化钠(氢氧化钡)——加硫酸钠
【解题要点]
利用化学方法除杂时,要注意三个方面:
1.
所加试剂只与杂质反应,不与被提纯
物反应;
2.
不引入新的杂质;
3.
最好将杂质转化为提纯物。同时也要注意观察所加试剂的量是适量还是过量
B
题型四:物质推断
有一包白色粉末,可能含有FeCl3、CuSO4、Na2SO4、MgCl2
、NaCl、Na2CO3中的一种或几种,现做下列实验:
a.取少量粉末,加水溶解得无色透明溶液,推断:不可能存在
;
b.在上述溶液中,加NaOH溶液,看不到变化,推断:
不可能存在
c.另取少量固体加盐酸,看不到任何变化,推断:不可能存在_______
从以上实验得出该固体粉末可能含有____________
【解题要点】解决推断题,首先要寻找题目的突破口。常用的突破口有物质本身特殊的颜色,反应时的特殊现象,特殊的条件等
FeCl3
CuSO4
MgCl2
Na2CO3
Na2SO4
NaCl
总结本节课的收获
作业
