高中化学人教版(2019)必修第一册第1章第3节氧化还原反应第一课时(26张)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册第1章第3节氧化还原反应第一课时(26张) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-23 21:53:59 | ||
图片预览








文档简介
(共26张PPT)
氧化还原反应
(第一课时)
物质
变化
自主学习
学科观念:分类、元素、变化、价态观
根据已学知识分析下列两个反应:
2CuO+C 2Cu+CO2; 2Fe2O3+3CO 4Fe+3CO2
1、完成表格 2、标出各物质所含元素的化合价
物质 反应物 发生的反应(氧化或还原反应)
得氧物质
失氧物质
C CO
氧化反应
CuO Fe2O3
还原反应
知识回顾
铜在氧气中燃烧
铁丝在氧气中燃烧
硫在氧气中燃烧
3Fe+2O2
Fe3O4
2Cu+O2
2CuO
SO2
S+O2
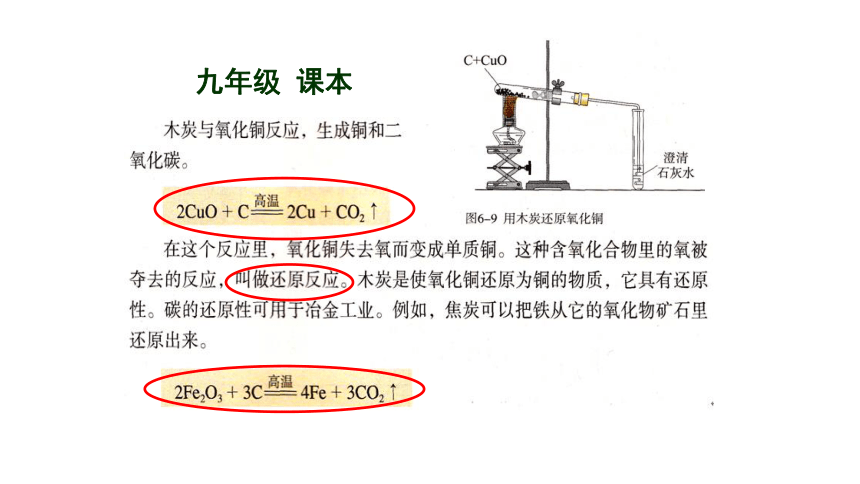
九年级 课本
1、结合初中所学知识,分析总结氧化反应和还原反应的物质变化有什么特征?
2、下列变化中没有发生氧化或还原反应的是( )
氧化反应:有氧气参加反应
还原反应:有O元素得失
A. Mg→MgO B. H2→H2O
C.CaCO3 →CO2 D. Fe2O3→Fe
反应分类的方法模型
概念模型应用
C
氧化还原反应的特征
氧化还原的概念
Cu
Cu
C
还原反应
CO2
O
O
Cu
氧化反应
2CuO + C 2Cu + CO2
△
得氧,被氧化
失氧,被还原
化合价升高,
化合价降低,
O
+2 0
0 +4
问题1—1:通过分析元素价态变化,指出化合价的升降、氧化还原反应相互之间有什么关系?
问题1—2:如何判断一个反应是否是氧化还原反应?
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
氧化还原反应一定有元素的化合价变化(升降)
对立统一辩证思想
氧化还原特征
氧化还原反应的本质
【思考1】下列反应是否属于氧化还原反应?
(2)2Na+Cl2 2NaCl
(3)H2+Cl2 2HCl
(4)Zn+H2SO4=ZnSO4+H2↑
(5)H2SO4+2NaOH=Na2SO4+2H2O
【模型应用】氧化还原反应的特征
(6)2H2O2 2H2O+O2↑
(1)CH4+2O2 CO2+2H2O
〖思考交流〗
1.请你从原子结构变化角度解释氯化钠、氯化氢的形成过程。
2.请你解释上述两种化合物形成过程中元素化合价变化的实质是什么?
分析得氧失氧→发现化合价升降→原因?
2Na+Cl2 2NaCl
0 0 +1 -1
Na
+11
8
1
2
+11
8
2
Na+
e
Cl
+17
8
7
2
Cl
+17
8
8
2
Na+
Cl
失去2×e-
得到2×e-
H
+1
1
Cl
+17
8
7
2
H2+Cl2 2HCl
0 0 +1 -1
e
e
H
氧化还原反应的本质
2Na+Cl2 2NaCl
宏观辨识
微观探析
实验室制取氢气
Zn+H2SO4=ZnSO4+H2↑
Zn+2H+ = Zn2+ + H2↑
2e
实验过程 操作装置 现象 解释
①
②
实验结论 【实验原理】
无明显现象
Cu不能与稀硫酸反应
Zn表面的电子通过导线被引导到铜片上给了H+
电流计指针偏转
铜片上产生气泡
氧化还原反应中有电子的转移
概念 从化合价升降角度 从电子转移角度
氧化反应
还原反应
CuO+H2 Cu+H2O
△
化合价升高,被氧化
化合价降低,被还原
得电子,
失电子,
化合价升高的反应
化合价降低的反应
失去电子(共用电子对偏离)的反应
得到电子(共用电子对偏向)的反应
【小结】
基本反映类型与氧化还原关系
【思考2】分析主题一【思考1】中的反应的反应类型,将序号填入下表,并进行完善,尝试画出四种基本反应类型与氧化还原反应的关系示意图。
反应类型 反应序号 初中所学反应的化学方程式 是否是氧化还原反应
置换反应 (4) Fe+CuSO4=FeSO4+Cu
分解反应 (6)
化合反应 (2)(3) CaO+H2O=Ca(OH)2
复分解反应 (5) CaCO3+2HCl=CaCO3+CO2↑+H2O
CaCO3 CaO+CO2↑
高温
是
否
否
否
S + 2KNO3 + 3C = K2S + N2↑+ 3CO2↑
氧化还原反应的价值
N2H4+O2=N2+2H2O
-2 +1
2H2+O2=2H2O
氢能源汽车
CO+NO N2+CO2
催化剂
感受氧化还原反应的价值
化学来源于生活
化学服务于生活
【练习】1.下列关于氧化还原反应的说法中正确的是 ( )
A.氧化还原反应前后一定有氧的得失
B.反应中某种元素的化合价升高,则该反应一定是氧化还原反应
C.实现Fe3+→Fe2+的变化过程一定是氧化反应
D.氧化还原反应中一定有电子的得失
2.下列反应中一定属于氧化还原反应的是 ( )
A. 2NaHCO3 Na2CO3+H2O+CO2↑ B. 有单质参与的反应
C. NaH+H2O=H2↑+NaOH D. 实验室制CO2
3.下列反应中电子转移的表示方法正确的是 ( )
A. B.
C. D.
B
C
B
总结
氧化还原模型
氧化反应:化合价升高 — 失去电子 — 被氧化
特征
本质
变化
还原反应:化合价降低 — 得到电子 — 被还原
现象——本质
宏观——微观
化学学科观念
化学改变生活知识创造价值
氧化还原反应
(第一课时)
物质
变化
自主学习
学科观念:分类、元素、变化、价态观
根据已学知识分析下列两个反应:
2CuO+C 2Cu+CO2; 2Fe2O3+3CO 4Fe+3CO2
1、完成表格 2、标出各物质所含元素的化合价
物质 反应物 发生的反应(氧化或还原反应)
得氧物质
失氧物质
C CO
氧化反应
CuO Fe2O3
还原反应
知识回顾
铜在氧气中燃烧
铁丝在氧气中燃烧
硫在氧气中燃烧
3Fe+2O2
Fe3O4
2Cu+O2
2CuO
SO2
S+O2
九年级 课本
1、结合初中所学知识,分析总结氧化反应和还原反应的物质变化有什么特征?
2、下列变化中没有发生氧化或还原反应的是( )
氧化反应:有氧气参加反应
还原反应:有O元素得失
A. Mg→MgO B. H2→H2O
C.CaCO3 →CO2 D. Fe2O3→Fe
反应分类的方法模型
概念模型应用
C
氧化还原反应的特征
氧化还原的概念
Cu
Cu
C
还原反应
CO2
O
O
Cu
氧化反应
2CuO + C 2Cu + CO2
△
得氧,被氧化
失氧,被还原
化合价升高,
化合价降低,
O
+2 0
0 +4
问题1—1:通过分析元素价态变化,指出化合价的升降、氧化还原反应相互之间有什么关系?
问题1—2:如何判断一个反应是否是氧化还原反应?
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
氧化还原反应一定有元素的化合价变化(升降)
对立统一辩证思想
氧化还原特征
氧化还原反应的本质
【思考1】下列反应是否属于氧化还原反应?
(2)2Na+Cl2 2NaCl
(3)H2+Cl2 2HCl
(4)Zn+H2SO4=ZnSO4+H2↑
(5)H2SO4+2NaOH=Na2SO4+2H2O
【模型应用】氧化还原反应的特征
(6)2H2O2 2H2O+O2↑
(1)CH4+2O2 CO2+2H2O
〖思考交流〗
1.请你从原子结构变化角度解释氯化钠、氯化氢的形成过程。
2.请你解释上述两种化合物形成过程中元素化合价变化的实质是什么?
分析得氧失氧→发现化合价升降→原因?
2Na+Cl2 2NaCl
0 0 +1 -1
Na
+11
8
1
2
+11
8
2
Na+
e
Cl
+17
8
7
2
Cl
+17
8
8
2
Na+
Cl
失去2×e-
得到2×e-
H
+1
1
Cl
+17
8
7
2
H2+Cl2 2HCl
0 0 +1 -1
e
e
H
氧化还原反应的本质
2Na+Cl2 2NaCl
宏观辨识
微观探析
实验室制取氢气
Zn+H2SO4=ZnSO4+H2↑
Zn+2H+ = Zn2+ + H2↑
2e
实验过程 操作装置 现象 解释
①
②
实验结论 【实验原理】
无明显现象
Cu不能与稀硫酸反应
Zn表面的电子通过导线被引导到铜片上给了H+
电流计指针偏转
铜片上产生气泡
氧化还原反应中有电子的转移
概念 从化合价升降角度 从电子转移角度
氧化反应
还原反应
CuO+H2 Cu+H2O
△
化合价升高,被氧化
化合价降低,被还原
得电子,
失电子,
化合价升高的反应
化合价降低的反应
失去电子(共用电子对偏离)的反应
得到电子(共用电子对偏向)的反应
【小结】
基本反映类型与氧化还原关系
【思考2】分析主题一【思考1】中的反应的反应类型,将序号填入下表,并进行完善,尝试画出四种基本反应类型与氧化还原反应的关系示意图。
反应类型 反应序号 初中所学反应的化学方程式 是否是氧化还原反应
置换反应 (4) Fe+CuSO4=FeSO4+Cu
分解反应 (6)
化合反应 (2)(3) CaO+H2O=Ca(OH)2
复分解反应 (5) CaCO3+2HCl=CaCO3+CO2↑+H2O
CaCO3 CaO+CO2↑
高温
是
否
否
否
S + 2KNO3 + 3C = K2S + N2↑+ 3CO2↑
氧化还原反应的价值
N2H4+O2=N2+2H2O
-2 +1
2H2+O2=2H2O
氢能源汽车
CO+NO N2+CO2
催化剂
感受氧化还原反应的价值
化学来源于生活
化学服务于生活
【练习】1.下列关于氧化还原反应的说法中正确的是 ( )
A.氧化还原反应前后一定有氧的得失
B.反应中某种元素的化合价升高,则该反应一定是氧化还原反应
C.实现Fe3+→Fe2+的变化过程一定是氧化反应
D.氧化还原反应中一定有电子的得失
2.下列反应中一定属于氧化还原反应的是 ( )
A. 2NaHCO3 Na2CO3+H2O+CO2↑ B. 有单质参与的反应
C. NaH+H2O=H2↑+NaOH D. 实验室制CO2
3.下列反应中电子转移的表示方法正确的是 ( )
A. B.
C. D.
B
C
B
总结
氧化还原模型
氧化反应:化合价升高 — 失去电子 — 被氧化
特征
本质
变化
还原反应:化合价降低 — 得到电子 — 被还原
现象——本质
宏观——微观
化学学科观念
化学改变生活知识创造价值
