化学人教版(2019)必修第一册第1章第2节离子反应第一课时(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册第1章第2节离子反应第一课时(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 992.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-22 22:55:32 | ||
图片预览








文档简介
(共28张PPT)
离子反应
第一课时
新课引入
许多化学反应是在水溶液中进行的,而参加反应的物质主要是酸、碱、盐。所以我们有必要对酸、碱、盐在水溶液中反应的特点和规律进行研究。
知识回顾
思考:
1、酸、碱、盐溶于水后发生了什么变化?
2、水溶液中这些物质之间的反应有什么特点呢?
3、生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。这是为什么呢?
宏观现象---微观实质
很多物质固态不导电时,在水溶液中导电
电解质的概念
实验探究观察宏观现象
【实验1-2】
问题1-1、观察实验现象,得出怎样的结论?
问题1-2、除了水溶液实验中的固体在什么条件下还能导电?
问题1-3、哪类物质可以在这些条件下导电?
完成课本P13实验,并思考下列问题:
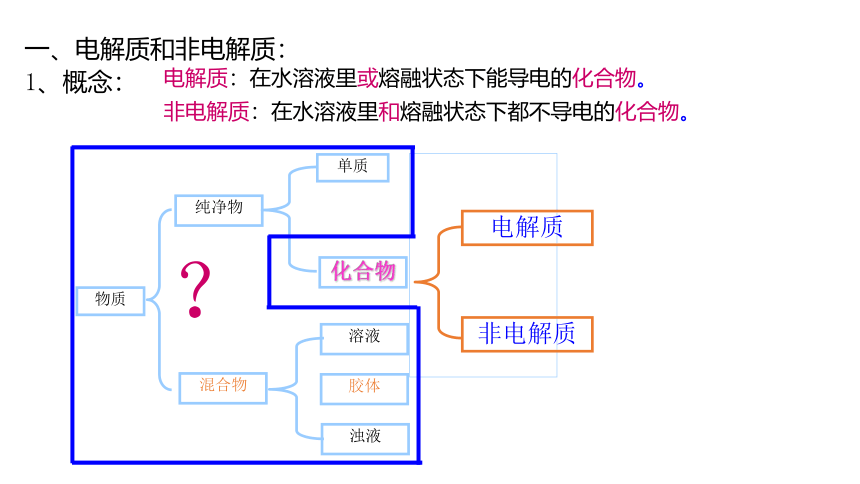
一、电解质和非电解质:
1、概念:
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液里和熔融状态下都不导电的化合物。
物质
纯净物
混合物
单质
化合物
溶液
胶体
浊液
电解质
非电解质
?
酸:
HCl、HNO3、H2SO4
、H2CO3
等
碱:
NaOH、KOH、NH3·H2O等
盐:
NaCl、
AgNO3、BaSO4等
活泼金属氧化物:Na2O、MgO、CaO等
水
非金属氧化物:CO、
CO2、SO3
等
非酸性气态氢化物:
NH3等
大多数有机物:
CH4、蔗糖、酒精等
常见的电解质:
常见的非电解质:
例1:
下列哪些属于电解质?
①KNO3
②NaOH
③H2SO4
④Fe
⑤H2O
⑥CO2
⑦CH4
⑧NaCl溶液⑨
BaSO4
⑩NH3
例2:下列说法正确吗?
1.电解质一定能导电,能导电的一定是电解质;
2.氯化钠和铁都能导电,它们都是电解质;
3.碳酸钙难溶于水,它是非电解质;
4.二氧化碳溶于水能导电,它是电解质;
①
②
③
⑤
⑨
电解质的电离
问题2-1:导电的实质是什么?
问题2-2:金属导电和电解质溶液或者熔融状态的电解质导电有何不同?
有自由移动的带电粒子
金属导电是因为有自由移动的电子;溶液导电的原因是因为其中存在自由移动的离子。
宏观现象
阅读课本思考下列问题:
微观实质
问题2-3:为什么固体氯化钠不导电?
因为正负电荷相互吸引,虽有离子,但不自由移动
证据推理
氯化钠加入水:
模型认知
氯化钠水溶液和熔融状态下导电过程:
强电解质:在水溶液中或熔融状态下全部电离成离子的电解质。
弱电解质:在水溶液中或熔融状态下部分电离成离子的电解质。
强电解质和弱电解质
二、电离:
电解质在水溶液里或熔融状态下产生自由移动离子的过程。
常见的强电解质:
强酸:
HCl、HNO3、H2SO4、HClO4、HBr、HI
强碱:
NaOH、KOH、Ba(OH)2、Ca(OH)2
大多数盐:
NaCl、
AgNO3、BaSO4等
常见的弱电解质:
弱酸:H2CO3
、CH3COOH、H2S、HF等
弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等
水
注意:
④
电解质的电离必须是自身的电离。如CO2、SO2、SO3、NH3的水溶液能导电,但不是它们本身电离导电,不是电解质。
①
电解质导电的条件:熔化状态或水溶液中。其他条件不一定导电,如固态NaCl,气态HCl;
②
单质、混合物既不是电解质也不是非电解质;
③
电解质的判断与它的溶解度大小无关。某些难溶物,由于溶解度很小,所以测不出它们的导电性,但它们熔融状态下能导电,所以属于电解质;
判断物质是否属于电解质:
一看:是不是化合物;
二看:是不是导电;(熔化或水溶液中)
三看:是不是自身电离。
电解质
非电解质
化合物
酸、碱、盐、水和许多金属氧化物。
大多数非金属氧化物;大多数有机物,如蔗糖、酒精等。
BaSO4、CaCO3、AgCl等难溶于水的盐是否属弱电解质?
CH3COOH易溶,是否属强电解质?
强电解质的溶液导电能力一定强吗?
思考:
注意:①电解质的强弱和其溶解度无必然联系;
②强电解质的导电能力不一定比弱电解质能力强,导电能力与浓度和离子所带的电荷数有关。
下列物质中属于强电解质的是_____________
属于弱电解质的是_____________
①NaCl
②NH3
③Cl2
④BaSO4
⑤HCl
⑥CH3COOH
⑦
H2S
⑧NaHCO3
⑨Cu(OH)2
⑩Cu
⑾HF
⑿蔗糖
⒀乙醇溶液
⒁SO2
⒂Na2O
例题:
用化学符号表示电解质电离过程的式子
电离方程式:
NaCl
Na+
+
Cl—
电离方程式书写要求:
①强电解质用“
”连接
②弱电解质用“
连接
③多元弱酸分步电离
④多元弱碱一步写完
⑤强酸酸式盐完全电离:NaHSO4
⑥弱酸酸式盐保留酸式酸根:NaHCO3、NaHS
注意:
电离方程式左右两边正负电荷之和相等。
强电解质
弱电解质
定义
物质类型
电离程度
电离过程
存在微粒
实例
方程式
水溶液或熔融全部电离
水溶液或熔融部分电离
完全电离
部分电离
阴、阳离子
阴阳离子、分子
强酸、强碱、大部分盐
弱酸、弱碱、水
可逆过程
不可逆
HF
H+
+F-
NaOH
Na++OH-
NaCl
HCl
NaOH
HF
\氨水\
水
对比填表:
从电离角度认识酸、碱、盐
物质
纯净物
混合物
单质
化合物
非电解质
强电解质
弱电解质
强酸:HCl、HNO3、
H2SO4等
强碱:KOH、NaOH、
Ca(OH)2、Ba(OH)2
多数盐:
NaNO3、
NaCl、BaSO4等
弱酸:
CH3COOH
、
H3PO4
、H2CO3等
弱碱:NH3?H2O等
水
:CO2、SO2、NH3、蔗糖、酒精
总结:物质的分类
练习:
1、下列电离方程式正确的是(
)
A.
Al2(SO4)3=2Al3+
+3SO4
2-
B.MgCl2=Mg2+
+Cl2-
C.Ba(OH)2=Ba2++2(OH)-
D.Na2CO3
=
2Na++CO32-
2、下列属于电解质的是(
)
CO2
、
SO3
、
P2O5
Cu
、
Al、
石墨、
酒精
、
蔗糖等
NaCl溶液
BaSO4
Cu(OH)
2
B.
C.
D.
AgCl
3、下列物质中,其水溶液能导电,但属于非电解质的是(
)
A、CH3COOH
B、Cl2
C、NH4HCO3
D、SO2
A.
4.写出下列物质在水溶液中的电离方程式
H2SO4、NaOH、
Ba(OH)2
、Fe2(SO4)3
、
NaHSO4
、
NaHCO3、NH3·H2O、Fe(OH)2、Na2CO3
5.下列电离方程式正确的是(
)
A、MgCl2
Mg2+
+
Cl2—
B、
CH3COOH
H
+
+
CH3COO—
C、
H2CO3
2H
+
+
CO32—
D、
Ba(OH)2
Ba2+
+2OH—
谢谢大家!
离子反应
第一课时
新课引入
许多化学反应是在水溶液中进行的,而参加反应的物质主要是酸、碱、盐。所以我们有必要对酸、碱、盐在水溶液中反应的特点和规律进行研究。
知识回顾
思考:
1、酸、碱、盐溶于水后发生了什么变化?
2、水溶液中这些物质之间的反应有什么特点呢?
3、生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。这是为什么呢?
宏观现象---微观实质
很多物质固态不导电时,在水溶液中导电
电解质的概念
实验探究观察宏观现象
【实验1-2】
问题1-1、观察实验现象,得出怎样的结论?
问题1-2、除了水溶液实验中的固体在什么条件下还能导电?
问题1-3、哪类物质可以在这些条件下导电?
完成课本P13实验,并思考下列问题:
一、电解质和非电解质:
1、概念:
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液里和熔融状态下都不导电的化合物。
物质
纯净物
混合物
单质
化合物
溶液
胶体
浊液
电解质
非电解质
?
酸:
HCl、HNO3、H2SO4
、H2CO3
等
碱:
NaOH、KOH、NH3·H2O等
盐:
NaCl、
AgNO3、BaSO4等
活泼金属氧化物:Na2O、MgO、CaO等
水
非金属氧化物:CO、
CO2、SO3
等
非酸性气态氢化物:
NH3等
大多数有机物:
CH4、蔗糖、酒精等
常见的电解质:
常见的非电解质:
例1:
下列哪些属于电解质?
①KNO3
②NaOH
③H2SO4
④Fe
⑤H2O
⑥CO2
⑦CH4
⑧NaCl溶液⑨
BaSO4
⑩NH3
例2:下列说法正确吗?
1.电解质一定能导电,能导电的一定是电解质;
2.氯化钠和铁都能导电,它们都是电解质;
3.碳酸钙难溶于水,它是非电解质;
4.二氧化碳溶于水能导电,它是电解质;
①
②
③
⑤
⑨
电解质的电离
问题2-1:导电的实质是什么?
问题2-2:金属导电和电解质溶液或者熔融状态的电解质导电有何不同?
有自由移动的带电粒子
金属导电是因为有自由移动的电子;溶液导电的原因是因为其中存在自由移动的离子。
宏观现象
阅读课本思考下列问题:
微观实质
问题2-3:为什么固体氯化钠不导电?
因为正负电荷相互吸引,虽有离子,但不自由移动
证据推理
氯化钠加入水:
模型认知
氯化钠水溶液和熔融状态下导电过程:
强电解质:在水溶液中或熔融状态下全部电离成离子的电解质。
弱电解质:在水溶液中或熔融状态下部分电离成离子的电解质。
强电解质和弱电解质
二、电离:
电解质在水溶液里或熔融状态下产生自由移动离子的过程。
常见的强电解质:
强酸:
HCl、HNO3、H2SO4、HClO4、HBr、HI
强碱:
NaOH、KOH、Ba(OH)2、Ca(OH)2
大多数盐:
NaCl、
AgNO3、BaSO4等
常见的弱电解质:
弱酸:H2CO3
、CH3COOH、H2S、HF等
弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等
水
注意:
④
电解质的电离必须是自身的电离。如CO2、SO2、SO3、NH3的水溶液能导电,但不是它们本身电离导电,不是电解质。
①
电解质导电的条件:熔化状态或水溶液中。其他条件不一定导电,如固态NaCl,气态HCl;
②
单质、混合物既不是电解质也不是非电解质;
③
电解质的判断与它的溶解度大小无关。某些难溶物,由于溶解度很小,所以测不出它们的导电性,但它们熔融状态下能导电,所以属于电解质;
判断物质是否属于电解质:
一看:是不是化合物;
二看:是不是导电;(熔化或水溶液中)
三看:是不是自身电离。
电解质
非电解质
化合物
酸、碱、盐、水和许多金属氧化物。
大多数非金属氧化物;大多数有机物,如蔗糖、酒精等。
BaSO4、CaCO3、AgCl等难溶于水的盐是否属弱电解质?
CH3COOH易溶,是否属强电解质?
强电解质的溶液导电能力一定强吗?
思考:
注意:①电解质的强弱和其溶解度无必然联系;
②强电解质的导电能力不一定比弱电解质能力强,导电能力与浓度和离子所带的电荷数有关。
下列物质中属于强电解质的是_____________
属于弱电解质的是_____________
①NaCl
②NH3
③Cl2
④BaSO4
⑤HCl
⑥CH3COOH
⑦
H2S
⑧NaHCO3
⑨Cu(OH)2
⑩Cu
⑾HF
⑿蔗糖
⒀乙醇溶液
⒁SO2
⒂Na2O
例题:
用化学符号表示电解质电离过程的式子
电离方程式:
NaCl
Na+
+
Cl—
电离方程式书写要求:
①强电解质用“
”连接
②弱电解质用“
连接
③多元弱酸分步电离
④多元弱碱一步写完
⑤强酸酸式盐完全电离:NaHSO4
⑥弱酸酸式盐保留酸式酸根:NaHCO3、NaHS
注意:
电离方程式左右两边正负电荷之和相等。
强电解质
弱电解质
定义
物质类型
电离程度
电离过程
存在微粒
实例
方程式
水溶液或熔融全部电离
水溶液或熔融部分电离
完全电离
部分电离
阴、阳离子
阴阳离子、分子
强酸、强碱、大部分盐
弱酸、弱碱、水
可逆过程
不可逆
HF
H+
+F-
NaOH
Na++OH-
NaCl
HCl
NaOH
HF
\氨水\
水
对比填表:
从电离角度认识酸、碱、盐
物质
纯净物
混合物
单质
化合物
非电解质
强电解质
弱电解质
强酸:HCl、HNO3、
H2SO4等
强碱:KOH、NaOH、
Ca(OH)2、Ba(OH)2
多数盐:
NaNO3、
NaCl、BaSO4等
弱酸:
CH3COOH
、
H3PO4
、H2CO3等
弱碱:NH3?H2O等
水
:CO2、SO2、NH3、蔗糖、酒精
总结:物质的分类
练习:
1、下列电离方程式正确的是(
)
A.
Al2(SO4)3=2Al3+
+3SO4
2-
B.MgCl2=Mg2+
+Cl2-
C.Ba(OH)2=Ba2++2(OH)-
D.Na2CO3
=
2Na++CO32-
2、下列属于电解质的是(
)
CO2
、
SO3
、
P2O5
Cu
、
Al、
石墨、
酒精
、
蔗糖等
NaCl溶液
BaSO4
Cu(OH)
2
B.
C.
D.
AgCl
3、下列物质中,其水溶液能导电,但属于非电解质的是(
)
A、CH3COOH
B、Cl2
C、NH4HCO3
D、SO2
A.
4.写出下列物质在水溶液中的电离方程式
H2SO4、NaOH、
Ba(OH)2
、Fe2(SO4)3
、
NaHSO4
、
NaHCO3、NH3·H2O、Fe(OH)2、Na2CO3
5.下列电离方程式正确的是(
)
A、MgCl2
Mg2+
+
Cl2—
B、
CH3COOH
H
+
+
CH3COO—
C、
H2CO3
2H
+
+
CO32—
D、
Ba(OH)2
Ba2+
+2OH—
谢谢大家!
