2.2.2 芳香烃-苯 课件 2020-2021学年人教版高二化学选修5
文档属性
| 名称 | 2.2.2 芳香烃-苯 课件 2020-2021学年人教版高二化学选修5 |  | |
| 格式 | pptx | ||
| 文件大小 | 13.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-24 11:10:34 | ||
图片预览



文档简介
2.2.2 芳香烃-苯
第2章 烃和卤代烃
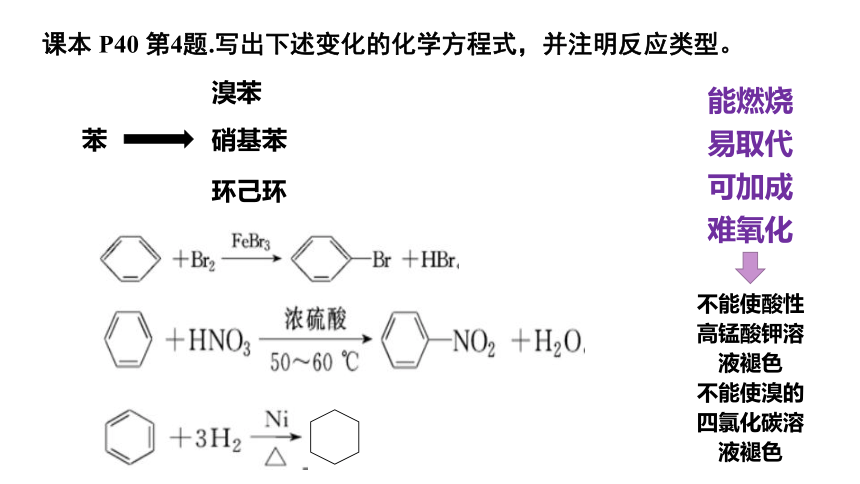
课本 P40 第4题.写出下述变化的化学方程式,并注明反应类型。
苯
溴苯
硝基苯
环己环
能燃烧
易取代
可加成
难氧化
不能使酸性高锰酸钾溶液褪色
不能使溴的四氯化碳溶液褪色
活动
苯的硝化反应的实验设计
根据苯与硝酸发生反应的条件,请你设计制备硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
【资料】硝基苯,无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
1.苯与硝酸的反应在50 ℃ --60℃ 时产物是硝基苯,温度过高会有副产物。
2.硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4.苯和硝酸都易挥发。
+ HO─NO2(浓)
NO2
+ H2O
浓H2SO4
50~60℃
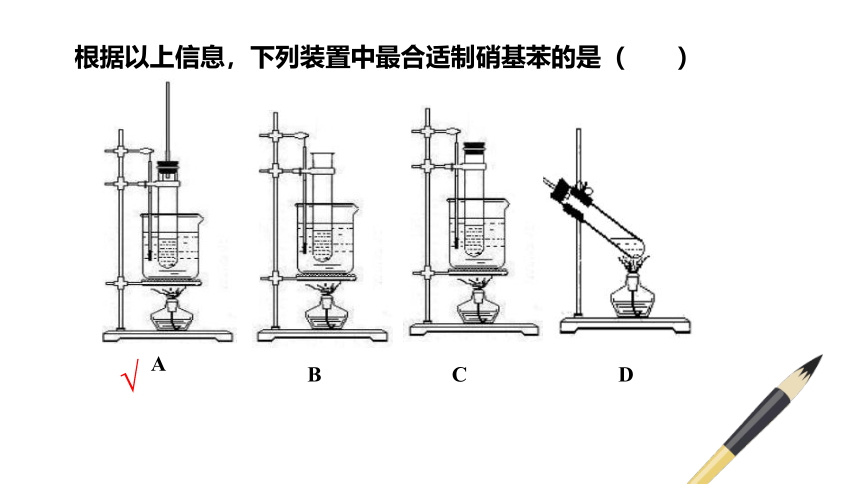
A
B
C
根据以上信息,下列装置中最合适制硝基苯的是( )
√
D
苯的硝化反应
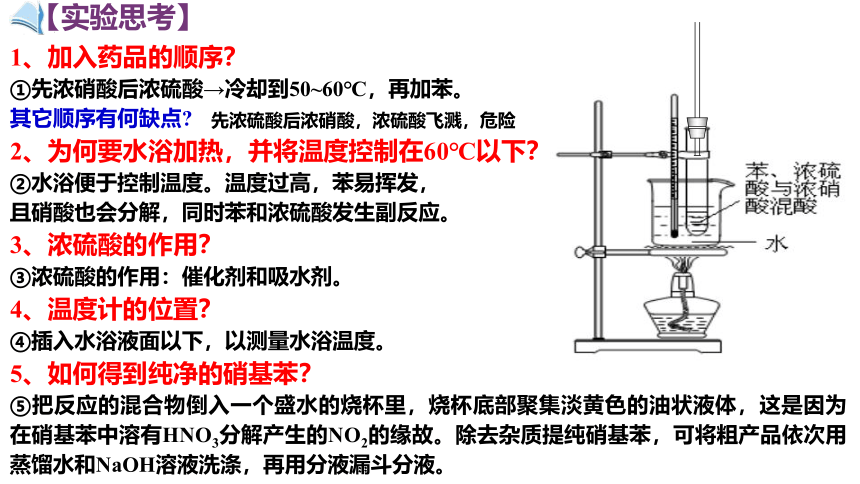
1、加入药品的顺序?
①先浓硝酸后浓硫酸→冷却到50~60℃,再加苯。
其它顺序有何缺点?
2、为何要水浴加热,并将温度控制在60℃以下?
②水浴便于控制温度。温度过高,苯易挥发,
且硝酸也会分解,同时苯和浓硫酸发生副反应。
3、浓硫酸的作用?
③浓硫酸的作用:催化剂和吸水剂。
4、温度计的位置?
④插入水浴液面以下,以测量水浴温度。
5、如何得到纯净的硝基苯?
⑤把反应的混合物倒入一个盛水的烧杯里,烧杯底部聚集淡黄色的油状液体,这是因为在硝基苯中溶有HNO3分解产生的NO2的缘故。除去杂质提纯硝基苯,可将粗产品依次用蒸馏水和NaOH溶液洗涤,再用分液漏斗分液。
【实验思考】
先浓硫酸后浓硝酸,浓硫酸飞溅,危险
1、50 - 60℃时,苯与浓硝酸在浓硫酸催化下可制取硝基苯,反应装置如图。下列对该实验的描述错误的是
A.最好用水浴加热,并用温度计控温
B.长玻璃管起冷凝同流作用
C.提纯硝基苯时只需直接用水去洗涤,便可洗去混在硝基苯中的杂质
D.加人过量硝酸可以提高苯的转化率
C
学以致用
2.下列可用来鉴别乙烯、四氯化碳、苯的是( )
A.酸性高锰酸钾溶液 B.溴水
C.液溴 D.硝化反应
3.下列说法正确的是( )
A.苯和液溴发生加成反应
B.苯和液溴发生反应时,常用的长直玻璃导管主要起平衡内外气压和冷凝的作用
C.苯的硝化反应是吸热反应,可用酒精灯直接加热
D.制硝基苯过程中浓硫酸的作用是脱水剂
AB
B
4、(1)1866年凯库勒提出了苯的单双键交替的正六边形平面结构(如图所示),解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是 。
A.苯不能使溴水褪色
B.苯能与H2发生加成反应
C.溴苯没有同分异构体
D.邻二溴苯只有一种
(2)现代化学认为苯分子碳碳之间的键是
_____________________________________
A、D
介于单键和双键之间的一种独特的键
请回答下列问题:
(1)关闭弹簧夹G,打开弹簧夹B,从装有少量苯的三颈烧瓶的一个口加少量液溴,再加入少量铁屑,塞住了口,三颈烧瓶中发生的主要反应的化学方程式为:_________________________
(2)试管C中苯的作用是:______________。试管D中出现的现象是:____________________
试管E中出现的现象是:___________________________________
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开弹簧夹G,关闭弹簧夹B,可以看到的现象是:________________________________________________________________________.
5、实验室制备溴苯可用下图所示装置。
+ Br2
Br
+ HBr
FeBr3
吸收挥发出来
的溴蒸气
产生白雾,溶液变红
产生淡黄色沉淀
广口瓶中的水沿着导管进去三颈烧瓶中,瓶中液体出现分层
P36 第4
1、CH≡CH + 2H2 CH3CH3
催化剂
2、CH3CH3 + Cl2 CH3CH2Cl +HCl
光照
3、CH≡CH + H2 CH2=CH2
催化剂
4、CH2=CH2 + HCl CH3CHCl
催化剂
5、CH≡CH + Br2 CHBr=CHBr
6、CHBr=CHBr+ Br2 CHBr2CHBr2
7、CH≡CH + HCl CH2=CHCl
催化剂、加热
催化剂
[ CH2-CH ]n
8、nCH≡CH
Cl
第2章 烃和卤代烃
课本 P40 第4题.写出下述变化的化学方程式,并注明反应类型。
苯
溴苯
硝基苯
环己环
能燃烧
易取代
可加成
难氧化
不能使酸性高锰酸钾溶液褪色
不能使溴的四氯化碳溶液褪色
活动
苯的硝化反应的实验设计
根据苯与硝酸发生反应的条件,请你设计制备硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
【资料】硝基苯,无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
1.苯与硝酸的反应在50 ℃ --60℃ 时产物是硝基苯,温度过高会有副产物。
2.硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4.苯和硝酸都易挥发。
+ HO─NO2(浓)
NO2
+ H2O
浓H2SO4
50~60℃
A
B
C
根据以上信息,下列装置中最合适制硝基苯的是( )
√
D
苯的硝化反应
1、加入药品的顺序?
①先浓硝酸后浓硫酸→冷却到50~60℃,再加苯。
其它顺序有何缺点?
2、为何要水浴加热,并将温度控制在60℃以下?
②水浴便于控制温度。温度过高,苯易挥发,
且硝酸也会分解,同时苯和浓硫酸发生副反应。
3、浓硫酸的作用?
③浓硫酸的作用:催化剂和吸水剂。
4、温度计的位置?
④插入水浴液面以下,以测量水浴温度。
5、如何得到纯净的硝基苯?
⑤把反应的混合物倒入一个盛水的烧杯里,烧杯底部聚集淡黄色的油状液体,这是因为在硝基苯中溶有HNO3分解产生的NO2的缘故。除去杂质提纯硝基苯,可将粗产品依次用蒸馏水和NaOH溶液洗涤,再用分液漏斗分液。
【实验思考】
先浓硫酸后浓硝酸,浓硫酸飞溅,危险
1、50 - 60℃时,苯与浓硝酸在浓硫酸催化下可制取硝基苯,反应装置如图。下列对该实验的描述错误的是
A.最好用水浴加热,并用温度计控温
B.长玻璃管起冷凝同流作用
C.提纯硝基苯时只需直接用水去洗涤,便可洗去混在硝基苯中的杂质
D.加人过量硝酸可以提高苯的转化率
C
学以致用
2.下列可用来鉴别乙烯、四氯化碳、苯的是( )
A.酸性高锰酸钾溶液 B.溴水
C.液溴 D.硝化反应
3.下列说法正确的是( )
A.苯和液溴发生加成反应
B.苯和液溴发生反应时,常用的长直玻璃导管主要起平衡内外气压和冷凝的作用
C.苯的硝化反应是吸热反应,可用酒精灯直接加热
D.制硝基苯过程中浓硫酸的作用是脱水剂
AB
B
4、(1)1866年凯库勒提出了苯的单双键交替的正六边形平面结构(如图所示),解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是 。
A.苯不能使溴水褪色
B.苯能与H2发生加成反应
C.溴苯没有同分异构体
D.邻二溴苯只有一种
(2)现代化学认为苯分子碳碳之间的键是
_____________________________________
A、D
介于单键和双键之间的一种独特的键
请回答下列问题:
(1)关闭弹簧夹G,打开弹簧夹B,从装有少量苯的三颈烧瓶的一个口加少量液溴,再加入少量铁屑,塞住了口,三颈烧瓶中发生的主要反应的化学方程式为:_________________________
(2)试管C中苯的作用是:______________。试管D中出现的现象是:____________________
试管E中出现的现象是:___________________________________
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开弹簧夹G,关闭弹簧夹B,可以看到的现象是:________________________________________________________________________.
5、实验室制备溴苯可用下图所示装置。
+ Br2
Br
+ HBr
FeBr3
吸收挥发出来
的溴蒸气
产生白雾,溶液变红
产生淡黄色沉淀
广口瓶中的水沿着导管进去三颈烧瓶中,瓶中液体出现分层
P36 第4
1、CH≡CH + 2H2 CH3CH3
催化剂
2、CH3CH3 + Cl2 CH3CH2Cl +HCl
光照
3、CH≡CH + H2 CH2=CH2
催化剂
4、CH2=CH2 + HCl CH3CHCl
催化剂
5、CH≡CH + Br2 CHBr=CHBr
6、CHBr=CHBr+ Br2 CHBr2CHBr2
7、CH≡CH + HCl CH2=CHCl
催化剂、加热
催化剂
[ CH2-CH ]n
8、nCH≡CH
Cl
