1.1.1《 原子的诞生 能层与能级 构造原理》课件(共29张)2020-2021学年人教版高二化学选修3
文档属性
| 名称 | 1.1.1《 原子的诞生 能层与能级 构造原理》课件(共29张)2020-2021学年人教版高二化学选修3 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1009.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-24 16:34:07 | ||
图片预览







文档简介
第一课时
原子的诞生 能层与能级 构造原理
第一节 原子结构
第一章 原子结构与性质
核心素养发展目标
1.通过对比分析、讨论交流,知道原子核外电子的能层、能级分布及其与能量的关系。
2.通过阅读识图、微观探究、思考交流,了解原子结构的模型及原子结构理论发展的历程,知道原子结构的构造原理,体会科学假设与思辩性推测的差异性与科学性。
3.通过归纳小结,问题探究,知道能层的含义以及与电子层的关系,并能正确表示能层和能级,了解一些元素的原子电子填充遵循的规律即构造原理。
【情景导入】为什么第一层最多只能容纳两个电子,第二层最多只能容纳八个电子而不能容纳更多的电子呢?第三、四、五层及其他电子层最多又可以容纳多少个电子?原子核外电子的排布与原子轨道有什么关系? 带着这些问题,我们将开始本章内容的学习。
活动一、开天辟地—原子的诞生
.【阅读思考】阅读教材“引言”及P4页内容,(1)人类对原子的认识史——不同时期的原子结构模型是怎样的?
【温馨提示】①原子结构:
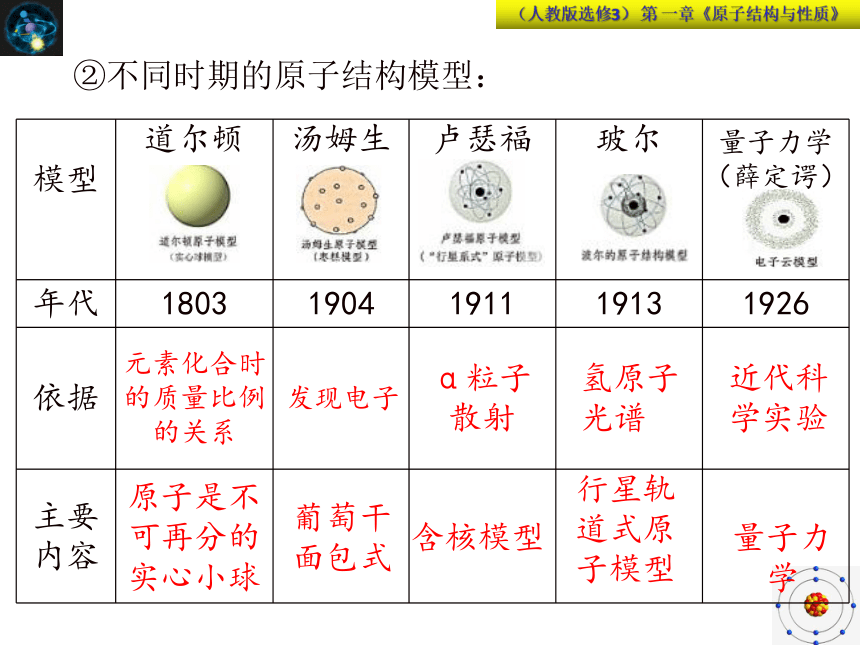
②不同时期的原子结构模型:
模型
道尔顿
汤姆生
卢瑟福
玻尔
量子力学(薛定谔)
年代
1803
1904
1911
1913
1926
依据
主要内容
元素化合时的质量比例的关系
发现电子
α粒子散射
氢原子光谱
近代科学实验
原子是不可再分的实心小球
葡萄干面包式
含核模型
行星轨道式原子模型
量子力学
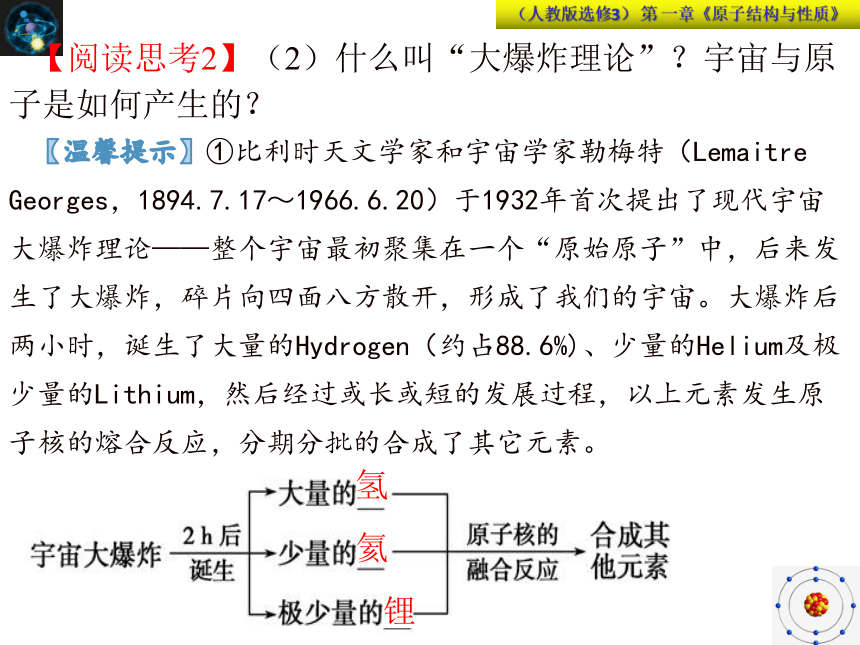
【阅读思考2】(2)什么叫“大爆炸理论”?宇宙与原子是如何产生的?
【温馨提示】①比利时天文学家和宇宙学家勒梅特(Lemaitre Georges,1894.7.17~1966.6.20)于1932年首次提出了现代宇宙大爆炸理论——整个宇宙最初聚集在一个“原始原子”中,后来发生了大爆炸,碎片向四面八方散开,形成了我们的宇宙。大爆炸后两小时,诞生了大量的Hydrogen(约占88.6%)、少量的Helium及极少量的Lithium,然后经过或长或短的发展过程,以上元素发生原子核的熔合反应,分期分批的合成了其它元素。
氢
氦
锂
【讨论交流】阅读教材P4 “科学史话”,思考科学假设与思辩性推测的差异性与科学性?
【温馨提示】思辩性推测作出的预言绝不是科学。科学假设不同于思辩性推测,须以已有科学事实和理论为依据,更要用系统的科学观察和实验来验证。实证是科学的基本特征。
【问题探究】宇宙的组成元素和地球上的元素有何不同?
【温馨提示】
地球元素:非金属元素仅22种(包括稀有气体),绝大多数是金属元素。
【对应训练】
1.下列说法错误的是 ( )
A.地球上的非金属元素共有22种
B.宇宙大爆炸产生了氢、氦、锂元素
C.思辨性推测就是科学假设
D.地球上的元素绝大多数是金属元素
【答案】C【解析】科学假设要以已有的科学事实和理论为依据,更要用系统的科学观察和实验来验证,而思辨性推测是一种预言性推测,不是科学假设,故C项说法错误。
2.如图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆生的观点的是( )
A.①②③ B.③①②
C.③②① D.②①③
【答案】B【解析】卢瑟福提出了原子的核式模型,道尔顿认为原子是一个实心的球体,汤姆生发现了电子,并提出了原子的“葡萄干布丁”模型。
活动二、能层与能级
【阅读思考】阅读教材P4—5页内容,思考在多电子原子中,能层和能级分类的依据分别是什么?
【温馨提示】根据多电子原子核外电子的能量差异,将核外电子分成不同的能层。根据多电子原子中同一能层电子能量的不同,将它们分成不同能级。
【讨论交流1】(1)能层的表示方法是什么?各能层最多容纳的电子数有何特点?
K
L
M
N
O
P
Q
2n2
【交流讨论2】(2)能级的表示方法是什么?各能级最多容纳的电子数有何特点?
【温馨提示】
【问题探究1(1)能层的概念及表示方法是什么?能层与能量有何关系?并举例说明。
【温馨提示】①在多电子原子中,核外电子是分层运动的,能量高的电子在离核远的区域里运动,能量低的电子在离核近的区域里运动。这也说明多电子的原子中电子的能量是不同的。能量不同的电子在核外不同的区域内运动,这种不同的区域称为能层,即“电子层”(n)。例如:氯原子的结构示意图为 ,表示氯原子的17个电子分布在三个能量不同的能层上。
②每一能层最多容纳的电子数为2n2。
③离核越近的能层,能量越低。
④能层的表示方法:
【问题探究2】(2)能级的概念及表示方法是什么?能级与能量有何关系?
【温馨提示】①在多电子原子中,同一能层的电子,能量也可能不同。同一能层的电子在不同能量的能级上运动,能级分别用s、p、d、f表示。就好比能层是楼层,能级是楼梯的阶级。
②在同一能层上不同能级的能量:ns③s、p、d、f最多容纳的电子数依次为2、6、10、14。
④能级的表示方法:
能层
能级
各能级最多容纳的电子数
能层最多容纳的电子数
n=1 K
1s
2
2
n=2 L
2s 2p
2 6
8
n=3 M
3s 3p 3d
2 6 10
18
n=4 N
4s 4p 4d 4f
2 6 10 14
32
n=5 O
5s …
…
…
⑤在目前已知的元素的原子中,能层数最高到第七电子层,而能级的种类也只出现了s、p、d、f,产生这种现象的原因是能级的能量问题。
【拓展探究】决定电子能量高低的因素有有哪些?
【温馨提示】决定电子能量高低的因素有:
①能层,能级符号相同时,能层数越高,电子能量越高;
②能级,在同一能层的不同能级中,s、p、d、f能级能量依次升高;
③在同一能层的相同能级中电子的能量相同;
④在多电子原子中会发生能级交错现象。如核外电子排布为1s22s22p63s23p6的氩原子共有5种能量不同的电子。
【对应训练】
1.下列有关认识正确的是( )
A.各能级可容纳的最多电子数按s、p、d、f……的顺序依次为1、3、5、7……的二倍
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
【答案】A【解析】各能层中的能级数等于其所处的能层数,即当n=1时,它只有1s能级,当n=2时,含有两个能级,分别为2s、2p能级,所以B、C都不正确;D中每个能层最多能填充2n2个电子,但不是一定含有2n2个电子。
2.下列关于多电子原子核外电子排布的说法正确的是( )
A.各能层含有的能级数等于能层序数减去1
B.同是s能级,在不同的能层中最多所能容纳的电子数是不相同的
C.原子核外电子的每一个能层最多可容纳的电子数为n2
D.M能层中含有3d能级
【答案】D【解析】各能层中所含有的能级数等于其能层序数,A项错误;s能级不管是在哪一能层上最多所容纳的电子数都为2个,B项错误;每个能层上最多容纳的电子数为2n2,C项错误;第一能层中,只含1s能级,第二能层中,只含2s、2p两个能级,第三能层(M层)中,含有3s、3p、3d三个能级,D项正确。
活动三、构造原理
【阅读思考】阅读教材P5页内容,思考什么是构造原理?
【温馨提示】随着原子核电荷数的递增,绝大多数元素的原子核外电子的排布将遵循以下排布顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、……人们把它称为构造原理。如图:
【问题探究1】(1)英文字母相同的不同能级中所能容纳的最多电子数是否相同?
【温馨提示】相同。如所有s能级最多容纳2×1个电子,p能级最多容纳2×3个电子,d能级最多容纳2×5个电子,f能级最多容纳2×7个电子。
【问题探究2】(2)能级数与能层序数有什么关系?不同能级的能量有什么关系?
【温馨提示】①任一能层的能级数等于该能层序数。②在每一个能层中,能级符号顺序为ns、np、nd、nf(n代表能层),能量依次升高,即在第n层中,能级的能量顺序是E(ns)【讨论交流1】(1)如何正确理解“构造原理”?什么是能级交错现象?请举例说明。
【温馨提示】①核外电子首先是以能量由低到高顺序进入轨道。构造原理是绝大多数基态原子的核外电子排布顺序;②各能级的能量由能层序数和能级类型共同决定,各能级的能量高低顺序,可由下列公式得到:ns<(n-2)f<(n-1)dE(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原因是电子之间存在着斥力,从而减弱了原子核对外层电子的吸引力,致使能级出现交错现象。
④电子按照构造原理排布,会使整个原子的能量处于最低状态,原子相对较稳定。
【讨论交流2】(2)原子的最外层电子数为什么不超过8个?次外层电子数为什么不超过18个?
【温馨提示】①由于能级交错的原因,End>E(n+1)s。当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,因此最外层电子数不可能超过8个。②同理可以解释为什么次外层电子数不超过18个。若最外层是第n层,次外层就是第(n-1)层。由于E(n-1)f>E(n+1)s>Enp,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,这三个亚层共有9个轨道,最多可容纳18个电子,因此次外层电子数不超过18个。
例如,原子最外层是第五层,次外层就是第四层,由于E4f>E6s>E5p,当第六层出现之前,次外层(第四层)只有在4s,4p和4d轨道上有电子,这三个亚层共有9个轨道,最多可容纳18个电子,也就是次外层不超过18个电子。
【讨论交流3】(3)什么叫电子排布式?如何根据构造原理书写基态原子的电子排布式?
【温馨提示】根据构造原理,只要知道原子序数(等于核电荷数),就可以写出几乎所有元素原子的电子排布,这样的电子排布是基态原子的。用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式,如Al原子的电子排布式: 。Mg原子:1s22s22p63s2。
【对应训练】
1.下列有关构造原理的说法错误的是( )
A.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d
B.某基态原子部分核外电子的排布为3s24s2
C.不是所有基态原子的核外电子排布均符合构造原理
D.构造原理中的电子填入能级的顺序,实质是各能级能量由低到高的顺序
【答案】B【解析】根据构造原理示意图判断,故A项正确。根据构造原理可知,3s与4s能级之间还有3p能级,故B项错误。绝大多数基态原子的核外电子排布都遵循构造原理,但也有少数例外,如Cu和Ag,故C项正确。构造原理中电子填入能级的顺序即各能级能量由低到高的顺序,故D项正确。
2.构造原理揭示的电子排布能级顺序实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)D.E(5s)>E(4s)>E(4f)>E(3d)
【答案】B【解析】根据构造原理,各能级能量的大小顺序:1s<2s<2p<3s<3p<4s<3d<4p<5s……A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高。
课堂检测
1.下列说法中不符合现代大爆炸宇宙学理论的是( )
A.我们所在的宇宙诞生于一次大爆炸
B.恒星正在不断地合成自然界中没有的新元素
C.氢、氦等轻核元素是宇宙中天然元素之母
D.宇宙的所有原子中,最多的是氢元素的原子
【答案】B【解析】根据现代爆炸理论,我们的宇宙诞生于一次大爆炸,A项正确;恒星在不断合成的元素是我们已知的元素,而不是新元素,B项错误;氢、氦等发生原子核的融合反应合成了其他元素,因此氢、氦等轻核元素是宇宙中天然元素之母,C项正确;宇宙的所有原子中,氢元素约占88.6%,D项正确。
2.下列叙述正确的是( )
A.能级就是电子层
B.每个能层最多可容纳的电子数是2n2
C.同一能层中的不同能级的能量高低相同
D.不同能层中的s能级的能量高低相同
【答案】B【解析】能级应该是电子亚层,能层才是电子层;同一能层中的不同能级的能量的高低顺序是E(ns)3.以下能级符号表述正确的是( )
①5s ②1d ③2f ④1p ⑤2d ⑥3f
⑦4f ⑧5d ⑨3p ⑩6s
A.③⑤⑦⑧⑨⑩ B.①③⑤⑦⑨
C.①⑦⑧⑨⑩ D.②④⑥⑧⑩
【答案】C【解析】每一个能层都有s能级,从第二能层开始出现p能级,从第三能层开始出现d能级,从第四能层开始出现f能级。综上所述,C项正确。
4.某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是( )
A.它的质子数一定是18
B.它的原子和37Cl可能互为同位素
C.它的单质一定是强还原剂
D.可以确定该微粒为Ar
【答案】B【解析】此微粒核外共有18个电子,可能是原子也可能是离子,离子又可能为阳离子Ca2+、K+或阴离子S2-、Cl-。
谢谢聆听!
原子的诞生 能层与能级 构造原理
第一节 原子结构
第一章 原子结构与性质
核心素养发展目标
1.通过对比分析、讨论交流,知道原子核外电子的能层、能级分布及其与能量的关系。
2.通过阅读识图、微观探究、思考交流,了解原子结构的模型及原子结构理论发展的历程,知道原子结构的构造原理,体会科学假设与思辩性推测的差异性与科学性。
3.通过归纳小结,问题探究,知道能层的含义以及与电子层的关系,并能正确表示能层和能级,了解一些元素的原子电子填充遵循的规律即构造原理。
【情景导入】为什么第一层最多只能容纳两个电子,第二层最多只能容纳八个电子而不能容纳更多的电子呢?第三、四、五层及其他电子层最多又可以容纳多少个电子?原子核外电子的排布与原子轨道有什么关系? 带着这些问题,我们将开始本章内容的学习。
活动一、开天辟地—原子的诞生
.【阅读思考】阅读教材“引言”及P4页内容,(1)人类对原子的认识史——不同时期的原子结构模型是怎样的?
【温馨提示】①原子结构:
②不同时期的原子结构模型:
模型
道尔顿
汤姆生
卢瑟福
玻尔
量子力学(薛定谔)
年代
1803
1904
1911
1913
1926
依据
主要内容
元素化合时的质量比例的关系
发现电子
α粒子散射
氢原子光谱
近代科学实验
原子是不可再分的实心小球
葡萄干面包式
含核模型
行星轨道式原子模型
量子力学
【阅读思考2】(2)什么叫“大爆炸理论”?宇宙与原子是如何产生的?
【温馨提示】①比利时天文学家和宇宙学家勒梅特(Lemaitre Georges,1894.7.17~1966.6.20)于1932年首次提出了现代宇宙大爆炸理论——整个宇宙最初聚集在一个“原始原子”中,后来发生了大爆炸,碎片向四面八方散开,形成了我们的宇宙。大爆炸后两小时,诞生了大量的Hydrogen(约占88.6%)、少量的Helium及极少量的Lithium,然后经过或长或短的发展过程,以上元素发生原子核的熔合反应,分期分批的合成了其它元素。
氢
氦
锂
【讨论交流】阅读教材P4 “科学史话”,思考科学假设与思辩性推测的差异性与科学性?
【温馨提示】思辩性推测作出的预言绝不是科学。科学假设不同于思辩性推测,须以已有科学事实和理论为依据,更要用系统的科学观察和实验来验证。实证是科学的基本特征。
【问题探究】宇宙的组成元素和地球上的元素有何不同?
【温馨提示】
地球元素:非金属元素仅22种(包括稀有气体),绝大多数是金属元素。
【对应训练】
1.下列说法错误的是 ( )
A.地球上的非金属元素共有22种
B.宇宙大爆炸产生了氢、氦、锂元素
C.思辨性推测就是科学假设
D.地球上的元素绝大多数是金属元素
【答案】C【解析】科学假设要以已有的科学事实和理论为依据,更要用系统的科学观察和实验来验证,而思辨性推测是一种预言性推测,不是科学假设,故C项说法错误。
2.如图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆生的观点的是( )
A.①②③ B.③①②
C.③②① D.②①③
【答案】B【解析】卢瑟福提出了原子的核式模型,道尔顿认为原子是一个实心的球体,汤姆生发现了电子,并提出了原子的“葡萄干布丁”模型。
活动二、能层与能级
【阅读思考】阅读教材P4—5页内容,思考在多电子原子中,能层和能级分类的依据分别是什么?
【温馨提示】根据多电子原子核外电子的能量差异,将核外电子分成不同的能层。根据多电子原子中同一能层电子能量的不同,将它们分成不同能级。
【讨论交流1】(1)能层的表示方法是什么?各能层最多容纳的电子数有何特点?
K
L
M
N
O
P
Q
2n2
【交流讨论2】(2)能级的表示方法是什么?各能级最多容纳的电子数有何特点?
【温馨提示】
【问题探究1(1)能层的概念及表示方法是什么?能层与能量有何关系?并举例说明。
【温馨提示】①在多电子原子中,核外电子是分层运动的,能量高的电子在离核远的区域里运动,能量低的电子在离核近的区域里运动。这也说明多电子的原子中电子的能量是不同的。能量不同的电子在核外不同的区域内运动,这种不同的区域称为能层,即“电子层”(n)。例如:氯原子的结构示意图为 ,表示氯原子的17个电子分布在三个能量不同的能层上。
②每一能层最多容纳的电子数为2n2。
③离核越近的能层,能量越低。
④能层的表示方法:
【问题探究2】(2)能级的概念及表示方法是什么?能级与能量有何关系?
【温馨提示】①在多电子原子中,同一能层的电子,能量也可能不同。同一能层的电子在不同能量的能级上运动,能级分别用s、p、d、f表示。就好比能层是楼层,能级是楼梯的阶级。
②在同一能层上不同能级的能量:ns
④能级的表示方法:
能层
能级
各能级最多容纳的电子数
能层最多容纳的电子数
n=1 K
1s
2
2
n=2 L
2s 2p
2 6
8
n=3 M
3s 3p 3d
2 6 10
18
n=4 N
4s 4p 4d 4f
2 6 10 14
32
n=5 O
5s …
…
…
⑤在目前已知的元素的原子中,能层数最高到第七电子层,而能级的种类也只出现了s、p、d、f,产生这种现象的原因是能级的能量问题。
【拓展探究】决定电子能量高低的因素有有哪些?
【温馨提示】决定电子能量高低的因素有:
①能层,能级符号相同时,能层数越高,电子能量越高;
②能级,在同一能层的不同能级中,s、p、d、f能级能量依次升高;
③在同一能层的相同能级中电子的能量相同;
④在多电子原子中会发生能级交错现象。如核外电子排布为1s22s22p63s23p6的氩原子共有5种能量不同的电子。
【对应训练】
1.下列有关认识正确的是( )
A.各能级可容纳的最多电子数按s、p、d、f……的顺序依次为1、3、5、7……的二倍
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
【答案】A【解析】各能层中的能级数等于其所处的能层数,即当n=1时,它只有1s能级,当n=2时,含有两个能级,分别为2s、2p能级,所以B、C都不正确;D中每个能层最多能填充2n2个电子,但不是一定含有2n2个电子。
2.下列关于多电子原子核外电子排布的说法正确的是( )
A.各能层含有的能级数等于能层序数减去1
B.同是s能级,在不同的能层中最多所能容纳的电子数是不相同的
C.原子核外电子的每一个能层最多可容纳的电子数为n2
D.M能层中含有3d能级
【答案】D【解析】各能层中所含有的能级数等于其能层序数,A项错误;s能级不管是在哪一能层上最多所容纳的电子数都为2个,B项错误;每个能层上最多容纳的电子数为2n2,C项错误;第一能层中,只含1s能级,第二能层中,只含2s、2p两个能级,第三能层(M层)中,含有3s、3p、3d三个能级,D项正确。
活动三、构造原理
【阅读思考】阅读教材P5页内容,思考什么是构造原理?
【温馨提示】随着原子核电荷数的递增,绝大多数元素的原子核外电子的排布将遵循以下排布顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、……人们把它称为构造原理。如图:
【问题探究1】(1)英文字母相同的不同能级中所能容纳的最多电子数是否相同?
【温馨提示】相同。如所有s能级最多容纳2×1个电子,p能级最多容纳2×3个电子,d能级最多容纳2×5个电子,f能级最多容纳2×7个电子。
【问题探究2】(2)能级数与能层序数有什么关系?不同能级的能量有什么关系?
【温馨提示】①任一能层的能级数等于该能层序数。②在每一个能层中,能级符号顺序为ns、np、nd、nf(n代表能层),能量依次升高,即在第n层中,能级的能量顺序是E(ns)
【温馨提示】①核外电子首先是以能量由低到高顺序进入轨道。构造原理是绝大多数基态原子的核外电子排布顺序;②各能级的能量由能层序数和能级类型共同决定,各能级的能量高低顺序,可由下列公式得到:ns<(n-2)f<(n-1)d
④电子按照构造原理排布,会使整个原子的能量处于最低状态,原子相对较稳定。
【讨论交流2】(2)原子的最外层电子数为什么不超过8个?次外层电子数为什么不超过18个?
【温馨提示】①由于能级交错的原因,End>E(n+1)s。当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,因此最外层电子数不可能超过8个。②同理可以解释为什么次外层电子数不超过18个。若最外层是第n层,次外层就是第(n-1)层。由于E(n-1)f>E(n+1)s>Enp,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,这三个亚层共有9个轨道,最多可容纳18个电子,因此次外层电子数不超过18个。
例如,原子最外层是第五层,次外层就是第四层,由于E4f>E6s>E5p,当第六层出现之前,次外层(第四层)只有在4s,4p和4d轨道上有电子,这三个亚层共有9个轨道,最多可容纳18个电子,也就是次外层不超过18个电子。
【讨论交流3】(3)什么叫电子排布式?如何根据构造原理书写基态原子的电子排布式?
【温馨提示】根据构造原理,只要知道原子序数(等于核电荷数),就可以写出几乎所有元素原子的电子排布,这样的电子排布是基态原子的。用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式,如Al原子的电子排布式: 。Mg原子:1s22s22p63s2。
【对应训练】
1.下列有关构造原理的说法错误的是( )
A.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d
B.某基态原子部分核外电子的排布为3s24s2
C.不是所有基态原子的核外电子排布均符合构造原理
D.构造原理中的电子填入能级的顺序,实质是各能级能量由低到高的顺序
【答案】B【解析】根据构造原理示意图判断,故A项正确。根据构造原理可知,3s与4s能级之间还有3p能级,故B项错误。绝大多数基态原子的核外电子排布都遵循构造原理,但也有少数例外,如Cu和Ag,故C项正确。构造原理中电子填入能级的顺序即各能级能量由低到高的顺序,故D项正确。
2.构造原理揭示的电子排布能级顺序实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
【答案】B【解析】根据构造原理,各能级能量的大小顺序:1s<2s<2p<3s<3p<4s<3d<4p<5s……A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高。
课堂检测
1.下列说法中不符合现代大爆炸宇宙学理论的是( )
A.我们所在的宇宙诞生于一次大爆炸
B.恒星正在不断地合成自然界中没有的新元素
C.氢、氦等轻核元素是宇宙中天然元素之母
D.宇宙的所有原子中,最多的是氢元素的原子
【答案】B【解析】根据现代爆炸理论,我们的宇宙诞生于一次大爆炸,A项正确;恒星在不断合成的元素是我们已知的元素,而不是新元素,B项错误;氢、氦等发生原子核的融合反应合成了其他元素,因此氢、氦等轻核元素是宇宙中天然元素之母,C项正确;宇宙的所有原子中,氢元素约占88.6%,D项正确。
2.下列叙述正确的是( )
A.能级就是电子层
B.每个能层最多可容纳的电子数是2n2
C.同一能层中的不同能级的能量高低相同
D.不同能层中的s能级的能量高低相同
【答案】B【解析】能级应该是电子亚层,能层才是电子层;同一能层中的不同能级的能量的高低顺序是E(ns)
①5s ②1d ③2f ④1p ⑤2d ⑥3f
⑦4f ⑧5d ⑨3p ⑩6s
A.③⑤⑦⑧⑨⑩ B.①③⑤⑦⑨
C.①⑦⑧⑨⑩ D.②④⑥⑧⑩
【答案】C【解析】每一个能层都有s能级,从第二能层开始出现p能级,从第三能层开始出现d能级,从第四能层开始出现f能级。综上所述,C项正确。
4.某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是( )
A.它的质子数一定是18
B.它的原子和37Cl可能互为同位素
C.它的单质一定是强还原剂
D.可以确定该微粒为Ar
【答案】B【解析】此微粒核外共有18个电子,可能是原子也可能是离子,离子又可能为阳离子Ca2+、K+或阴离子S2-、Cl-。
谢谢聆听!
