2020-2021学年人教版(五四学制)化学九年级全册 第三单元 酸和碱复习 课件(共23张PPT)
文档属性
| 名称 | 2020-2021学年人教版(五四学制)化学九年级全册 第三单元 酸和碱复习 课件(共23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 750.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-23 17:08:27 | ||
图片预览






文档简介
(共23张PPT)
酸和碱复习
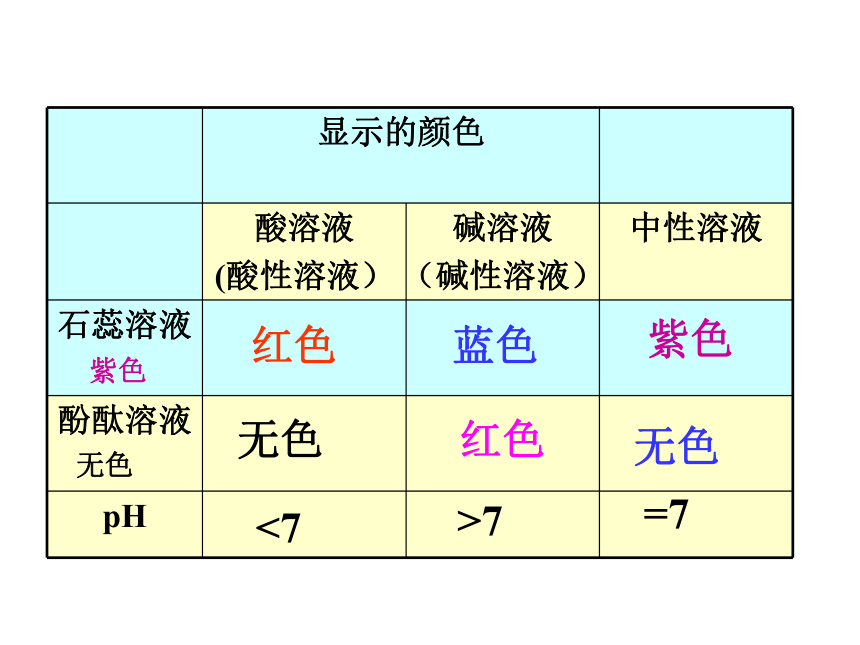
显示的颜色
酸溶液
(酸性溶液)
碱溶液
(碱性溶液)
中性溶液
石蕊溶液
酚酞溶液
pH
紫色
无色
红色
蓝色
无色
红色
紫色
无色
<7
>7
=7
溶液的酸碱性常用________________来测出.
溶液的酸程度常用________来表示.
酸碱指示剂
pH
pH<7,溶液呈_____性,
pH越小,酸性越___
pH=7,溶液呈_____性
pH>7,溶液呈_____性,pH越大,碱性越____
酸
中
碱
强
强
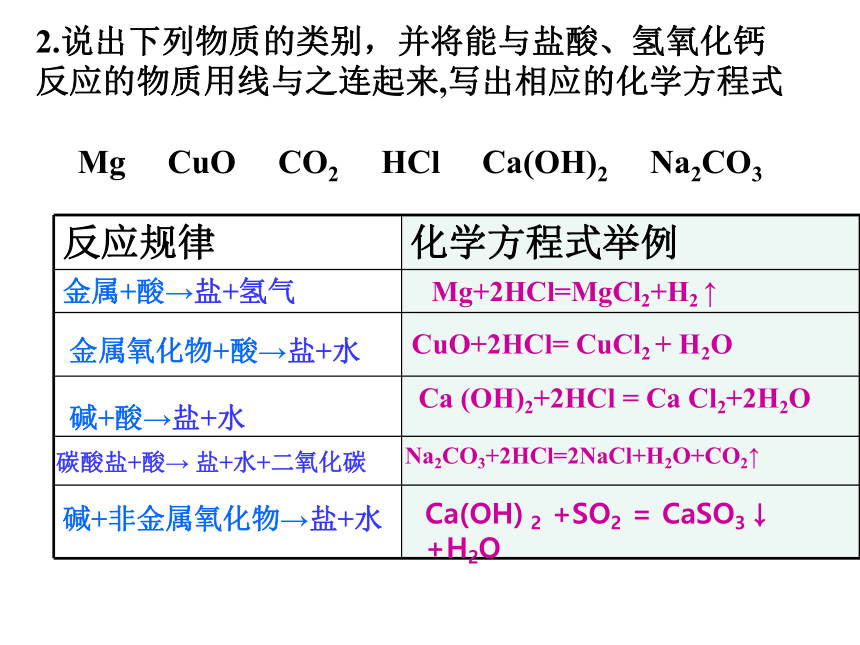
2.说出下列物质的类别,并将能与盐酸、氢氧化钙
反应的物质用线与之连起来,写出相应的化学方程式
Mg
CuO
CO2
HCl
Ca(OH)2
Na2CO3
2.说出下列物质的类别,并将能与盐酸、氢氧化钙
反应的物质用线与之连起来,写出相应的化学方程式
Mg
CuO
CO2
HCl
Ca(OH)2
Na2CO3
反应规律
化学方程式举例
金属+酸→盐+氢气
Mg+2HCl=MgCl2+H2
↑
金属氧化物+酸→盐+水
碱+酸→盐+水
碳酸盐+酸→
盐+水+二氧化碳
碱+非金属氧化物→盐+水
CuO+2HCl=
CuCl2
+
H2O
Ca
(OH)2+2HCl
=
Ca
Cl2+2H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Ca(OH)
2
+SO2
=
CaSO3↓
+H2O
二、酸和碱的化学性质
(1)酸有一些相似的化学性质,其原因是不同的酸溶液中含有相同的_____。
(2)碱有一些相似的化学性质,其原因是不同的碱溶液中含有相同的_____。
H+
OH
–
酸和碱有相似化学性质的原因
(3)中和反应的实质是
.
酸中的氢离子和碱中的氢氧根离子结合生成水分子
酸 H+
+酸根离子
碱 OH-
+金属离子
1.你能用多少种方法
鉴别实验室失去标签的稀盐酸和澄清石灰水两瓶无色溶液?
操作
现象与结论
酸和碱的化学性质的应用
鉴别试剂:
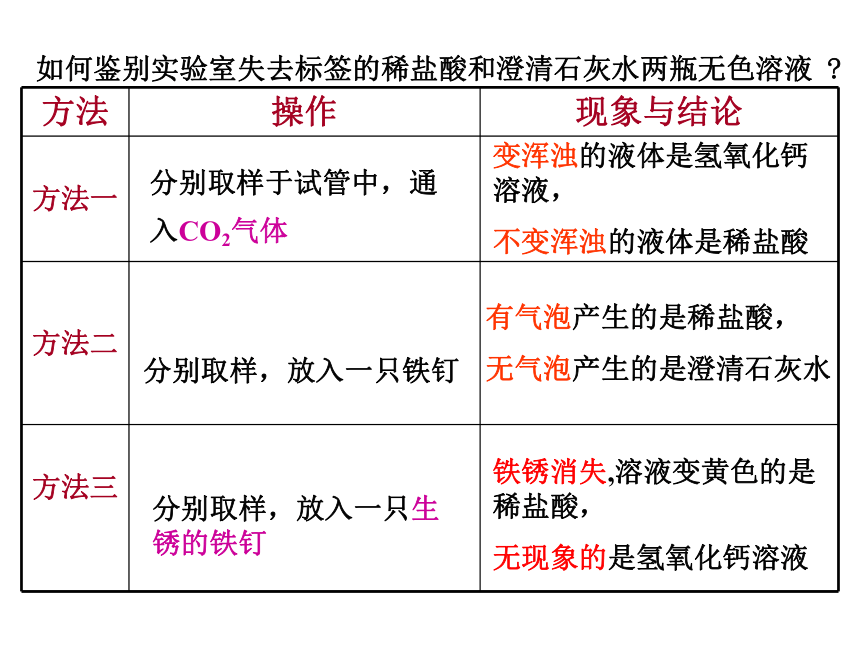
如何鉴别实验室失去标签的稀盐酸和澄清石灰水两瓶无色溶液
?
方法
操作
现象与结论
方法一
方法二
方法三
分别取样于试管中,通入CO2气体
变浑浊的液体是氢氧化钙溶液,
不变浑浊的液体是稀盐酸
分别取样,放入一只铁钉
有气泡产生的是稀盐酸,
无气泡产生的是澄清石灰水
分别取样,放入一只生锈的铁钉
铁锈消失,溶液变黄色的是稀盐酸,
无现象的是氢氧化钙溶液
方法
操作
现象与结论
方法四
方法五
方法六
…
…
分别取,滴入1-2滴酚酞试液
溶液不变色是稀盐酸,
溶液变红色是氢氧化钙溶液
分别用玻璃棒蘸取待检样品于pH试纸上,与标准比色卡对照.
读出pH
PH<7是稀盐酸
PH>7是氢氧化钙溶液
分别取样,加入一粒石灰石
有气泡是稀盐酸
无气泡产生是澄清石灰水
操作
现象
结论
2.现有失去标签的3瓶无色溶液,它们是盐酸,氢氧化钠溶液和氯化钠溶液,若用酸碱指示剂区分,能一次性区分出3瓶无色溶液的试剂是
,
仅用酚酞溶液能否区分这3瓶无色溶液?若能,请写出操作方法现象和结论。
紫色石蕊溶液、
pH试纸
分别取样,滴入无色酚酞溶液
溶液变红色
是NaOH溶液
取少量变红的溶液,分别加到没变红的溶液的试管中
溶液呈红色
是NaCl溶液
溶液呈无色
是HCl溶液
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?????????????????????????????????????????????????????????????????????????????????????
在医药上:
调配防护药膏、泻剂、镇痛剂、解毒剂,
制抗惊厥药等;
在微生物工业中:用作培养基成分,
酿造用添加剂等
在轻工业中:用于生产鲜酵母、味精、
饮料、矿泉水、保健盐等
硫酸镁
的用途
硫酸镁晶体
3.以硫酸为原料之一,写出尽可能多的生成硫酸镁的化学方程式?
反应规律
化学方程式举例
金属+酸→盐+氢气
金属氧化物+酸→盐+水
碱+酸→盐+水
碳酸盐+酸→
盐+水+二氧化碳
H2SO4
+
Mg
==MgSO4
+
H2↑
H2SO4
+
MgO
==MgSO4
+
H2O
H2SO4
+
Mg(OH)2
==MgSO4
+2
H2O
H2SO4
+
MgCO3
==
MgSO4
+
H2O
+
CO2↑
氢氧化钠固体应如何保存?为什么?
如何检验一瓶氢氧化钠溶液是否已变质
?
取待检样品少量于试管中并加入足量稀盐酸,若有气泡产生,该则氢氧化钠溶液已变质,若无气泡产生,该则氢氧化钠溶液没变质。
想一想
答:应密封保存.因为氢氧化钠固体露置在空气中易吸收空气中的水分而潮解,并易吸收空气中的二氧化碳而变质.
市售消化药片中常含氢氧化铝、氢氧化镁该药片适合于治疗胃酸过多的病人,其化学反应原理是
______________________________________
用化学方程式表示为
___________________________________________________
氢氧化镁、氢氧化铝与胃液中的盐酸反应
,
除去过多的胃酸
Mg(OH)2+2HCl
=
MgCl2+2H2O
Al(OH)3+3HCl
=
AlCl3+3H2O
玉祁镀锌厂在把铁管镀锌之前,常要用
______
去除铁锈,除锈的化学反应方程式______________________除锈后的溶液往往变成
色,若除锈后铁管仍然放在酸溶液中,则可见到
的现象,原因是__________________(用化学方程式表示)
稀盐酸
Fe2O3+6HCl=
2FeCl3
+
3H2O
黄
铁管表面有气泡
Fe+2HCl=
FeCl2
+
H2
↑
某些食品的包装袋内有一个装有白色颗粒状固体的小纸袋,上面写着“干燥剂主要成分为生石灰,请勿食用”等字样,问:
(1)生石灰可作干燥剂的理由是
(用化学方程式表示)
(2)“请勿食用”是因为干燥剂食用后对人体有
。
(3)下列气体:SO2
、CO2
、
H2
、
O2
、HCl
中不能用生石灰干燥的是_____________________原因是_____________________________________________
想一想
CaO
+H2O
=Ca(OH)2
有腐蚀性
SO2
、CO2
、HCl
SO2
、CO2
、HCl
会与CaO及吸水后生成的
Ca(OH)2反应
做硫在氧气中燃烧的实验时常在盛有氧气的瓶中预先放入少量浓氢氧化钠溶液作用是
。
化学方程式为
.
吸收生成的气体二氧化硫,防止SO2污染空气
2NaOH
+SO2
=
Na2SO3
+H2O
烧开水的铝壶壁上沉积的水垢(主要成分是碳酸钙)可以加入适量的盐酸把它除掉,用化学方程式表示除水垢的原理为
_____________________________________盐酸要“适量”的原因用化学方程式表示为
_____________________________________
_____________________________________
CaCO3
+2HCl=
CaCl2+H2O+CO2↑
Al2O3+6HCl=
2Al2O3
+
3H2O
2Al
+
6HCl
=2AlCl3
+
3H2
↑
铝制品耐腐蚀的原因
(用化学方程式表示)
2Al
+
2O2
=Al2O3
操作
现象
结论
取少量反应后的废液,加入
.
该废液显酸性
4.某同学在用大理石和稀盐酸做完实验室制取二氧化碳实验后,想把实验后反应器内的废液倒入下水管道,小明认为不可,废液中可能会含有盐酸腐蚀铁制下水管道(已知氯化钙溶液呈中性),于是他们想分析废液的成分,
你认为废液中溶质成分可能是
,也可能是
,
请设计实验进行检验
请写出处理该废液的一种方法
.
酸的通性:
酸能与酸碱指示剂反应。
酸能与活泼金属反应。
酸能与金属氧化物反应。
酸能与碱反应。
酸能与某些盐反应。
我来总结!
酸
H+
+
酸根离子
碱 OH-
+金属离子
碱的通性有:
碱能与酸碱指示剂反应
碱能与某些非金属氧化物反应
碱能与酸反应
碱能与某些盐反应
3.以硫酸为原料之一,试一试你能写出多少个生成硫酸镁的化学方程式?
H2SO4
+
Mg
==MgSO4
+
H2↑
H2SO4
+
MgO
==MgSO4
+
H2O
H2SO4
+
Mg(OH)2
==MgSO4
+2
H2O
H2SO4
+
MgCO3
==
MgSO4
+
H2O
+
CO2↑
(二)酸和碱的化学性质
酸
指示剂
金属
金属
氧化物
盐
碱
非金属
氧化物
酸和碱复习
显示的颜色
酸溶液
(酸性溶液)
碱溶液
(碱性溶液)
中性溶液
石蕊溶液
酚酞溶液
pH
紫色
无色
红色
蓝色
无色
红色
紫色
无色
<7
>7
=7
溶液的酸碱性常用________________来测出.
溶液的酸程度常用________来表示.
酸碱指示剂
pH
pH<7,溶液呈_____性,
pH越小,酸性越___
pH=7,溶液呈_____性
pH>7,溶液呈_____性,pH越大,碱性越____
酸
中
碱
强
强
2.说出下列物质的类别,并将能与盐酸、氢氧化钙
反应的物质用线与之连起来,写出相应的化学方程式
Mg
CuO
CO2
HCl
Ca(OH)2
Na2CO3
2.说出下列物质的类别,并将能与盐酸、氢氧化钙
反应的物质用线与之连起来,写出相应的化学方程式
Mg
CuO
CO2
HCl
Ca(OH)2
Na2CO3
反应规律
化学方程式举例
金属+酸→盐+氢气
Mg+2HCl=MgCl2+H2
↑
金属氧化物+酸→盐+水
碱+酸→盐+水
碳酸盐+酸→
盐+水+二氧化碳
碱+非金属氧化物→盐+水
CuO+2HCl=
CuCl2
+
H2O
Ca
(OH)2+2HCl
=
Ca
Cl2+2H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Ca(OH)
2
+SO2
=
CaSO3↓
+H2O
二、酸和碱的化学性质
(1)酸有一些相似的化学性质,其原因是不同的酸溶液中含有相同的_____。
(2)碱有一些相似的化学性质,其原因是不同的碱溶液中含有相同的_____。
H+
OH
–
酸和碱有相似化学性质的原因
(3)中和反应的实质是
.
酸中的氢离子和碱中的氢氧根离子结合生成水分子
酸 H+
+酸根离子
碱 OH-
+金属离子
1.你能用多少种方法
鉴别实验室失去标签的稀盐酸和澄清石灰水两瓶无色溶液?
操作
现象与结论
酸和碱的化学性质的应用
鉴别试剂:
如何鉴别实验室失去标签的稀盐酸和澄清石灰水两瓶无色溶液
?
方法
操作
现象与结论
方法一
方法二
方法三
分别取样于试管中,通入CO2气体
变浑浊的液体是氢氧化钙溶液,
不变浑浊的液体是稀盐酸
分别取样,放入一只铁钉
有气泡产生的是稀盐酸,
无气泡产生的是澄清石灰水
分别取样,放入一只生锈的铁钉
铁锈消失,溶液变黄色的是稀盐酸,
无现象的是氢氧化钙溶液
方法
操作
现象与结论
方法四
方法五
方法六
…
…
分别取,滴入1-2滴酚酞试液
溶液不变色是稀盐酸,
溶液变红色是氢氧化钙溶液
分别用玻璃棒蘸取待检样品于pH试纸上,与标准比色卡对照.
读出pH
PH<7是稀盐酸
PH>7是氢氧化钙溶液
分别取样,加入一粒石灰石
有气泡是稀盐酸
无气泡产生是澄清石灰水
操作
现象
结论
2.现有失去标签的3瓶无色溶液,它们是盐酸,氢氧化钠溶液和氯化钠溶液,若用酸碱指示剂区分,能一次性区分出3瓶无色溶液的试剂是
,
仅用酚酞溶液能否区分这3瓶无色溶液?若能,请写出操作方法现象和结论。
紫色石蕊溶液、
pH试纸
分别取样,滴入无色酚酞溶液
溶液变红色
是NaOH溶液
取少量变红的溶液,分别加到没变红的溶液的试管中
溶液呈红色
是NaCl溶液
溶液呈无色
是HCl溶液
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?????????????????????????????????????????????????????????????????????????????????????
在医药上:
调配防护药膏、泻剂、镇痛剂、解毒剂,
制抗惊厥药等;
在微生物工业中:用作培养基成分,
酿造用添加剂等
在轻工业中:用于生产鲜酵母、味精、
饮料、矿泉水、保健盐等
硫酸镁
的用途
硫酸镁晶体
3.以硫酸为原料之一,写出尽可能多的生成硫酸镁的化学方程式?
反应规律
化学方程式举例
金属+酸→盐+氢气
金属氧化物+酸→盐+水
碱+酸→盐+水
碳酸盐+酸→
盐+水+二氧化碳
H2SO4
+
Mg
==MgSO4
+
H2↑
H2SO4
+
MgO
==MgSO4
+
H2O
H2SO4
+
Mg(OH)2
==MgSO4
+2
H2O
H2SO4
+
MgCO3
==
MgSO4
+
H2O
+
CO2↑
氢氧化钠固体应如何保存?为什么?
如何检验一瓶氢氧化钠溶液是否已变质
?
取待检样品少量于试管中并加入足量稀盐酸,若有气泡产生,该则氢氧化钠溶液已变质,若无气泡产生,该则氢氧化钠溶液没变质。
想一想
答:应密封保存.因为氢氧化钠固体露置在空气中易吸收空气中的水分而潮解,并易吸收空气中的二氧化碳而变质.
市售消化药片中常含氢氧化铝、氢氧化镁该药片适合于治疗胃酸过多的病人,其化学反应原理是
______________________________________
用化学方程式表示为
___________________________________________________
氢氧化镁、氢氧化铝与胃液中的盐酸反应
,
除去过多的胃酸
Mg(OH)2+2HCl
=
MgCl2+2H2O
Al(OH)3+3HCl
=
AlCl3+3H2O
玉祁镀锌厂在把铁管镀锌之前,常要用
______
去除铁锈,除锈的化学反应方程式______________________除锈后的溶液往往变成
色,若除锈后铁管仍然放在酸溶液中,则可见到
的现象,原因是__________________(用化学方程式表示)
稀盐酸
Fe2O3+6HCl=
2FeCl3
+
3H2O
黄
铁管表面有气泡
Fe+2HCl=
FeCl2
+
H2
↑
某些食品的包装袋内有一个装有白色颗粒状固体的小纸袋,上面写着“干燥剂主要成分为生石灰,请勿食用”等字样,问:
(1)生石灰可作干燥剂的理由是
(用化学方程式表示)
(2)“请勿食用”是因为干燥剂食用后对人体有
。
(3)下列气体:SO2
、CO2
、
H2
、
O2
、HCl
中不能用生石灰干燥的是_____________________原因是_____________________________________________
想一想
CaO
+H2O
=Ca(OH)2
有腐蚀性
SO2
、CO2
、HCl
SO2
、CO2
、HCl
会与CaO及吸水后生成的
Ca(OH)2反应
做硫在氧气中燃烧的实验时常在盛有氧气的瓶中预先放入少量浓氢氧化钠溶液作用是
。
化学方程式为
.
吸收生成的气体二氧化硫,防止SO2污染空气
2NaOH
+SO2
=
Na2SO3
+H2O
烧开水的铝壶壁上沉积的水垢(主要成分是碳酸钙)可以加入适量的盐酸把它除掉,用化学方程式表示除水垢的原理为
_____________________________________盐酸要“适量”的原因用化学方程式表示为
_____________________________________
_____________________________________
CaCO3
+2HCl=
CaCl2+H2O+CO2↑
Al2O3+6HCl=
2Al2O3
+
3H2O
2Al
+
6HCl
=2AlCl3
+
3H2
↑
铝制品耐腐蚀的原因
(用化学方程式表示)
2Al
+
2O2
=Al2O3
操作
现象
结论
取少量反应后的废液,加入
.
该废液显酸性
4.某同学在用大理石和稀盐酸做完实验室制取二氧化碳实验后,想把实验后反应器内的废液倒入下水管道,小明认为不可,废液中可能会含有盐酸腐蚀铁制下水管道(已知氯化钙溶液呈中性),于是他们想分析废液的成分,
你认为废液中溶质成分可能是
,也可能是
,
请设计实验进行检验
请写出处理该废液的一种方法
.
酸的通性:
酸能与酸碱指示剂反应。
酸能与活泼金属反应。
酸能与金属氧化物反应。
酸能与碱反应。
酸能与某些盐反应。
我来总结!
酸
H+
+
酸根离子
碱 OH-
+金属离子
碱的通性有:
碱能与酸碱指示剂反应
碱能与某些非金属氧化物反应
碱能与酸反应
碱能与某些盐反应
3.以硫酸为原料之一,试一试你能写出多少个生成硫酸镁的化学方程式?
H2SO4
+
Mg
==MgSO4
+
H2↑
H2SO4
+
MgO
==MgSO4
+
H2O
H2SO4
+
Mg(OH)2
==MgSO4
+2
H2O
H2SO4
+
MgCO3
==
MgSO4
+
H2O
+
CO2↑
(二)酸和碱的化学性质
酸
指示剂
金属
金属
氧化物
盐
碱
非金属
氧化物
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
