鲁教版九年级下册化学 7.2碱及其性质 课件(24张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 7.2碱及其性质 课件(24张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 741.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-25 09:32:47 | ||
图片预览




文档简介
第七章 常见的酸和碱
第二节 碱及其性质
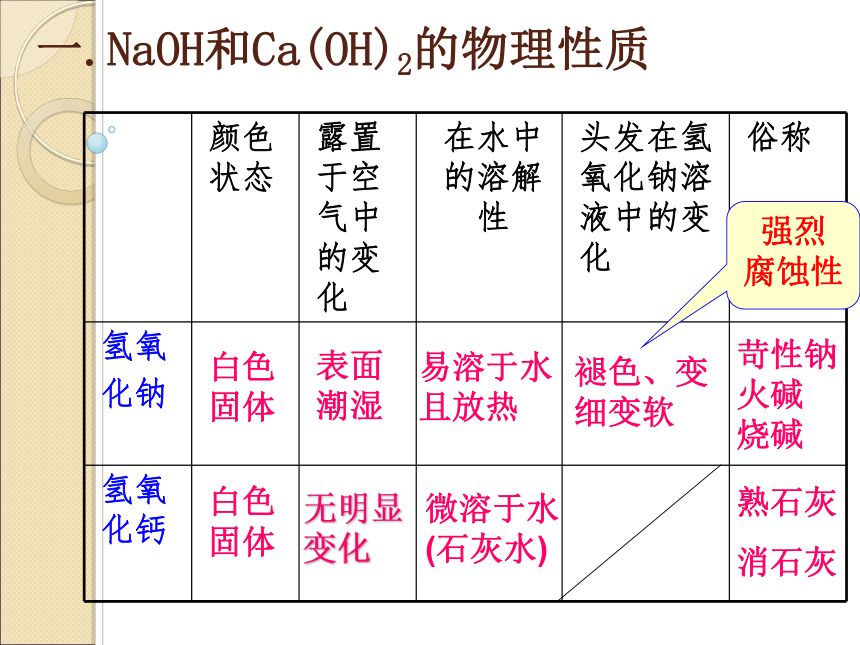
颜色状态
露置于空气中的变化
在水中的溶解性
头发在氢氧化钠溶液中的变化
俗称
氢氧
化钠
氢氧化钙
白色固体
白色固体
表面潮湿
无明显变化
易溶于水且放热
微溶于水(石灰水)
褪色、变细变软
苛性钠
火碱
烧碱
熟石灰
消石灰
一.NaOH和Ca(OH)2的物理性质
强烈
腐蚀性
针对练习一
1.氢氧化钠在空气中放置一段时间后潮解的现象说明它具有( )性质,这种性质决定它的用途是( )
2.羊毛绒放入氢氧化钠溶液中加热的现象说明了( )使用氢氧化钠时应注意( )
3.你认为应该怎样称取一定质量的氢氧化钠固体?
答:___________________
吸水
作干燥剂
腐蚀性
防止沾到皮肤上
放在烧杯里称量
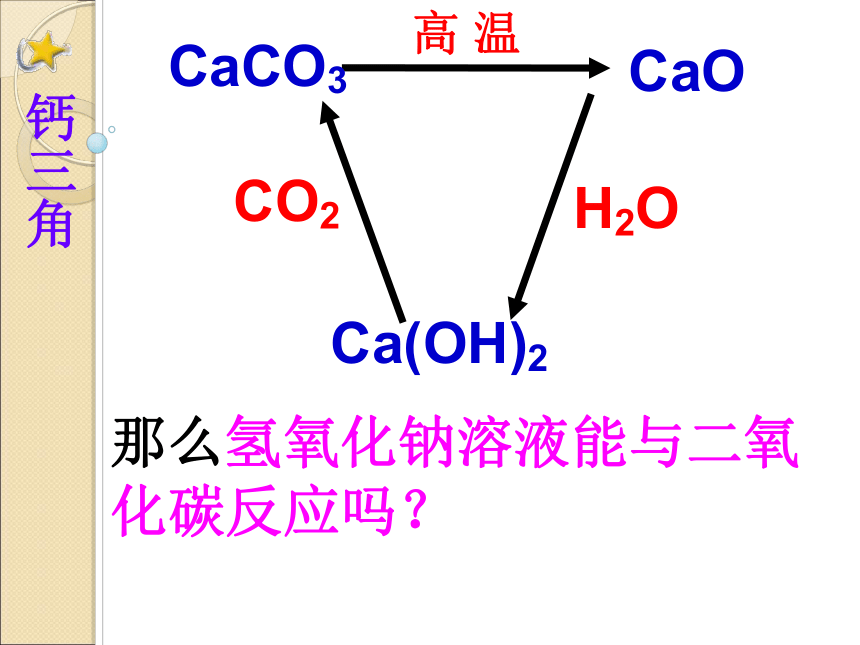
工业上通过高温煅烧石灰石来生产生石灰:
CaCO3 CaO +CO2↑
高温
氧化钙(CaO)俗称生石灰,与水反应放出大量的热。生石灰具有吸水性,可用做某些气体和食品的干燥剂。
生石灰 熟石灰 石灰石
几种物质:
CaO + H2O = Ca(OH)2
CO2
H2O
CaCO3
Ca(OH)2
高 温
CaO
那么氢氧化钠溶液能与二氧化碳反应吗?
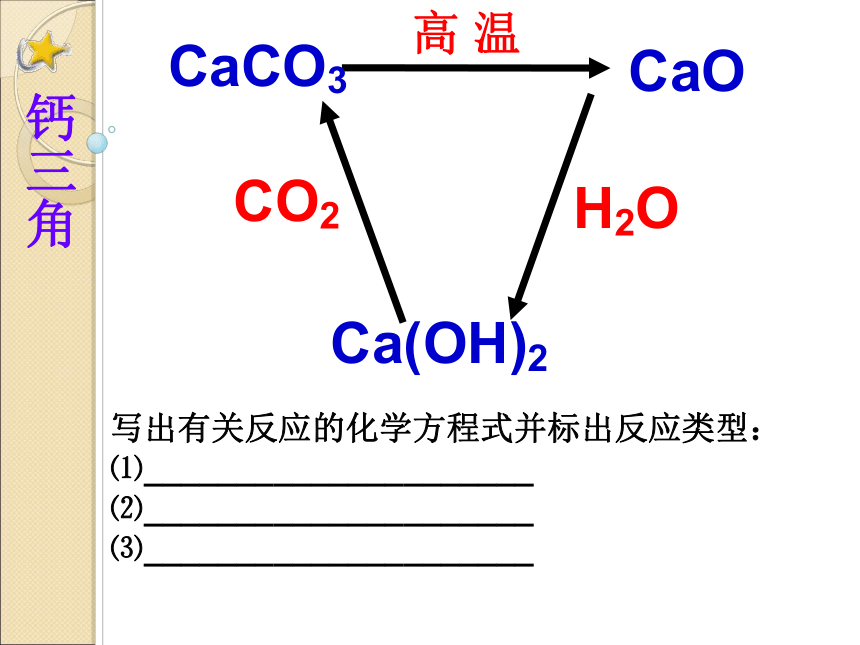
钙三角
CO2
H2O
CaCO3
Ca(OH)2
高 温
CaO
写出有关反应的化学方程式并标出反应类型:
⑴_____________________
⑵_____________________
⑶_____________________
钙三角
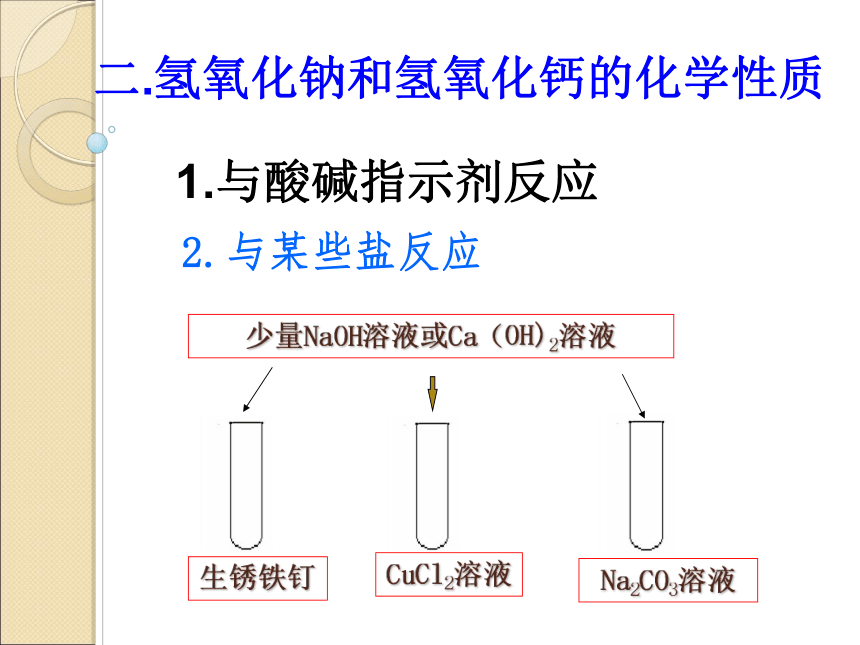
二.氢氧化钠和氢氧化钙的化学性质
1.与酸碱指示剂反应
2.与某些盐反应
生锈铁钉
CuCl2溶液
Na2CO3溶液
少量NaOH溶液或Ca(OH)2溶液
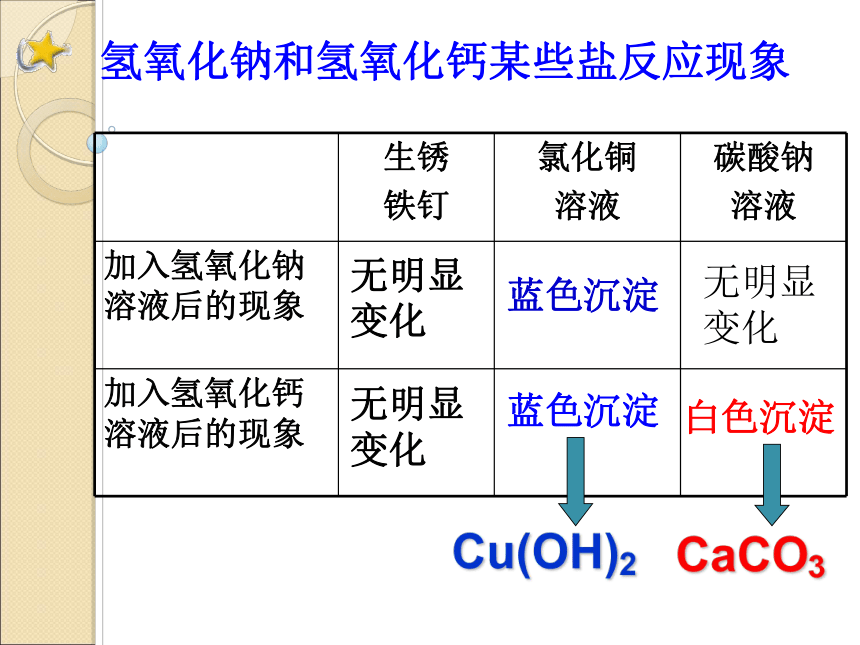
氢氧化钠和氢氧化钙某些盐反应现象
生锈
铁钉
氯化铜
溶液
碳酸钠
溶液
加入氢氧化钠溶液后的现象
加入氢氧化钙溶液后的现象
无明显变化
蓝色沉淀
无明显变化
蓝色沉淀
白色沉淀
无明显变化
Cu(OH)2
CaCO3
2NaOH+CuCl2=Cu(OH)2 ↓ + 2NaCl
Ca(OH)2+CuCl2=Cu(OH)2 + CaCl2
Ca(OH)2+Na2CO3= 2NaOH+CaCO3
(工业制取烧碱的反应原理)
1.氢氧化钠溶液与氯化铜溶液
2.氢氧化钙溶液与氯化铜溶液
3.氢氧化钙溶液与碳酸钠溶液
与盐的反应
CO2 + 2NaOH = Na2CO3 +H2O
CO2 + Ca(OH)2 = CaCO3 +H2O
1)澄清石灰水变浑浊
2)NaOH 能与CO2反应吗?若能,你能写出其反应方程式吗?
讨论:
氢氧化钠溶液和二氧化碳混合后发生了反应,但没有明显现象,你能否设计实验,证明氢氧化钠和二氧化碳之间确实发生了反应?
分别向澄清石灰水与NaOH溶液中盛有CO2 气体,观察现象。
2.与非金属氧化物反应
(1)与酸碱指示剂反应
(2)与非金属氧化物反应
(3)与某些盐反应
(4)与酸反应(见酸的性质)
小结:碱的化学性质
(都含有OH-)
为什么NaOH和Ca(OH)2等不同的碱溶液会有相似的化学性质?
酸、碱的化学性质比较
酸
碱
1与指示剂作用
紫色石蕊:红
酚酞:不变色
紫色石蕊:蓝
酚酞:红
2与金属的反应
反应生成盐和氢气
不反应
3与氧化物作用
与金属氧化物反应生成盐和水
与非金属氧化物反应生成盐和水
4与盐的作用
与某些盐反应生成新盐和新酸
与某些盐反应生成新盐和新碱
2NaOH+CuCl2
Cu(OH)2 + 2NaCl
NaOH + HCl NaCl + H2O
CaCO3+2HCl CaCl2+H2O+CO2
(1)定义:
两种化合物相互交换成分,生成另外两种化合物的反应。
3.复分解反应:
(2)复分解反应发生的条件,即有沉淀析出,或有气体放出,或有水生成
(1)定义:
两种化合物相互交换成分,生成另外两种化合物的反应。
3.复分解反应:
(2)复分解反应发生的条件,即有沉淀析出,或有气体放出,或有水生成
针对练习一
下列反应的方程式属于复分解反应的是( )
A. CaO+H2O = Ca(OH)2
B. Ca(OH)2+Na2CO3=CaCO3 +2NaOH
C. CO2 + Ca(OH)2 = CaCO3 + H2O
D. H2CO3 = H2O+CO2
B
1.下列有关物质的名称、俗名、化学式中,三者皆指同一物质的是 ( )
A.氧化钙、消石灰、CaO B.氯化氢、盐酸、HCl
C.碳酸钙、熟石灰、CaCO3
D.氢氧化钠、烧碱、NaOH
2.下列物质能与澄清的石灰水反应,但观察不到明显现象的是( )
A.稀盐酸 B.氯化钠溶液
C.硫酸铜溶液 D.碳酸钠溶液
3.下列物质长期露置于空气中,因发生化学变化而使溶液的质量减少的是( )
A.浓硫酸 B.石灰水 C.浓盐酸 D.氯化钠溶液
【当堂达标测试】
D
A
B
4. 某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是( )
D
【课外拓展】
常见的沉淀:
①蓝色沉淀:Cu(OH)2。
②红褐色沉淀:Fe(OH)3 。
③白色沉淀:CaCO3 Mg(OH)2 BaCO3。
④难溶于稀硝酸的白色沉淀:AgCl、BaSO4。
【中考链接】
1.(2017江苏苏州)下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而增大的是( )
A.浓盐酸 B.氯化钾溶液
C.浓氨水 D.氢氧化钠溶液
2. (2013)向2mL氨水中滴加5?6滴紫色石蕊试液,充分振荡后溶液颜色将变成
( )
A.红色 B.紫色 C.无色 D.蓝色
D
D
3.(2015湖北黄石)KOH溶液中含有H2O、K+、OH-、能使无色酚酞试液变成红色。某化学兴趣小组想探究KOH溶液使无色酚酞试液变成红色的原因。
【提出问题】KOH溶液中的什么成分使无色酚酞试液变红?
【猜想】猜想1:KOH溶液中的H2O使无色酚酞试液变红。
猜想2:KOH溶液中的K+使无色酚酞试液变红。
猜想3:KOH溶液中的____(填化学式)使无色酚酞试液变红
【实验探究】
实验操作
实验现象
结论
①用试管取少量蒸馏水,滴入1-2滴无色酚酞试液
试管内溶液不变色
猜想1不成立
②用试管取少量KCl溶液,滴入1-2滴无色酚酞试液
——————
猜想2不成立
③________________,滴入1-2滴无色酚酞试液
试管内溶液变红
________
OH-
试管内溶液不变色
猜想3成立
用试管取少量KOH溶液
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学理由是______。
【拓展】①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是________________;
②KOH固体应__________保存。
氯化钾溶液里含有水
溶液变红
密封
4.(2016四川达州)同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究。请你一同探究并回答下列问题:
【提出问题】:滤液中的溶质是什么物质?溶液呈中性。
【查阅资料】:①Ca(NO3)2溶液呈中性。 ②Ca(NO3)2 +Na2CO3= CaCO3↓+2NaNO3
【猜想假设】:甲同学认为:只含有NaOH;
乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2 Na2CO3;
你认为可能含有 。
NaOH Na2CO3
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是________
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的。
实验步骤
实验现象
实验结论
取滤液于试管中
____________
猜想正确
丙
Ca(OH)2 和 Na2CO3发生化学反应
滴入过量的Ca(NO3)2溶液,再滴入无色酚酞试液
有白色沉淀且溶液变红
甲同学也针对自己的猜想进行了如下实验
实验步骤实
验现象
实验结论
取滤液于试管中滴加少量的稀盐酸
无明显现象
猜想正确
你认为甲同学的实验结论是否正确 (填正确或不正确),理由是 。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑______。
否
氢氧化钙与盐酸反应也无明显现象
生成物
第二节 碱及其性质
颜色状态
露置于空气中的变化
在水中的溶解性
头发在氢氧化钠溶液中的变化
俗称
氢氧
化钠
氢氧化钙
白色固体
白色固体
表面潮湿
无明显变化
易溶于水且放热
微溶于水(石灰水)
褪色、变细变软
苛性钠
火碱
烧碱
熟石灰
消石灰
一.NaOH和Ca(OH)2的物理性质
强烈
腐蚀性
针对练习一
1.氢氧化钠在空气中放置一段时间后潮解的现象说明它具有( )性质,这种性质决定它的用途是( )
2.羊毛绒放入氢氧化钠溶液中加热的现象说明了( )使用氢氧化钠时应注意( )
3.你认为应该怎样称取一定质量的氢氧化钠固体?
答:___________________
吸水
作干燥剂
腐蚀性
防止沾到皮肤上
放在烧杯里称量
工业上通过高温煅烧石灰石来生产生石灰:
CaCO3 CaO +CO2↑
高温
氧化钙(CaO)俗称生石灰,与水反应放出大量的热。生石灰具有吸水性,可用做某些气体和食品的干燥剂。
生石灰 熟石灰 石灰石
几种物质:
CaO + H2O = Ca(OH)2
CO2
H2O
CaCO3
Ca(OH)2
高 温
CaO
那么氢氧化钠溶液能与二氧化碳反应吗?
钙三角
CO2
H2O
CaCO3
Ca(OH)2
高 温
CaO
写出有关反应的化学方程式并标出反应类型:
⑴_____________________
⑵_____________________
⑶_____________________
钙三角
二.氢氧化钠和氢氧化钙的化学性质
1.与酸碱指示剂反应
2.与某些盐反应
生锈铁钉
CuCl2溶液
Na2CO3溶液
少量NaOH溶液或Ca(OH)2溶液
氢氧化钠和氢氧化钙某些盐反应现象
生锈
铁钉
氯化铜
溶液
碳酸钠
溶液
加入氢氧化钠溶液后的现象
加入氢氧化钙溶液后的现象
无明显变化
蓝色沉淀
无明显变化
蓝色沉淀
白色沉淀
无明显变化
Cu(OH)2
CaCO3
2NaOH+CuCl2=Cu(OH)2 ↓ + 2NaCl
Ca(OH)2+CuCl2=Cu(OH)2 + CaCl2
Ca(OH)2+Na2CO3= 2NaOH+CaCO3
(工业制取烧碱的反应原理)
1.氢氧化钠溶液与氯化铜溶液
2.氢氧化钙溶液与氯化铜溶液
3.氢氧化钙溶液与碳酸钠溶液
与盐的反应
CO2 + 2NaOH = Na2CO3 +H2O
CO2 + Ca(OH)2 = CaCO3 +H2O
1)澄清石灰水变浑浊
2)NaOH 能与CO2反应吗?若能,你能写出其反应方程式吗?
讨论:
氢氧化钠溶液和二氧化碳混合后发生了反应,但没有明显现象,你能否设计实验,证明氢氧化钠和二氧化碳之间确实发生了反应?
分别向澄清石灰水与NaOH溶液中盛有CO2 气体,观察现象。
2.与非金属氧化物反应
(1)与酸碱指示剂反应
(2)与非金属氧化物反应
(3)与某些盐反应
(4)与酸反应(见酸的性质)
小结:碱的化学性质
(都含有OH-)
为什么NaOH和Ca(OH)2等不同的碱溶液会有相似的化学性质?
酸、碱的化学性质比较
酸
碱
1与指示剂作用
紫色石蕊:红
酚酞:不变色
紫色石蕊:蓝
酚酞:红
2与金属的反应
反应生成盐和氢气
不反应
3与氧化物作用
与金属氧化物反应生成盐和水
与非金属氧化物反应生成盐和水
4与盐的作用
与某些盐反应生成新盐和新酸
与某些盐反应生成新盐和新碱
2NaOH+CuCl2
Cu(OH)2 + 2NaCl
NaOH + HCl NaCl + H2O
CaCO3+2HCl CaCl2+H2O+CO2
(1)定义:
两种化合物相互交换成分,生成另外两种化合物的反应。
3.复分解反应:
(2)复分解反应发生的条件,即有沉淀析出,或有气体放出,或有水生成
(1)定义:
两种化合物相互交换成分,生成另外两种化合物的反应。
3.复分解反应:
(2)复分解反应发生的条件,即有沉淀析出,或有气体放出,或有水生成
针对练习一
下列反应的方程式属于复分解反应的是( )
A. CaO+H2O = Ca(OH)2
B. Ca(OH)2+Na2CO3=CaCO3 +2NaOH
C. CO2 + Ca(OH)2 = CaCO3 + H2O
D. H2CO3 = H2O+CO2
B
1.下列有关物质的名称、俗名、化学式中,三者皆指同一物质的是 ( )
A.氧化钙、消石灰、CaO B.氯化氢、盐酸、HCl
C.碳酸钙、熟石灰、CaCO3
D.氢氧化钠、烧碱、NaOH
2.下列物质能与澄清的石灰水反应,但观察不到明显现象的是( )
A.稀盐酸 B.氯化钠溶液
C.硫酸铜溶液 D.碳酸钠溶液
3.下列物质长期露置于空气中,因发生化学变化而使溶液的质量减少的是( )
A.浓硫酸 B.石灰水 C.浓盐酸 D.氯化钠溶液
【当堂达标测试】
D
A
B
4. 某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是( )
D
【课外拓展】
常见的沉淀:
①蓝色沉淀:Cu(OH)2。
②红褐色沉淀:Fe(OH)3 。
③白色沉淀:CaCO3 Mg(OH)2 BaCO3。
④难溶于稀硝酸的白色沉淀:AgCl、BaSO4。
【中考链接】
1.(2017江苏苏州)下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而增大的是( )
A.浓盐酸 B.氯化钾溶液
C.浓氨水 D.氢氧化钠溶液
2. (2013)向2mL氨水中滴加5?6滴紫色石蕊试液,充分振荡后溶液颜色将变成
( )
A.红色 B.紫色 C.无色 D.蓝色
D
D
3.(2015湖北黄石)KOH溶液中含有H2O、K+、OH-、能使无色酚酞试液变成红色。某化学兴趣小组想探究KOH溶液使无色酚酞试液变成红色的原因。
【提出问题】KOH溶液中的什么成分使无色酚酞试液变红?
【猜想】猜想1:KOH溶液中的H2O使无色酚酞试液变红。
猜想2:KOH溶液中的K+使无色酚酞试液变红。
猜想3:KOH溶液中的____(填化学式)使无色酚酞试液变红
【实验探究】
实验操作
实验现象
结论
①用试管取少量蒸馏水,滴入1-2滴无色酚酞试液
试管内溶液不变色
猜想1不成立
②用试管取少量KCl溶液,滴入1-2滴无色酚酞试液
——————
猜想2不成立
③________________,滴入1-2滴无色酚酞试液
试管内溶液变红
________
OH-
试管内溶液不变色
猜想3成立
用试管取少量KOH溶液
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学理由是______。
【拓展】①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是________________;
②KOH固体应__________保存。
氯化钾溶液里含有水
溶液变红
密封
4.(2016四川达州)同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究。请你一同探究并回答下列问题:
【提出问题】:滤液中的溶质是什么物质?溶液呈中性。
【查阅资料】:①Ca(NO3)2溶液呈中性。 ②Ca(NO3)2 +Na2CO3= CaCO3↓+2NaNO3
【猜想假设】:甲同学认为:只含有NaOH;
乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2 Na2CO3;
你认为可能含有 。
NaOH Na2CO3
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是________
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的。
实验步骤
实验现象
实验结论
取滤液于试管中
____________
猜想正确
丙
Ca(OH)2 和 Na2CO3发生化学反应
滴入过量的Ca(NO3)2溶液,再滴入无色酚酞试液
有白色沉淀且溶液变红
甲同学也针对自己的猜想进行了如下实验
实验步骤实
验现象
实验结论
取滤液于试管中滴加少量的稀盐酸
无明显现象
猜想正确
你认为甲同学的实验结论是否正确 (填正确或不正确),理由是 。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑______。
否
氢氧化钙与盐酸反应也无明显现象
生成物
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
